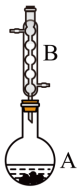
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应装置示意图如图:
反应为: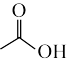 +
+
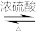
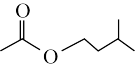 +H2O
+H2O
相关物质性质如表:
实验步骤:在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140-143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)装置B的名称是____ ;主要作用是:____ 。
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时____ (填序号)。
(3)在洗涤操作中,第一次水洗的主要目的是____ 。
(4)实验中加入少量无水硫酸镁的目的是____ 。
(5)本实验的产率是____ 。
(6)在进行蒸馏操作时,若从130℃开始收集馏分,产率会偏____ (填“高”或“低”)。

反应为:
 +
+
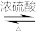
 +H2O
+H2O相关物质性质如表:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
(1)装置B的名称是
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时
| A.立即补加 | B.冷却后补加 | C.不需补加 | D.重新配料 |
(4)实验中加入少量无水硫酸镁的目的是
(5)本实验的产率是
(6)在进行蒸馏操作时,若从130℃开始收集馏分,产率会偏
更新时间:2022-10-29 15:55:14
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵:
反应式:2NH3(g)+CO2(g) H2NCOONH4△H <0
H2NCOONH4△H <0
(1)如果使用如图所示的装置制取NH3,你所选择的试剂是_____________ 。

(2)备氨基甲酸铵的装置如下图。把氨和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备:(注:四氯化碳与液体石蜡均为惰性介质。)
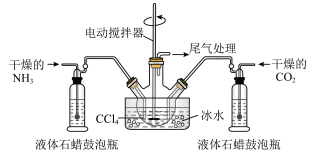
①发生器用冰水冷却的原因是_______ ,液体石蜡鼓泡瓶的作用是__________ ,发生反应的仪器名称是_______________ 。
②从反应后的混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是_____ (选填序号)
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(3)尾气有污染,可用________ 溶液吸收处理。
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵钱样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。样品中氨基甲酸铵的物质的量分数为__________ 。[已知Mr(H2NCOONH4)=78, Mr(NH4HCO3)=79, Mr(CaCO3)=100]
反应式:2NH3(g)+CO2(g)
 H2NCOONH4△H <0
H2NCOONH4△H <0(1)如果使用如图所示的装置制取NH3,你所选择的试剂是

(2)备氨基甲酸铵的装置如下图。把氨和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备:(注:四氯化碳与液体石蜡均为惰性介质。)

①发生器用冰水冷却的原因是
②从反应后的混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(3)尾气有污染,可用
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵钱样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。样品中氨基甲酸铵的物质的量分数为
您最近一年使用:0次
【推荐2】回答下列问题
(1)将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是(写化学式)___________
(2)向浓度相等、体积均为100mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
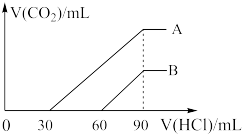
①A曲线表明,原溶液通入CO2___________ mL(标准状况)。
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的物质的量之比为___________ 。
③原NaOH溶液的物质的量浓度为___________ 。
(3)某温度下,将Br2通入NaOH溶液中,反应后得到NaBr、NaBrO、NaBrO3的混合溶液,经测定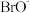 与
与 离子的个数之比是2:7,则Br2与NaOH反应时,氧化剂与还原剂的物质的量之比为
离子的个数之比是2:7,则Br2与NaOH反应时,氧化剂与还原剂的物质的量之比为___________ 。
(4)化学需氧量(COD)是用K2Cr2O7处理一定量水样时所消耗氧化剂的量,并换算成以O2为氧化剂时,1L水样所消耗氧气的mg数(mg/L)。某废水样品20.00mL,加入10.00mL0.0400mol/L的K2Cr2O7溶液,充分反应后,用0.100mol/L的硫酸亚铁铵溶液进行反滴定,终点时消耗硫酸亚铁铵溶液12.00mL。该废水样品的COD为___________ 。
(1)将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是(写化学式)
(2)向浓度相等、体积均为100mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。

①A曲线表明,原溶液通入CO2
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的物质的量之比为
③原NaOH溶液的物质的量浓度为
(3)某温度下,将Br2通入NaOH溶液中,反应后得到NaBr、NaBrO、NaBrO3的混合溶液,经测定
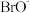 与
与 离子的个数之比是2:7,则Br2与NaOH反应时,氧化剂与还原剂的物质的量之比为
离子的个数之比是2:7,则Br2与NaOH反应时,氧化剂与还原剂的物质的量之比为(4)化学需氧量(COD)是用K2Cr2O7处理一定量水样时所消耗氧化剂的量,并换算成以O2为氧化剂时,1L水样所消耗氧气的mg数(mg/L)。某废水样品20.00mL,加入10.00mL0.0400mol/L的K2Cr2O7溶液,充分反应后,用0.100mol/L的硫酸亚铁铵溶液进行反滴定,终点时消耗硫酸亚铁铵溶液12.00mL。该废水样品的COD为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】形状记忆陶瓷目前尚处于研究阶段,其中一种形状记忆陶瓷的主要原材料是纳米级ZrO2。用锆石(ZrSiO4,含少量Fe、Al和Si的氧化物)制备纳米级ZrO2的流程设计如图:
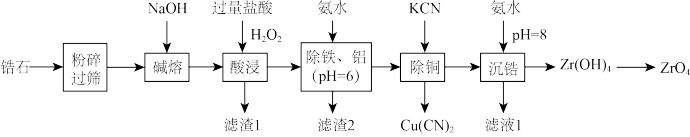
回答下列问题。
(1)锆石“粉碎过筛”的目的是____ 。
(2)“酸浸”过程中发生的氧化还原反应的离子方程式为____ 。滤渣1的主要成分是____ 。若室温下Ksp[Cu(CN)2]=4×10-11,则为了使溶液中的c(Cu2+)≤1×10-5mol/L,则溶液中CN—的浓度不能低于____ 。
(3)在空气中焙烧Zr(OH)4可以得到纳米ZrO2,反应使用的主要陶瓷仪器是____ ,工业生产中常常用无水乙醇洗涤Zr(OH)4,除了可以使纳米级ZrO2纯度更高、颗粒更细外,还可以____ 。
(4)酸浸时,得到的溶质主要是ZrOCl2,而不是预想中的ZrCl4,说明ZrCl4很容易水解,则ZrCl4水解产生ZrOCl2的化学方程式是____ 。
(5)若锆石中含有ZrSiO4的质量分数是54.9%,在制备ZrO2的过程中损失10%的锆元素,则1kg锆石理论上能够制得ZrO2的质量是____ g。

回答下列问题。
(1)锆石“粉碎过筛”的目的是
(2)“酸浸”过程中发生的氧化还原反应的离子方程式为
(3)在空气中焙烧Zr(OH)4可以得到纳米ZrO2,反应使用的主要陶瓷仪器是
(4)酸浸时,得到的溶质主要是ZrOCl2,而不是预想中的ZrCl4,说明ZrCl4很容易水解,则ZrCl4水解产生ZrOCl2的化学方程式是
(5)若锆石中含有ZrSiO4的质量分数是54.9%,在制备ZrO2的过程中损失10%的锆元素,则1kg锆石理论上能够制得ZrO2的质量是
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
【推荐1】以下是有机物 H 的合成路径。
已知:
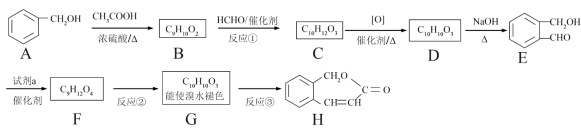
(1)①的反应类型是________ 。②的反应条件是_____________ 。
(2)试剂 a 是_________ 。F 的结构简式是_________ 。
(3)反应③的化学方程式_________ 。 与E互为同分异构体,能水解且苯环上只有一种取代基的结构简式是_________ 。(写出其中一种)
(4)A合成E为何选择这条路径来合成,而不是A和HCHO直接合成,理由是_________ 。
(5)根据已有知识,设计由 为原料合成
为原料合成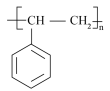 的路线
的路线_________ ,无机试剂任选(合成路线常用的表示方法为:X Y……
Y…… 目标产物)
目标产物)
已知:


(1)①的反应类型是
(2)试剂 a 是
(3)反应③的化学方程式
(4)A合成E为何选择这条路径来合成,而不是A和HCHO直接合成,理由是
(5)根据已有知识,设计由
 为原料合成
为原料合成 的路线
的路线 Y……
Y……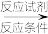 目标产物)
目标产物)
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
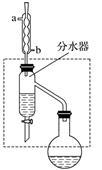
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________ (填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是___________________________________________________ 。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________________ (填标号)。
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是__________________ 。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后________ (填标号)。
A.直接将乙酸丁酯从分液漏斗的上口倒出
B.直接将乙酸丁酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为________ 。
CH3COOH+CH3CH2CH2CH2OH
 CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g·cm-3 | 1.1 | 0.80 | 0.88 |

(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后
A.直接将乙酸丁酯从分液漏斗的上口倒出
B.直接将乙酸丁酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
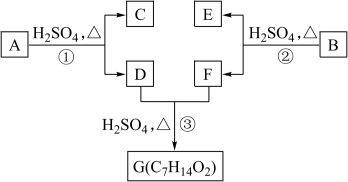
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C苯环上的一溴代物只有两种,则C的结构简式为______________________ ;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为_____________ ,D具有的官能团是 _________________ ;
(3)反应①的化学方程式是_______________________ ;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是______________________________ ;
(5)E可能的结构简式是________________________________ 。

(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C苯环上的一溴代物只有两种,则C的结构简式为
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为
(3)反应①的化学方程式是
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是
(5)E可能的结构简式是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得(已知苯甲酸的酸性强于碳酸),反应装置如图(部分装置省略),反应原理如下:

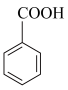 +C2H5OH
+C2H5OH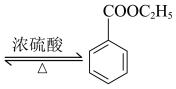 +H2O
+H2O
实验操作步骤:
①向三颈烧瓶内加入12.2 g苯甲酸、25 mL乙醇、20 mL苯及4 mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80 mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25 mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210—213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8 mL。
可能用到的有关数据如下:
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______
(2)步骤①中加浓硫酸的作用是________ ,加沸石的目的是______ 。
(3)步骤②中使用分水器除水的目的是__________ 。
(4)步骤③中加入碳酸钠的目的是____________ 。
(5)步骤④中有机层从分液漏斗的____ (选填“上口倒出”或“下口放出”)。
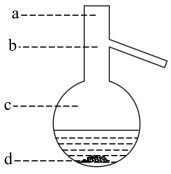
(6)蒸馏操作中温度计水银球的位置应为下图中________ (填a、b、c、d)所示。
(7)本实验所得到的苯甲酸乙酯产率______ %。

 +C2H5OH
+C2H5OH +H2O
+H2O实验操作步骤:
①向三颈烧瓶内加入12.2 g苯甲酸、25 mL乙醇、20 mL苯及4 mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80 mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25 mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210—213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8 mL。
可能用到的有关数据如下:
| 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸乙酯 | 150 | 1.05 | 211~213 | 微溶于水,溶于乙醇、乙醚 |
| 乙醇 | 46 | 0.79 | 78.5 | 易溶于水 |
| 乙醚 | 74 | 0.73 | 34.4 | 微溶于水 |
(1)反应装置中分水器上方的仪器名称是
(2)步骤①中加浓硫酸的作用是
(3)步骤②中使用分水器除水的目的是
(4)步骤③中加入碳酸钠的目的是
(5)步骤④中有机层从分液漏斗的
(6)蒸馏操作中温度计水银球的位置应为下图中

(7)本实验所得到的苯甲酸乙酯产率
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】1-溴丁烷可作稀有元素萃取剂、烃化剂及有机合成的原料。实验室合成1-溴丁烷的装置(加热及夹持装置略去)及有关数据如下:

发生的反应如下:


实验步骤如下:
①在圆底烧瓶中加入14mL水,再慢慢分批加入19mL(0.54mol)浓硫酸,混合均匀并冷却至室温后,再依次加入12mL1-丁醇(0.13mol)和16.5g(0.16mol)溴化钠,充分振荡后加入2粒沸石。加热至沸,调整加热速度,以保持沸腾而又平稳回流,并不时摇动烧瓶促使反应完成。回流约30min。
②待反应液冷却后,改回流装置为蒸馏装置,蒸出粗产物。将馏出液移至分液漏斗中,加入10mL的水洗涤,静置分层后,将产物转入另一干燥的分液漏斗中,用8mL的浓硫酸洗涤,分去硫酸层后有机相依次用10mL的水、饱和碳酸氢钠溶液和水洗涤后,转入干燥的锥形瓶中,加入1~2g的无水氯化钙干燥,间歇摇动锥形瓶,直到液体清亮为止。将过滤后的产物移至小蒸馏瓶中,蒸馏,收集99~103℃的馏分,得到产物12.0g。
回答下列问题:
(1)实验时需小火加热,若大火加热,有机相显红棕色,因为生成了___________ (填化学式),可在后处理时用少量亚硫酸氢钠水溶液洗涤以除去,发生的离子反应方程式为___________ 。
(2)实验中1-丁醇会发生其它副反应,生成的有机副产物结构简式为___________ (任写一种)。
(3)粗蒸馏 终点的判断:1-溴丁烷是否蒸馏完全,可以从下列哪些方面判断___________?
(4)用浓硫酸洗涤粗产品后,有机相应从分液漏斗___________ (填“上口倒出”或“下口放出”)。
(5)用饱和的碳酸氢钠溶液洗涤前先要用水洗一次的原因是___________ 。
(6)加入氯化钙干燥后要滤除干燥剂再蒸馏,若不滤除会产生的影响是___________ 。
(7)本实验中1-溴丁烷的产率为___________ (保留两位有效数字)。

| 名称 | 分子量 | 性状 | 密度g/mL | 熔点 | 熔点 | 溶解度g/100mL溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 1-丁醇 | 74.0 | 无色透明液体 | 0.802 |  | 117.7 | 7.920 |  |  |
| 1-溴丁烷 | 137.0 | 无色透明液体 | 1.299 | 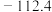 | 101.6 | 不溶 |  |  |


实验步骤如下:
①在圆底烧瓶中加入14mL水,再慢慢分批加入19mL(0.54mol)浓硫酸,混合均匀并冷却至室温后,再依次加入12mL1-丁醇(0.13mol)和16.5g(0.16mol)溴化钠,充分振荡后加入2粒沸石。加热至沸,调整加热速度,以保持沸腾而又平稳回流,并不时摇动烧瓶促使反应完成。回流约30min。
②待反应液冷却后,改回流装置为蒸馏装置,蒸出粗产物。将馏出液移至分液漏斗中,加入10mL的水洗涤,静置分层后,将产物转入另一干燥的分液漏斗中,用8mL的浓硫酸洗涤,分去硫酸层后有机相依次用10mL的水、饱和碳酸氢钠溶液和水洗涤后,转入干燥的锥形瓶中,加入1~2g的无水氯化钙干燥,间歇摇动锥形瓶,直到液体清亮为止。将过滤后的产物移至小蒸馏瓶中,蒸馏,收集99~103℃的馏分,得到产物12.0g。
回答下列问题:
(1)实验时需小火加热,若大火加热,有机相显红棕色,因为生成了
(2)实验中1-丁醇会发生其它副反应,生成的有机副产物结构简式为
(3)
| A.看是否有馏出液,若没有,说明蒸馏已达终点 |
| B.看蒸馏烧瓶中油层是否完全消失,若完全消失,说明蒸馏已达终点 |
| C.取一试管收集几滴馏出液,加水摇动观察无油珠出现。如无,表示馏出液中已无有机物、蒸馏完成 |
| D.取一试管收集几滴馏出液,加硝酸银溶液,如无淡黄色沉淀生成表示馏出液中已无有机物、蒸馏完成 |
(5)用饱和的碳酸氢钠溶液洗涤前先要用水洗一次的原因是
(6)加入氯化钙干燥后要滤除干燥剂再蒸馏,若不滤除会产生的影响是
(7)本实验中1-溴丁烷的产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图:
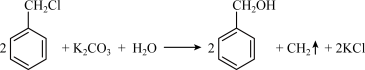
实验步骤:如图所示,在装有电动搅拌器的250mL三颈烧瓶里加入9.0g碳酸钾(过量),70.0mL水,加热溶解,再加入2.0mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0mL氯化苄。搅拌加热回流反应1~1.5h。反应结束后冷却,并转入125mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208℃的馏分,得8.4mL苯甲醇。
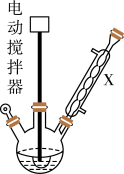
回答下列问题:
(1)仪器X的名称是___ ,冷却水应从___ (填“上口”或“下口”)通入。由于苯甲醇的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是___ (填字母)。

(2)本实验中加入无水硫酸镁的目的是___ 。从绿色化学角度考虑,萃取剂宜采用___ (填字母)。
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法___ (填“是”或“否”)正确,其理由是___ 。
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是___ 。
(5)本实验苯甲醇的产率为___ %(计算结果保留一位小数)。
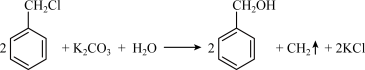
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 | |
氯化苄 | 126.5 | -43 | 179.4 | 1.1 | 不溶 |
碳酸钾 | 138 | 891 | — | 2.4 | 易溶 |
四乙基溴化铵 | — | — | — | — | 易溶 |
苯甲醇 | 108 | -15.3 | 205.3 | 1.0 | 易溶 |

回答下列问题:
(1)仪器X的名称是

(2)本实验中加入无水硫酸镁的目的是
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是
(5)本实验苯甲醇的产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】2—甲基—2—己醇常用于合成洗涤剂、乳化剂等。实验室制备2—甲基—2—己醇的流程如图:
CH3(CH2)3Br(1—丁烷)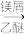 CH3(CH2)3MgBr
CH3(CH2)3MgBr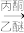

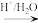

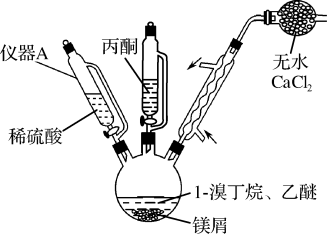
已知:RMgBr化学性质活泼,易与H2O、R′X等发生反应生成RH、R—R′。
(1)仪器A的名称是____ 。
(2)引发CH3(CH2)3Br与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是____ ,若镁屑不足,则反应时生成的有机副产物为____ 。(填结构简式)
(3)干燥管中无水氯化钙的作用为____ 。
(4)加入丙酮及稀硫酸时均需用冰水冷却,这是因为____ 。
(5)起始加入三颈烧瓶的CH3(CH2)3Br的体积为5mL,密度为1.28g·mL-1,最终所得产品的质量为2.71g,则2—甲基—2—己醇的产率为____ 。
CH3(CH2)3Br(1—丁烷)
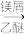 CH3(CH2)3MgBr
CH3(CH2)3MgBr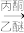

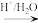


已知:RMgBr化学性质活泼,易与H2O、R′X等发生反应生成RH、R—R′。
(1)仪器A的名称是
(2)引发CH3(CH2)3Br与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是
(3)干燥管中无水氯化钙的作用为
(4)加入丙酮及稀硫酸时均需用冰水冷却,这是因为
(5)起始加入三颈烧瓶的CH3(CH2)3Br的体积为5mL,密度为1.28g·mL-1,最终所得产品的质量为2.71g,则2—甲基—2—己醇的产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
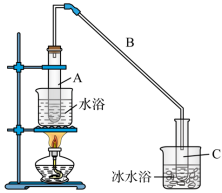
已知: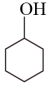
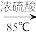
 +H2O
+H2O
(1)制备粗品。将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____ ,导管B除了导气外还具有的作用是_____ 。
②试管C置于冰水浴中的目的是_____ 。
(2)制备精品。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____ 层(填“上”、“下”),分液后用_____ 洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,仪器a的名称为_____ 。收集产品时,控制的温度应在_____ 左右。

(3)以下区分环己烯精品和粗品的方法,合理的是_____ 。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点

已知:

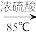
 +H2O
+H2O| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品。将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是
②试管C置于冰水浴中的目的是
(2)制备精品。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,仪器a的名称为

(3)以下区分环己烯精品和粗品的方法,合理的是
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某小组用淀粉水解液和浓 (作催化剂)、
(作催化剂)、 为原料制取草酸晶体(
为原料制取草酸晶体(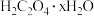 ),进而制备纳米草酸钙(
),进而制备纳米草酸钙( ),按如下流程开展实验(夹持仪器略):
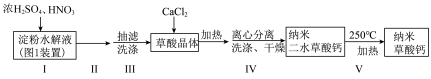
),按如下流程开展实验(夹持仪器略):
已知:①草酸能溶于水,易溶于乙醇;
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式: 。
。
请回答下列问题:
(1)仪器甲相比普通分液漏斗的优点是___________ ,仪器乙的名称为___________ ,步骤Ⅱ的操作名称是___________ 。
(2) 不与
不与 反应,但在本实验中可以完全被吸收,请用离子方程式表示
反应,但在本实验中可以完全被吸收,请用离子方程式表示 被完全吸收的原因
被完全吸收的原因___________ 。
(3)催化剂浓硫酸用量过多,会导致草酸产率减少,原因是___________ 。
(4)下列有关操作说法正确的是___________。
(5)草酸晶体(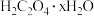 )含有结晶水,某同学准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用
)含有结晶水,某同学准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用 标准溶液滴定,若草酸晶体中混有
标准溶液滴定,若草酸晶体中混有 ,则该滴定法测得产品中x的值
,则该滴定法测得产品中x的值___________ (填“偏大”“偏小”、“无影响”)。
 (作催化剂)、
(作催化剂)、 为原料制取草酸晶体(
为原料制取草酸晶体(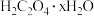 ),进而制备纳米草酸钙(
),进而制备纳米草酸钙( ),按如下流程开展实验(夹持仪器略):
),按如下流程开展实验(夹持仪器略):
已知:①草酸能溶于水,易溶于乙醇;
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式:
 。
。
请回答下列问题:
(1)仪器甲相比普通分液漏斗的优点是
(2)
 不与
不与 反应,但在本实验中可以完全被吸收,请用离子方程式表示
反应,但在本实验中可以完全被吸收,请用离子方程式表示 被完全吸收的原因
被完全吸收的原因(3)催化剂浓硫酸用量过多,会导致草酸产率减少,原因是
(4)下列有关操作说法正确的是___________。
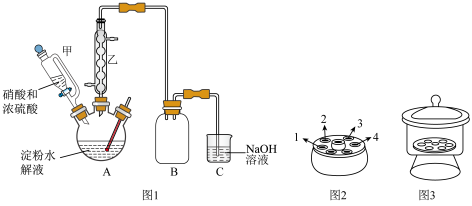
| A.步骤Ⅲ洗涤可用乙醇水溶液,步骤Ⅳ洗涤可用蒸馏水 |
| B.步骤Ⅳ采用离心分离,装置如图2所示,操作时应将两支离心管放置于1、4处 |
| C.步骤Ⅳ干燥采用图3装置,取用时,手握干燥器盖顶圆球向上拉,取下盖子倒放在桌上,将装有产品的器皿放在陶瓷板上 |
| D.步骤Ⅴ为提高反应速率,也可采用更高温度加热 |
(5)草酸晶体(
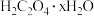 )含有结晶水,某同学准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用
)含有结晶水,某同学准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用 标准溶液滴定,若草酸晶体中混有
标准溶液滴定,若草酸晶体中混有 ,则该滴定法测得产品中x的值
,则该滴定法测得产品中x的值
您最近一年使用:0次



