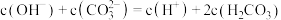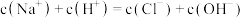HA与醋酸酸性相似,下列叙述错误的是
| A.HA水溶液中微粒浓度大小顺序:c(HA)>c(H+)>c(A-)>c(OH-) |
| B.HA与NH3作用生成的化合物是共价化合物 |
C.NaA水溶液中: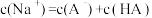 |
| D.稀释0.1mol·L-1 HA水溶液,其电离程度增大,pH也增大 |
22-23高二上·全国·课时练习 查看更多[1]
(已下线)3.3.2 溶液中离子浓度大小的比较-同步学习必备知识
更新时间:2022-12-16 20:13:16
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,物质的量浓度均为0.1 mol·L-1的下列溶液:①Na2CO3溶液;②NaOH溶液;③NaHSO4溶液;④NH4Cl溶液;⑤NaNO3溶液;已知电离常数K(HSO4-)=1.2×10-2,K2(H2CO3)=5.6×10-11,K(NH3·H2O)=1.8×10-5,pH由小到大的排列顺序是
| A.③<④<⑤<①<② | B.④<③<⑤<①<② |
| C.④<③<①<⑤<② | D.①<④<③<⑤<② |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下向100mL 0.1mol·L-1的CH3COOH溶液中逐滴加入0.1mol·L-1的NaOH溶液,所得溶液的pH随加入NaOH溶液的体积V的关系中不正确 的是
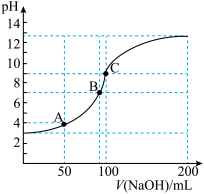

| A.往A点所示的溶液中加入少量HCl或NaOH,溶液的pH几乎不变 |
| B.A点溶液中:c(CH3COO-)-c(CH3COOH) =2×(10-4-10-10)mol·L-1 |
| C.对C点溶液加热 , c(CH3COOH) .c(OH-) /[c(CH3COO-).c(H+)]的值减小 |
| D.常温时,CH3COOH的电离常数为10-5 mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】常温下,有体积相同的四种溶液:①pH=2的CH3COOH溶液;②pH=2的硫酸;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
| A.①和②混合后:c(H+)=c(CH3COO-)+c(OH-)+2c(SO42-) |
| B.①和④溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)=0.01mol·L-1 |
| C.②和③混合溶液中:c(SO42-)>c(NH4+ )>c(OH-)>c(H+) |
| D.四种溶液各稀释100倍,溶液的pH:④>③>①>② |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】柠檬酸是天然防腐剂和食品添加剂,它是一种有机三元弱酸(用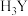 表示),与NaOH溶液反应生成柠檬酸钠。下列说法中正确的是
表示),与NaOH溶液反应生成柠檬酸钠。下列说法中正确的是
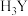 表示),与NaOH溶液反应生成柠檬酸钠。下列说法中正确的是
表示),与NaOH溶液反应生成柠檬酸钠。下列说法中正确的是A.柠檬酸的电离方程式为: |
B.若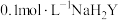 水溶液pH<7,则 水溶液pH<7,则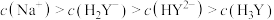 |
C.在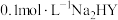 溶液中: 溶液中: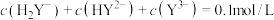 |
D.在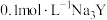 溶液中: 溶液中: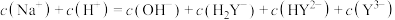 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】阿伏加德罗常数的值为NA。下列叙述正确的是
| A.162g淀粉[(C6H10O5)n]完全水解生成葡萄糖的分子数为nNA |
| B.28g环丙烷中含C—H键的数目为4NA |
| C.1mol·L-1的醋酸钠溶液中含CH3COOH、CH3COO—总数为NA |
| D.电解熔融CuC12,阴极增重6.4g,外电路中通过电子的数目为0.10NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断正确的是
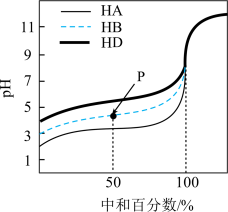

| A.三种酸对应电离常数Ka的大小关系为:HD<HB<HA |
| B.滴定至P点时,溶液中:c(Na+)+ c(H+) = c(OH-)+ c(HB) |
| C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) |
| D.当中和百分数达100%时,三种溶液中:c(A-)<c(B-)<c(D-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】室温下,下列有关溶液说法正确的是
| A.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH |
| B.某溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7时,则溶液的pH为a或14-a |
| C.等体积等物质的量浓度的NaClO溶液和NaCl溶液中离子总数大小N前>N后 |
| D.常温下,pH=3的HA溶液与pH=11的BOH等体积混合,溶液pH>7,则BOH为强碱 |
您最近一年使用:0次


 的盐酸滴定25mL
的盐酸滴定25mL 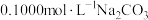 溶液,所得滴定曲线如图.下列说法正确的是
溶液,所得滴定曲线如图.下列说法正确的是 的水解常数约为
的水解常数约为