按要求填写下列空白:
(1)FeCl2溶液呈_______ 性(填“酸”“中”或“碱”),原因是(用离子方程式表示)_______ ,实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以_______ 其水解(填“促进”或“抑制”),然后再用蒸馏水稀释到所需的浓度,再加入铁粉,其目的是_______ 。
(2)把AlCl3、NaHCO3、Na2SO3溶液蒸干、灼烧,最后得到的主要固体产物是_______ 、_______ 、_______ (填化学式)。
(3)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈碱性的原因是_______ (用离子方程式表示);灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是_______ (用离子方程式表示);当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为_______ 。
(4)写出(NH4)2SO4溶液中各粒子浓度关系。
①大小关系(离子):_______ 。
②物料守恒:_______ 。
③电荷守恒:_______ 。
④质子守恒:_______ 。
(1)FeCl2溶液呈
(2)把AlCl3、NaHCO3、Na2SO3溶液蒸干、灼烧,最后得到的主要固体产物是
(3)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈碱性的原因是
(4)写出(NH4)2SO4溶液中各粒子浓度关系。
①大小关系(离子):
②物料守恒:
③电荷守恒:
④质子守恒:
更新时间:2022-12-14 17:13:05
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)已知某废水试样中可能含有表中的离子:
将废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
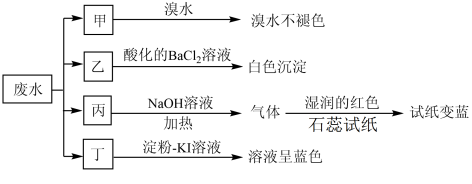
回答下列问题:
离子X是_______ (填化学式,下同),离子Y是_______ 。表中不能确定是否存在的阴离子是_______ ,能证明该阴离子是否存在的简单实验操作为_______ 。写出废水试样中滴加淀粉-KI溶液所发生反应的离子方程式:_______ 。
(2)已知某溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标准状况下)关系如下表所示,回答下列问题:
原溶液中 、
、 、
、 的物质的量浓度之比为
的物质的量浓度之比为_______ 。
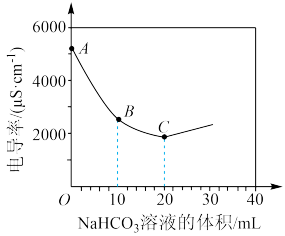
(3)向100mL 溶液中滴加
溶液中滴加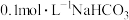 溶液,测得溶液电导率的变化如图。下列说法错误的是_______。
溶液,测得溶液电导率的变化如图。下列说法错误的是_______。
(1)已知某废水试样中可能含有表中的离子:
| 阳离子 |  、 、 、 、 、 、 |
| 阴离子 |  、 、 、 、 、 、 |

回答下列问题:
离子X是
(2)已知某溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标准状况下)关系如下表所示,回答下列问题:
 的体积(标准状况下) 的体积(标准状况下) | 2.8L | 5.6L | 11.2L |
 | 1.25mol | 1.5mol | 2mol |
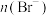 | 1.5mol | 1.4mol | 0.9mol |
 | a mol | 0 | 0 |
 、
、 、
、 的物质的量浓度之比为
的物质的量浓度之比为(3)向100mL
 溶液中滴加
溶液中滴加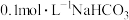 溶液,测得溶液电导率的变化如图。下列说法错误的是_______。
溶液,测得溶液电导率的变化如图。下列说法错误的是_______。
A. 和 和 都是强电解质 都是强电解质 |
B.A→B电导率下降的主要原因是发生了反应 |
C.B→C溶液中的 减小 减小 |
| D.C点时,往溶液滴入少量酚酞,溶液呈红色 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请用所学的化学知识解释下列反应。
(1)Ag2O-Zn-KOH 组成的纽扣电池,正极区 pH 增大,请用电极反应式解释:______________ 。
(2)炒过菜的铁锅不及时清洗(未洗净残液中含 NaCl),不久会生锈,写出正极电极反应 式:_____________ ,其锈蚀过程属于_____ (填“析氢腐蚀”或“吸氧腐蚀”)。
(3)CuO 中含 Fe2O3,要想用此化合物制得纯净的 CuCl2 固体涉及流程为:

①物质 a 为加入_____ 把 pH 调到_____ 。
②操作 c 为在_____ 条件下加热蒸干得固体 CuCl2。
(4)C2H6在足量 O2中完全燃烧,当转移 7 mol e-时放热 a kJ,写出表示 C2H6 燃烧热的热化学方程式:_____ 。
(5)CO2 中混有 HCl,可用饱和 NaHCO3 溶液吸收 HCl,请用平衡移动原理解释原因_____
(1)Ag2O-Zn-KOH 组成的纽扣电池,正极区 pH 增大,请用电极反应式解释:
(2)炒过菜的铁锅不及时清洗(未洗净残液中含 NaCl),不久会生锈,写出正极电极反应 式:
(3)CuO 中含 Fe2O3,要想用此化合物制得纯净的 CuCl2 固体涉及流程为:

| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 pH | 1.9 | 4.7 |
| 完全沉淀 pH | 3.2 | 6.7 |
①物质 a 为加入
②操作 c 为在
(4)C2H6在足量 O2中完全燃烧,当转移 7 mol e-时放热 a kJ,写出表示 C2H6 燃烧热的热化学方程式:
(5)CO2 中混有 HCl,可用饱和 NaHCO3 溶液吸收 HCl,请用平衡移动原理解释原因
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】油画的白色颜料中曾含二价铅盐。二价铅盐经过长时间空气(含有H2S)的侵蚀,生成PbS而变黑。可用一定浓度的H2O2溶液擦洗修复。
(1)H2O2与 反应生成
反应生成 和H2O,写出该反应的化学方程式
和H2O,写出该反应的化学方程式___________ 。
(2)在 悬浊液中滴加一定量的
悬浊液中滴加一定量的 溶液,发生复分解反应,溶液变澄清,有弱电解质生成,该弱电解质的化学式为
溶液,发生复分解反应,溶液变澄清,有弱电解质生成,该弱电解质的化学式为___________ ;当 和
和 恰好完全反应时,溶液显
恰好完全反应时,溶液显___________ 性(填酸性、碱性、中性)。
(3)H2S是二元弱酸,向 溶液中加入
溶液中加入 溶液,生成白色沉淀,其化学式为
溶液,生成白色沉淀,其化学式为___________ ,该物质在空气中很快变成红褐色,用方程式表示其原因:___________ 。
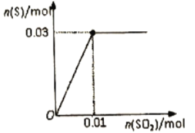
(4)向200 溶液中缓缓通入
溶液中缓缓通入 ,发生反应的化学方程式为
,发生反应的化学方程式为___________ ,生成S的物质的量与通入 的物质的量的关系如下图所示,(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
的物质的量的关系如下图所示,(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为___________ 。从开始通 至饱和,再继续通一段时间,整个过程溶液中
至饱和,再继续通一段时间,整个过程溶液中 的变化情况为
的变化情况为___________ 。
(1)H2O2与
 反应生成
反应生成 和H2O,写出该反应的化学方程式
和H2O,写出该反应的化学方程式(2)在
 悬浊液中滴加一定量的
悬浊液中滴加一定量的 溶液,发生复分解反应,溶液变澄清,有弱电解质生成,该弱电解质的化学式为
溶液,发生复分解反应,溶液变澄清,有弱电解质生成,该弱电解质的化学式为 和
和 恰好完全反应时,溶液显
恰好完全反应时,溶液显(3)H2S是二元弱酸,向
 溶液中加入
溶液中加入 溶液,生成白色沉淀,其化学式为
溶液,生成白色沉淀,其化学式为(4)向200
 溶液中缓缓通入
溶液中缓缓通入 ,发生反应的化学方程式为
,发生反应的化学方程式为 的物质的量的关系如下图所示,(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
的物质的量的关系如下图所示,(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为 至饱和,再继续通一段时间,整个过程溶液中
至饱和,再继续通一段时间,整个过程溶液中 的变化情况为
的变化情况为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)在①NH4Cl②NaCl③CH3COONa三种盐溶液中,常温下呈酸性的是_____ (填序号,下同),呈中性的是_____ ,呈碱性的是_____ 。
(2)氯化铁水解的离子方程式为______ ,配制氯化铁溶液时滴加少量盐酸的作用是____ 。
(2)氯化铁水解的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)写出Na2SO3溶于水发生电离和水解的所有方程式_______ 。
(2)写出BaSO4的沉淀溶解平衡方程式_______ 。
(3)用离子方程式表示下列金属离子和酸根不能在水中大量共存的原因
①
_______ 。
②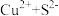
_______ 。
③
_______ 。
(1)写出Na2SO3溶于水发生电离和水解的所有方程式
(2)写出BaSO4的沉淀溶解平衡方程式
(3)用离子方程式表示下列金属离子和酸根不能在水中大量共存的原因
①

②
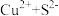
③

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】生活处处有化学,化学知识无处不在。用所学知识解释工业、生产、生活与科研中的相关现象。
(1)写出H2C2O4在溶液中发生第一步电离的方程式:_______ ,写出该步电离常数的表达式Ka1=_______ 。
(2)水的离子积表达式Kw=_______ 。常温下0.01 mol/L HCl 溶液的水电离出的 c(H +)=_______ pH=11的CH3 COONa 溶液中由水电离产生的 c(OH-)=_______ 。
(3)CH3COONa溶液呈碱性的原因_______ (用离子方程式)。
(4)将饱和FeCl3的水溶液加入沸水中可以制备胶体,原因是:_______ (用离子方程式表示)。如果加热制备所得胶体,观察到颜色变化为_______ 。
(5)学过的平衡常数有化学平衡常数(K)、电离平衡常数(Ka\Kb)、水的离子积常数(Kw)、盐的水解常数(Kh),后面还会学习沉淀溶解平衡,其常数叫溶度积Ksp。其实这些常数有很多相似之处。任写一点_______ 。(符合题意的答案,均可给分)
(6)如除去MgCl2溶液中Fe3+需要的除杂试剂是_______ 。
(7)泡沫灭火器中筒体内的硫酸铝酸性溶液与碳酸氢钠碱性溶液混合发生化学反应,将生成的泡沫压出喷嘴, 喷射出去进行灭火的。写出对应的离子方程式_______ 。
(1)写出H2C2O4在溶液中发生第一步电离的方程式:
(2)水的离子积表达式Kw=
(3)CH3COONa溶液呈碱性的原因
(4)将饱和FeCl3的水溶液加入沸水中可以制备胶体,原因是:
(5)学过的平衡常数有化学平衡常数(K)、电离平衡常数(Ka\Kb)、水的离子积常数(Kw)、盐的水解常数(Kh),后面还会学习沉淀溶解平衡,其常数叫溶度积Ksp。其实这些常数有很多相似之处。任写一点
(6)如除去MgCl2溶液中Fe3+需要的除杂试剂是
(7)泡沫灭火器中筒体内的硫酸铝酸性溶液与碳酸氢钠碱性溶液混合发生化学反应,将生成的泡沫压出喷嘴, 喷射出去进行灭火的。写出对应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现有以下物质:①氯化铁溶液 ②干冰 ③冰醋酸 ④亚硫酸钠晶体 ⑤液态氯化氢 ⑥纯蔗糖 ⑦硫酸铝晶体 ⑧熔融的氢氧化钡 ⑨硫酸氢钠溶液
(1)其中,能导电的是:___ ;属于电解质的是:___ ;属于非电解质的是:___ 。
(2)写出下列几种物质在水溶液中的电离方程式:
硫酸氢钠_____ ;亚硫酸______ ;硫氢化钠_____ ;氢氧化钡_____ ;
(3)将上述的①⑦的水溶液加热并蒸干,其中能得到相应的盐的是____ (填序号);不能得到相应盐的溶液,加热蒸干并灼烧后的产物为_____ 。
(4)⑦在日常生活中经常可见,其中,泡沫灭火器中的一种液体为硫酸铝溶液,另一种为碳酸氢钠溶液,倒置使这两种液体混合后,即可产生大量的泡沫,请用离子方程式描述这一过程___ 。
(1)其中,能导电的是:
(2)写出下列几种物质在水溶液中的电离方程式:
硫酸氢钠
(3)将上述的①⑦的水溶液加热并蒸干,其中能得到相应的盐的是
(4)⑦在日常生活中经常可见,其中,泡沫灭火器中的一种液体为硫酸铝溶液,另一种为碳酸氢钠溶液,倒置使这两种液体混合后,即可产生大量的泡沫,请用离子方程式描述这一过程
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】常温下,向100mL0.01mol·L-1HA溶液中逐滴加入0.02mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)由图中信息可知HA为________ (填“强”或“弱”)酸,MOH为_________ (填“强”或“弱”)碱。
(2)常温下一定浓度的MA稀溶液的pH=a,则a______ (填“>”“<”或“=”)7,用离子方程式表示其原因:__________________ ,此时溶液中由水电离出的c(OH-)=____________ 。
(3)K点对应的溶液中,c(M+)+c(MOH)________ (填“>”“<”或“=”)2c(A-),溶液中离子浓度的大小关系:__________________________ 。

(1)由图中信息可知HA为
(2)常温下一定浓度的MA稀溶液的pH=a,则a
(3)K点对应的溶液中,c(M+)+c(MOH)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】填空
(1)实验室可用NaOH溶液吸收 ,反应为
,反应为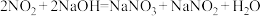 。含0.2molNaOH的水溶液与0.2mol
。含0.2molNaOH的水溶液与0.2mol 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 的
的 溶液,则两溶液中
溶液,则两溶液中 和
和 由大到小的顺序为
由大到小的顺序为_______ (已知 的电离常数
的电离常数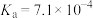 ,
, 的电离常数
的电离常数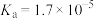 )。可使溶液A和溶液B的pH相等的方法是
)。可使溶液A和溶液B的pH相等的方法是_______ (填序号)。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(2)直接排放含 的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的
的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的 。吸收液(NaOH溶液)吸收
。吸收液(NaOH溶液)吸收 的过程中,pH随
的过程中,pH随 的变化如下表:
的变化如下表:
①由上表判断 溶液显
溶液显_______ 性,用化学平衡原理解释:_______ 。
②当吸收液呈中性时,溶液中离子浓度关系正确的是_______ (填序号)。
a.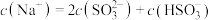
b.
c.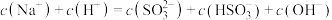
(1)实验室可用NaOH溶液吸收
 ,反应为
,反应为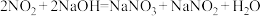 。含0.2molNaOH的水溶液与0.2mol
。含0.2molNaOH的水溶液与0.2mol 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 的
的 溶液,则两溶液中
溶液,则两溶液中 和
和 由大到小的顺序为
由大到小的顺序为 的电离常数
的电离常数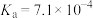 ,
, 的电离常数
的电离常数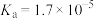 )。可使溶液A和溶液B的pH相等的方法是
)。可使溶液A和溶液B的pH相等的方法是a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(2)直接排放含
 的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的
的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的 。吸收液(NaOH溶液)吸收
。吸收液(NaOH溶液)吸收 的过程中,pH随
的过程中,pH随 的变化如下表:
的变化如下表: | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断
 溶液显
溶液显②当吸收液呈中性时,溶液中离子浓度关系正确的是
a.
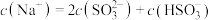
b.

c.
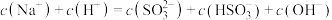
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】电离平衡常数是衡量弱电解质电离程度的量。已知如表数据(25℃):
(1)25℃,等浓度的以下三种溶液pH由大到小的顺序为_______ 。(填写序号)
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______ 。
(3)现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是_______。
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
①c_______ 0.2(填“>”“<”或“=”,下同)。该混合液中离子浓度c(A-)_______ c(Na+)。
②a组实验所得混合溶液中由水电离出的c(OH-)=_______ mol/L。写出该混合溶液中下列算式的精确结果:c(Na+) - c(A-) = _______ mol/L。
| 化学式 | 电离平衡常数 |
| HCN | Ka = 4.9×10-10 |
| CH3COOH | Ka = 1.8×10-5 |
| H2CO3 | Ka1 = 4.4×10-7,Ka2 = 4.7×10-11 |
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
(3)现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是_______。
| A.c(H+)>c(OH-) | B.c(H+)<c(OH-) |
| C.c(H+)+c(HCN)=c(OH-) | D.c(HCN)+c(CN-)=0.01mol/L |
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 反应后溶液pH |
| a | 0.1 | 0.1 | 8 |
| b | c | 0.2 | 7 |
②a组实验所得混合溶液中由水电离出的c(OH-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】已知常温下,0.1mol•L-1HA溶液pH约为3,则:
(1)HA的电离平衡常数约为_______ ,0.1mol•L-1HA溶液中HA的电离度约为_______ 。
(2)向上述HA溶液中加入等浓度的NaOH溶液。
①若两者体积相等,溶液呈_______ 性,原因为(离子方程式)_______ ,此时溶液中离子浓度由大到小的顺序为_______ ,若所得溶液pH=a,则c(Na+)-c(A-)=_______ mol•L-1。
②若混合溶液呈中性,加入的NaOH溶液的体积_______ (填>、<或=)原HA溶液的体积。
③若两者以体积比2∶1混合,溶液呈_______ 性,此时溶液中各分子、离子浓度(不考虑H2O)由大到小的顺序为_______ 。
④上述①②③所得混合液中水的电离程度最大的是_______ 。
(1)HA的电离平衡常数约为
(2)向上述HA溶液中加入等浓度的NaOH溶液。
①若两者体积相等,溶液呈
②若混合溶液呈中性,加入的NaOH溶液的体积
③若两者以体积比2∶1混合,溶液呈
④上述①②③所得混合液中水的电离程度最大的是
您最近一年使用:0次

 和Cl-等无毒无害物质,可用该反应处理含氰废水(破氰),反应的离子方程式为
和Cl-等无毒无害物质,可用该反应处理含氰废水(破氰),反应的离子方程式为

