为实现“碳达峰”、“碳中和”目标,可将CO2催化加氢制甲醇。该反应体系中涉及以下两个主要反应:
反应I: △H1<0
△H1<0
反应II: △H2>0
△H2>0
(1)已知101kPa和298K时一些物质的标准摩尔生成热(在101kPa和一定温度下,由最稳定单质生成1mol纯物质的热效应,称为该物质的标准摩尔生成热)数据如表所示:
则反应I的
_______ 。
(2)在密闭容器中上述反应混合体系建立平衡后,下列说法正确的是_______。
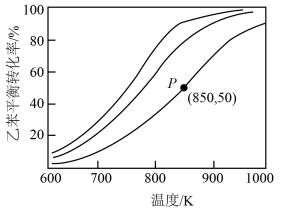
(3)向容器中加入1mol CO2、1mol H2,维持压强100kpa发生反应,CO2和H2的平衡转化率随温度变化曲线如图所示。

①曲线_______ (填“L1”或“L2”)表示CO2的平衡转化率。
②温度高于T2K后曲线L2随温度升高而降低的原因为_______ 。
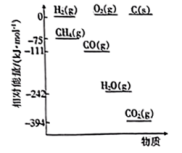
③T1K下反应达到平衡时,H2O(g)的物质的量为_______ mol,反应I的标准平衡常数
_______ (保留1位小数)。(已知:分压=总压×该组分物质的量分数,对于反应: ,
,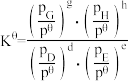 ,其中
,其中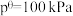 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
(4)利用电催化可将CO2同时转化为多种燃料,装置如图:
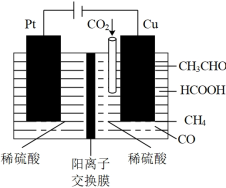
①铜电极上产生CH4的电极反应式为_______ 。
②5.6L(标准状况下) CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g,则生成CO和CH4的体积比为_______ 。
反应I:
 △H1<0
△H1<0反应II:
 △H2>0
△H2>0(1)已知101kPa和298K时一些物质的标准摩尔生成热(在101kPa和一定温度下,由最稳定单质生成1mol纯物质的热效应,称为该物质的标准摩尔生成热)数据如表所示:
| 物质 | H2(g) | CO2(g) | CH3OH(g) | H2O(g) |
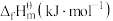 | 0 | -393.5 | -201 | -241.8 |

(2)在密闭容器中上述反应混合体系建立平衡后,下列说法正确的是_______。
| A.增大压强,CO的浓度一定保持不变 |
| B.降低温度,反应II的逆反应速率增大,正反应速率减小 |
| C.增大 CH3OH的浓度,反应II的平衡向正反应方向移动 |
| D.恒温恒压下充入气,反应I的平衡向逆反应方向移动 |

①曲线
②温度高于T2K后曲线L2随温度升高而降低的原因为
③T1K下反应达到平衡时,H2O(g)的物质的量为

 ,
,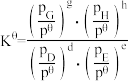 ,其中
,其中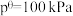 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。(4)利用电催化可将CO2同时转化为多种燃料,装置如图:

①铜电极上产生CH4的电极反应式为
②5.6L(标准状况下) CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g,则生成CO和CH4的体积比为
更新时间:2023-04-02 20:44:55
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】为了实现“碳达峰”和“碳中和”的。目标,将 转化成可利用的化学能源的负碳技术是世界各国关注的焦点。
转化成可利用的化学能源的负碳技术是世界各国关注的焦点。
方法一: 捕集
捕集 合成
合成 。
。
Ⅰ.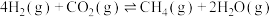


Ⅱ.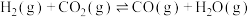


(1)相关物质相对能量大小如图所示,则 =
=___________  ,升高温度,
,升高温度,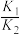
___________ (填“增大”或“减小”)。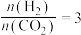 时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数
时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数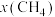 与压强p的变化关系、
与压强p的变化关系、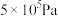 时
时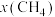 与温度T的变化关系如图所示,图中A、B两点对应的速率:
与温度T的变化关系如图所示,图中A、B两点对应的速率: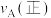
___________ (填“大于”、“小于”或“等于”)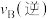 ;若C点
;若C点 与
与 的分压相同,则
的分压相同,则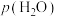 =
=___________  。
。 催化加氢制甲醇。
催化加氢制甲醇。
以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
i.
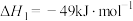
ii.
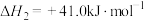
iii.

(3)一定温度和催化剂条件下,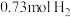 、
、 和
和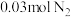 (已知
(已知 不参与反应)在总压强为
不参与反应)在总压强为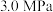 的密闭容器中进行上述反应,平衡时
的密闭容器中进行上述反应,平衡时 的转化率、
的转化率、 和
和 的选择性随温度的变化曲线如图所示。
的选择性随温度的变化曲线如图所示。___________ (填“ ”、“
”、“ ”或“
”或“ ”)的变化。
”)的变化。
②某温度下, 反应达到平衡,测得容器中
反应达到平衡,测得容器中 的体积分数为12.5%。此时用
的体积分数为12.5%。此时用 的分压表示0~t1时间内的反应速率
的分压表示0~t1时间内的反应速率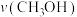 =
=___________  ;设此时
;设此时 ,该温度下反应ii的平衡常数
,该温度下反应ii的平衡常数
___________ 。(用含a的代数式表示)。【已知:分压=总压×该组分的物质的量分数;对于反应 ,
,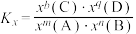 ,x为物质的量分数】
,x为物质的量分数】
 转化成可利用的化学能源的负碳技术是世界各国关注的焦点。
转化成可利用的化学能源的负碳技术是世界各国关注的焦点。方法一:
 捕集
捕集 合成
合成 。
。Ⅰ.
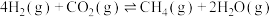


Ⅱ.
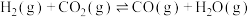


(1)相关物质相对能量大小如图所示,则
 =
= ,升高温度,
,升高温度,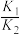
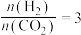 时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数
时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数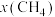 与压强p的变化关系、
与压强p的变化关系、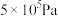 时
时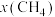 与温度T的变化关系如图所示,图中A、B两点对应的速率:
与温度T的变化关系如图所示,图中A、B两点对应的速率: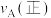
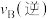 ;若C点
;若C点 与
与 的分压相同,则
的分压相同,则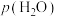 =
= 。
。
 催化加氢制甲醇。
催化加氢制甲醇。以
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:i.

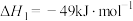
ii.

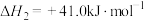
iii.


(3)一定温度和催化剂条件下,
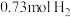 、
、 和
和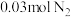 (已知
(已知 不参与反应)在总压强为
不参与反应)在总压强为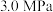 的密闭容器中进行上述反应,平衡时
的密闭容器中进行上述反应,平衡时 的转化率、
的转化率、 和
和 的选择性随温度的变化曲线如图所示。
的选择性随温度的变化曲线如图所示。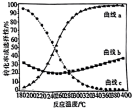
 ”、“
”、“ ”或“
”或“ ”)的变化。
”)的变化。②某温度下,
 反应达到平衡,测得容器中
反应达到平衡,测得容器中 的体积分数为12.5%。此时用
的体积分数为12.5%。此时用 的分压表示0~t1时间内的反应速率
的分压表示0~t1时间内的反应速率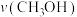 =
= ;设此时
;设此时 ,该温度下反应ii的平衡常数
,该温度下反应ii的平衡常数
 ,
,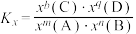 ,x为物质的量分数】
,x为物质的量分数】
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】建设环境友好型社会是全世界的共识,治理环境污染也是国际性难题。化学和化学技术凭借其自身的优点和特性,已经在治理环境污染中发挥着越来越重要的作用。
回答下列问题:
Ⅰ.氮氧化物的处理对建设生态文明具有重要的意义,如何消除NO成为当前研究的主要课题之一、某研究小组将
 、
、
 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应:
催化剂表面发生反应: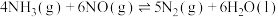
 。
。 时,相关物质的相对能量如图所示。
时,相关物质的相对能量如图所示。
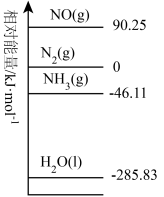
(1)反应的
___________ ;该反应自发进行的条件为___________ (填“高温”、“低温”或“任意条件”)
(2)已知该反应的 ,
,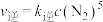 (
( 、
、 为速率常数,与温度、催化剂有关)若平衡后升高温度,则
为速率常数,与温度、催化剂有关)若平衡后升高温度,则
___________ (填“增大”、“不变”或“减小”)。
Ⅱ.“低碳经济”已成为全世界科学家研究的重要课题。苯乙烯是生产塑料与合成橡胶的重要原料。常压下,乙苯和 经催化剂吸附后能发生如下反应:
经催化剂吸附后能发生如下反应:
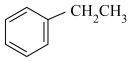 (g)
(g) 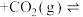
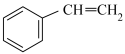 (g)
(g) 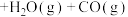

控制投料比[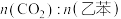 ]分别为
]分别为 、
、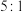 和
和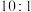 ,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:
,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:
(3)乙苯平衡转化率相同时,投料比越高,对应的反应温度越___________ (填“高”或“低”)。
(4)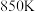 时,反应经
时,反应经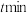 达到图中
达到图中 点所示状态,若初始时乙苯的物质的量为
点所示状态,若初始时乙苯的物质的量为 ,则
,则 (苯乙烯)
(苯乙烯)
___________  。
。
(5)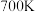 时,向恒容密闭容器中加入过量
时,向恒容密闭容器中加入过量 和一定量乙苯,初始和平衡时容器内压强分别为
和一定量乙苯,初始和平衡时容器内压强分别为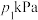 和
和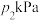 ,则平衡时该反应的
,则平衡时该反应的 为
为___________  (以含有
(以含有 、
、 、
、 的代数式表示)。
的代数式表示)。
已知:a.混合气体中某组分的分压等于总压与该气体物质的量分数之积;以平衡分压代替平衡浓度进行计算,可得反应的平衡常数 ;b.
;b.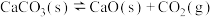
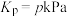
Ⅲ.可用氢气和二氧化碳在催化剂作用下合成甲醇: 。
。
(6)恒压下, 和
和 的起始物质的量之比为
的起始物质的量之比为 时,该反应甲醇的平衡产率随温度的变化如图所示。甲醇的产率
时,该反应甲醇的平衡产率随温度的变化如图所示。甲醇的产率 点高于
点高于 点的原因为
点的原因为___________ 。
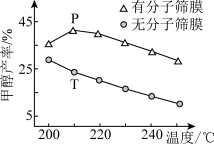 (分子筛膜能选择性分离
(分子筛膜能选择性分离 )
)
回答下列问题:
Ⅰ.氮氧化物的处理对建设生态文明具有重要的意义,如何消除NO成为当前研究的主要课题之一、某研究小组将

 、
、
 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应:
催化剂表面发生反应: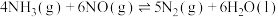
 。
。 时,相关物质的相对能量如图所示。
时,相关物质的相对能量如图所示。
(1)反应的

(2)已知该反应的
 ,
,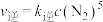 (
( 、
、 为速率常数,与温度、催化剂有关)若平衡后升高温度,则
为速率常数,与温度、催化剂有关)若平衡后升高温度,则
Ⅱ.“低碳经济”已成为全世界科学家研究的重要课题。苯乙烯是生产塑料与合成橡胶的重要原料。常压下,乙苯和
 经催化剂吸附后能发生如下反应:
经催化剂吸附后能发生如下反应: (g)
(g) 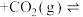
 (g)
(g) 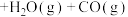

控制投料比[
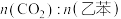 ]分别为
]分别为 、
、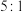 和
和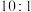 ,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:
,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:
(3)乙苯平衡转化率相同时,投料比越高,对应的反应温度越
(4)
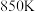 时,反应经
时,反应经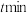 达到图中
达到图中 点所示状态,若初始时乙苯的物质的量为
点所示状态,若初始时乙苯的物质的量为 ,则
,则 (苯乙烯)
(苯乙烯)
 。
。(5)
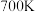 时,向恒容密闭容器中加入过量
时,向恒容密闭容器中加入过量 和一定量乙苯,初始和平衡时容器内压强分别为
和一定量乙苯,初始和平衡时容器内压强分别为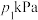 和
和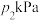 ,则平衡时该反应的
,则平衡时该反应的 为
为 (以含有
(以含有 、
、 、
、 的代数式表示)。
的代数式表示)。已知:a.混合气体中某组分的分压等于总压与该气体物质的量分数之积;以平衡分压代替平衡浓度进行计算,可得反应的平衡常数
 ;b.
;b.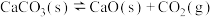
Ⅲ.可用氢气和二氧化碳在催化剂作用下合成甲醇:
 。
。(6)恒压下,
 和
和 的起始物质的量之比为
的起始物质的量之比为 时,该反应甲醇的平衡产率随温度的变化如图所示。甲醇的产率
时,该反应甲醇的平衡产率随温度的变化如图所示。甲醇的产率 点高于
点高于 点的原因为
点的原因为 (分子筛膜能选择性分离
(分子筛膜能选择性分离 )
)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】全球大气CO2浓度升高对人类生产生活产生了影响,研究二氧化碳的回收对我国2060年实现碳中和具有现实意义,碳及其化合物的资源化利用成为研究热点。回答下列问题:
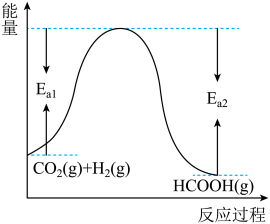
(1)已知CO2和H2在一定条件下能发生反应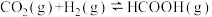 ,反应物与生成物的能量与活化能的关系如图所示,该反应的ΔH=
,反应物与生成物的能量与活化能的关系如图所示,该反应的ΔH=_______ kJ/mol(用含Ea1和Ea2的代数式表示)。
(2)恒温恒容条件下,为了提高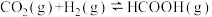 反应中CO2的平衡转化率,可采取的措施为
反应中CO2的平衡转化率,可采取的措施为_______ (任写一项)。下列不能说明该反应达到平衡状态的是_______ (填字母)。
A.v(CO2)正=v(H2)逆
B.HCOOH的体积分数不再变化
C.混合气体的密度不再变化
D.c(CO2):c(H2):c(HCOOH)=1:1:1
(3)已知25℃时,大气中的CO2溶于水存在以下过程:
①CO2(g)⇌CO2(aq) ②CO2(aq)+H2O(l) ⇌H+(aq)+ (aq) K
(aq) K
溶液中CO2的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为ymol•L-1•kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+的浓度为_______ mol•L-1(忽略 和水的电离)。
和水的电离)。
(4)CO2在Cu-ZnO催化下同时发生如下反应I、II,是解决温室效应和能源短缺的重要手段。
I.CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g)
II.CO2(g) + H2(g) ⇌CO(g) + H2O(g)
保持温度T时,在体积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时容器内各气体物质的量如表所示:
已知起始时容器内的压强为p0kPa,达平衡时容器内总压强为pkPa。
若反应I、II均达平衡时,p0=1.4 p,则表中n=_______ ;反应I的平衡常数Kp=_______ (用含p的式子表示)。
(5)光催化还原法能实现CO2甲烷化,其可能的反应机理如图所示,g-C3N4为催化剂,在紫外光照射下,VB端光产生带正电荷的空穴(h+),形成光生电子一空穴对,与所吸附的物质发生氧化还原反应。
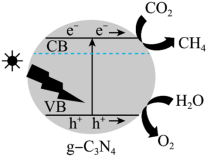
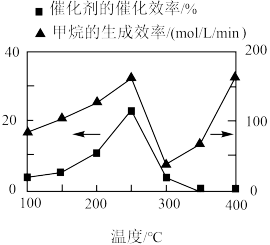
①光催化H2O转化O2为时,在VB端发生的反应为_______ 。
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300~400℃之间,CH4生成速率加快的原因是_______ 。
(1)已知CO2和H2在一定条件下能发生反应
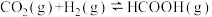 ,反应物与生成物的能量与活化能的关系如图所示,该反应的ΔH=
,反应物与生成物的能量与活化能的关系如图所示,该反应的ΔH=
(2)恒温恒容条件下,为了提高
 反应中CO2的平衡转化率,可采取的措施为
反应中CO2的平衡转化率,可采取的措施为A.v(CO2)正=v(H2)逆
B.HCOOH的体积分数不再变化
C.混合气体的密度不再变化
D.c(CO2):c(H2):c(HCOOH)=1:1:1
(3)已知25℃时,大气中的CO2溶于水存在以下过程:
①CO2(g)⇌CO2(aq) ②CO2(aq)+H2O(l) ⇌H+(aq)+
 (aq) K
(aq) K溶液中CO2的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为ymol•L-1•kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+的浓度为
 和水的电离)。
和水的电离)。(4)CO2在Cu-ZnO催化下同时发生如下反应I、II,是解决温室效应和能源短缺的重要手段。
I.CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g)
II.CO2(g) + H2(g) ⇌CO(g) + H2O(g)
保持温度T时,在体积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时容器内各气体物质的量如表所示:
| CO2(g) | H2(g) | CH3OH(g) | CO(g) | H2O(g) | |
| 起始/mol | 0.5 | 0.9 | 0 | 0 | 0 |
| 平衡/mol | n | 0.3 |
若反应I、II均达平衡时,p0=1.4 p,则表中n=
(5)光催化还原法能实现CO2甲烷化,其可能的反应机理如图所示,g-C3N4为催化剂,在紫外光照射下,VB端光产生带正电荷的空穴(h+),形成光生电子一空穴对,与所吸附的物质发生氧化还原反应。

①光催化H2O转化O2为时,在VB端发生的反应为
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300~400℃之间,CH4生成速率加快的原因是

您最近一年使用:0次
【推荐1】甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________ (填“>”或“<”)0,△H1=________ (用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
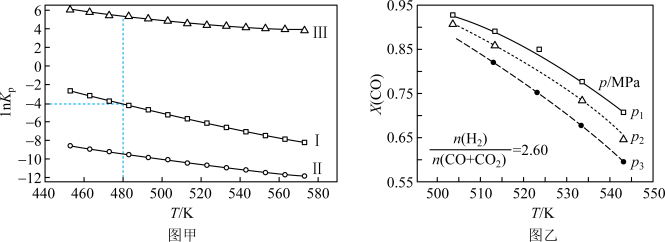
①反应(Ⅱ)的△H________ (填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________ 。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________ (KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
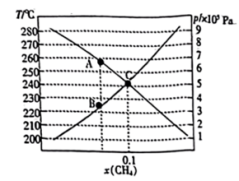
(3)若用CO和CO2混合气体合成甲醇,起始时均控制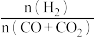 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____ (填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大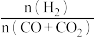 ,X(CO)增大
,X(CO)增大
Ⅰ.CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1Ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2Ⅲ.CO(g)+H2O(g)
 CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3回答下列问题
(1)反应(Ⅰ)的△S
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示

①反应(Ⅱ)的△H
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=
(3)若用CO和CO2混合气体合成甲醇,起始时均控制
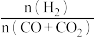 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大
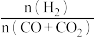 ,X(CO)增大
,X(CO)增大
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】某同学对可逆反应 平衡体系进行探究。回答下列问题如图1。
平衡体系进行探究。回答下列问题如图1。

(1)向左侧烧杯中加入 晶体,观察甲瓶红棕色变浅,向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。则该反应
晶体,观察甲瓶红棕色变浅,向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。则该反应

___________ 0.(填“>”“=”或“<”)
(2)关闭止水夹,维持温度不变,用注射器向甲瓶中充入一定量 ,则此时反应
,则此时反应 浓度熵Q
浓度熵Q___________ K(填“>”、“=”或“<”),平衡将___________ (填“正向”、“逆向”或“不”)移动,颜色比原来___________ (填“深”、“浅”或“不变”),再次达平衡时, 的转化率将
的转化率将___________ 。(填“增大”、“减小”或“不变”)
(3)查阅资料可知,F。Daniels等曾利用测压法在刚性反应器中研究了25℃时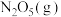 分解反应:
分解反应:
Ⅰ、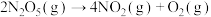 [
[ 时,
时,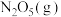 完全分解]
完全分解]
Ⅱ、
反应体系的总压强p随时间t的变化如图2所示。
①研究表明,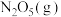 分解的反应速率
分解的反应速率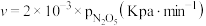 。t=1h时,测得体系中
。t=1h时,测得体系中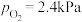 ,则此时
,则此时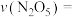
___________  。
。
②若提高反应温度至35℃,则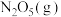 完全分解后体系压强
完全分解后体系压强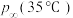
___________ 65.8kPa(填“大于”“等于”或“小于”),原因是___________ (用Q与K解释)。
③25℃时 反应的平衡常数
反应的平衡常数
___________ kPa。( 为以分压表示的平衡常数,
为以分压表示的平衡常数, 等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量分数计算结果保留1位小数)
等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量分数计算结果保留1位小数)
 平衡体系进行探究。回答下列问题如图1。
平衡体系进行探究。回答下列问题如图1。
(1)向左侧烧杯中加入
 晶体,观察甲瓶红棕色变浅,向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。则该反应
晶体,观察甲瓶红棕色变浅,向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。则该反应

(2)关闭止水夹,维持温度不变,用注射器向甲瓶中充入一定量
 ,则此时反应
,则此时反应 浓度熵Q
浓度熵Q 的转化率将
的转化率将(3)查阅资料可知,F。Daniels等曾利用测压法在刚性反应器中研究了25℃时
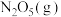 分解反应:
分解反应:Ⅰ、
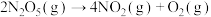 [
[ 时,
时,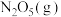 完全分解]
完全分解]Ⅱ、

反应体系的总压强p随时间t的变化如图2所示。
①研究表明,
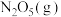 分解的反应速率
分解的反应速率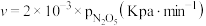 。t=1h时,测得体系中
。t=1h时,测得体系中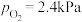 ,则此时
,则此时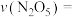
 。
。②若提高反应温度至35℃,则
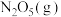 完全分解后体系压强
完全分解后体系压强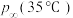
③25℃时
 反应的平衡常数
反应的平衡常数
 为以分压表示的平衡常数,
为以分压表示的平衡常数, 等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量分数计算结果保留1位小数)
等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量分数计算结果保留1位小数)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
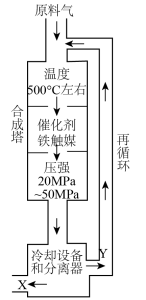
(1)图中条件选定的主要原因是_______ (填字母编号)。
A.温度、压强对化学平衡的影响
B.催化剂铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(2)工业生产中氮气与氢气按物质的量之比为1∶2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为x mol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的
_______ (用p表示,气体分压=总压×物质的量分数)。
(3)合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,若进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
而实际流程从合成塔出来的混合气体中含有氨约为15%,这表明_______ 。
A.表中所测数据有明显误差 B.生产条件控制不当
C.氨的分解速率大于预测值 D.合成塔中的反应并未达到平衡
该流程控制含氨约为15%的原因是_______ 。

(1)图中条件选定的主要原因是
A.温度、压强对化学平衡的影响
B.催化剂铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(2)工业生产中氮气与氢气按物质的量之比为1∶2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为x mol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的

(3)合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,若进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
| 压强 | 20MPa | 60MPa |
| 500℃ | 19.1 | 42.2 |
A.表中所测数据有明显误差 B.生产条件控制不当
C.氨的分解速率大于预测值 D.合成塔中的反应并未达到平衡
该流程控制含氨约为15%的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】O2对人类有着重要的作用。请回答下列问题:
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=___ 。
(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g) MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=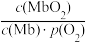 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
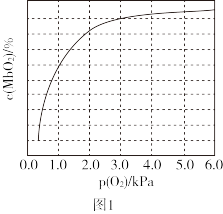
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=___ kPa。
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g) HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压___ (填“较高”或“较低”)有利于CO2排出体外。请你从平衡移动的角度解释原因___ 。
(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作析氯电极 ,本身不参与电解。已知:3NaClO+CO(NH2)2=3NaCl+2H2O+N2↑+CO2↑。

①氮原子的核外电子排布式___ 。
②电解过程中钌钛电极上发生反应为___ 。
③电解过程中不锈钢电极附近pH___ (填“降低”“升高”或“不变”)。
④标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目___ 。
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g)
 MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=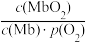 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g)
 HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作

①氮原子的核外电子排布式
②电解过程中钌钛电极上发生反应为
③电解过程中不锈钢电极附近pH
④标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】以废锌催化剂(主要成分为 及少量
及少量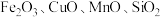 )为原料制备锌的流程如下:
)为原料制备锌的流程如下:
①“浸取”时,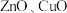 转化为
转化为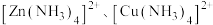 进入溶液;
进入溶液;
② 时,
时,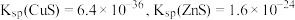 ;
;
③深度除杂标准:溶液中,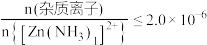 ;
;
(1)“滤渣1”的主要成分为 、
、_______ 。
(2)“深度除锰”是在碱性条件下将残留的 转化为
转化为 离子方程式为
离子方程式为_______ 。
(3)“深度除铜”时,锌的最终回收率,除铜效果{以反应后溶液中铜锌比 表示}与
表示}与 加入量[以
加入量[以 表示]的关系曲线如图所示。
表示]的关系曲线如图所示。 加入量
加入量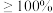 时,锌的最终回收率下降的原因是
时,锌的最终回收率下降的原因是_______ (用离子方程式表示),该反应的平衡常数为_______ (保留3位有效数字)。{已知 的
的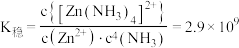 }
}
②“深度除铜”时 加入量最好应选
加入量最好应选_______ (填标号)。
A.90% B.100% C.110% D.120%
(4)“萃取”时有机萃取剂(用 表示)萃取金属离子的原理可表示为:
表示)萃取金属离子的原理可表示为: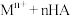 (有机层)
(有机层)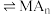 (有机层)
(有机层)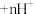 (水层)。“反萃取”的目的是将有机层
(水层)。“反萃取”的目的是将有机层 转移到水层,为尽可能多的提高反萃取率,应选择的实验条件或采取的实验操作有
转移到水层,为尽可能多的提高反萃取率,应选择的实验条件或采取的实验操作有_______ (答两点)。
(5) 存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。
存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。 晶体中
晶体中 的配位数为
的配位数为_______ 。
②图b闪锌矿型晶胞密度为 ,则
,则 与
与 的最近距离为
的最近距离为_______  。(设
。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 及少量
及少量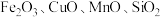 )为原料制备锌的流程如下:
)为原料制备锌的流程如下: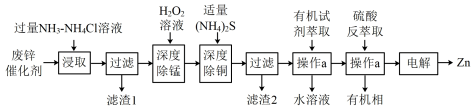
①“浸取”时,
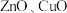 转化为
转化为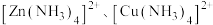 进入溶液;
进入溶液;②
 时,
时,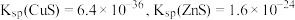 ;
;③深度除杂标准:溶液中,
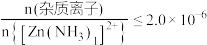 ;
;(1)“滤渣1”的主要成分为
 、
、(2)“深度除锰”是在碱性条件下将残留的
 转化为
转化为 离子方程式为
离子方程式为(3)“深度除铜”时,锌的最终回收率,除铜效果{以反应后溶液中铜锌比
 表示}与
表示}与 加入量[以
加入量[以 表示]的关系曲线如图所示。
表示]的关系曲线如图所示。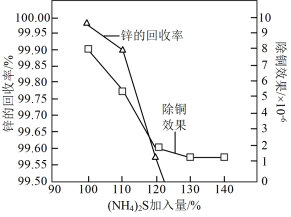
 加入量
加入量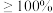 时,锌的最终回收率下降的原因是
时,锌的最终回收率下降的原因是 的
的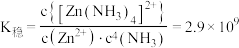 }
}②“深度除铜”时
 加入量最好应选
加入量最好应选A.90% B.100% C.110% D.120%
(4)“萃取”时有机萃取剂(用
 表示)萃取金属离子的原理可表示为:
表示)萃取金属离子的原理可表示为: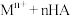 (有机层)
(有机层)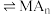 (有机层)
(有机层)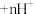 (水层)。“反萃取”的目的是将有机层
(水层)。“反萃取”的目的是将有机层 转移到水层,为尽可能多的提高反萃取率,应选择的实验条件或采取的实验操作有
转移到水层,为尽可能多的提高反萃取率,应选择的实验条件或采取的实验操作有(5)
 存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。
存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。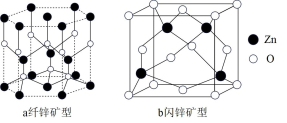
 晶体中
晶体中 的配位数为
的配位数为②图b闪锌矿型晶胞密度为
 ,则
,则 与
与 的最近距离为
的最近距离为 。(设
。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】(1)标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,25℃时几种物质的标准生成焓如下:
ⅰ.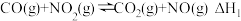
ⅱ.
①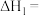
___________ ;CO还原 生成两种无污染的气态物质的热化学方程式为
生成两种无污染的气态物质的热化学方程式为___________ 。
②运用化学反应原理分析,反应过程中 的转化率随温度升高先增大后减小的原因是
的转化率随温度升高先增大后减小的原因是___________ 。
(2)在催化剂Rh表面CO还原NO基元反应机理路径如图a表示,两个N(s)结合生成的 称为
称为 ,
,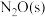 解离生成的
解离生成的 称为
称为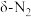 ,基元反应速率随温度的变化关系如图b所示。
,基元反应速率随温度的变化关系如图b所示。
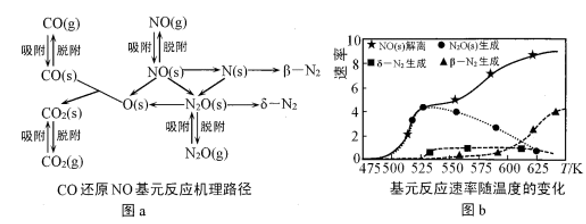
下列说法正确的是___________ (填字母)。
A.在催化剂表面NO的吸附并解离是反应发生的先决条件
B.在催化剂表面 的及时脱附有利于反应的进行
的及时脱附有利于反应的进行
C.当温度超过625K时,生成的 主要是由CO还原
主要是由CO还原 生成的
生成的
D.当温度低于530K时,发生的主要反应为
E.寻找低温下高效的催化剂控制汽车尾气的污染是未来研究的方向
(3)已知对于反应ⅱ: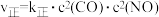 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
①既要加快NO的消除速率,又要消除更多的NO,可采取措施有___________ (写出其中一条即可)。
②达到平衡后,只升高温度, 增大的倍数
增大的倍数___________ (填“>”、“<”或“=”) 增大的倍数。若在1L恒容密闭容器中充入1molCO和1moLNO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为40%,则
增大的倍数。若在1L恒容密闭容器中充入1molCO和1moLNO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为40%,则
___________ (计算结果用分数表示)。
| 物质 |  | CO |  | NO |
| 标准生成焓(kJ/mol) | 33.1 | -110.5 | -183.6 | 90.3 |
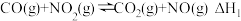
ⅱ.

①
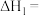
 生成两种无污染的气态物质的热化学方程式为
生成两种无污染的气态物质的热化学方程式为②运用化学反应原理分析,反应过程中
 的转化率随温度升高先增大后减小的原因是
的转化率随温度升高先增大后减小的原因是(2)在催化剂Rh表面CO还原NO基元反应机理路径如图a表示,两个N(s)结合生成的
 称为
称为 ,
,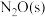 解离生成的
解离生成的 称为
称为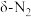 ,基元反应速率随温度的变化关系如图b所示。
,基元反应速率随温度的变化关系如图b所示。
下列说法正确的是
A.在催化剂表面NO的吸附并解离是反应发生的先决条件
B.在催化剂表面
 的及时脱附有利于反应的进行
的及时脱附有利于反应的进行C.当温度超过625K时,生成的
 主要是由CO还原
主要是由CO还原 生成的
生成的D.当温度低于530K时,发生的主要反应为

E.寻找低温下高效的催化剂控制汽车尾气的污染是未来研究的方向
(3)已知对于反应ⅱ:
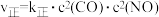 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。①既要加快NO的消除速率,又要消除更多的NO,可采取措施有
②达到平衡后,只升高温度,
 增大的倍数
增大的倍数 增大的倍数。若在1L恒容密闭容器中充入1molCO和1moLNO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为40%,则
增大的倍数。若在1L恒容密闭容器中充入1molCO和1moLNO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为40%,则
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】方法与规律提炼:
(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
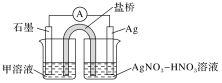
为达到目的,其中石墨为_________ 极,甲溶液是____________ ,证明反应Ag++Fe2+=Ag+Fe3+能够发生的实验操作及现象是_________________________
(2)用零价铁(Fe)去除水体中的硝酸盐(NO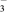 )已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。

上图中作负极的物质是___________ 。正极的电极反应式是______________ 。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________ 。 电路中转移1 mol电子,需消耗氧气_______ L(标准状况)。
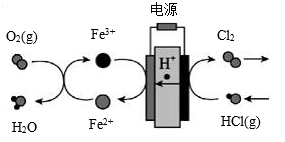
(4)KClO3也可采用“电解法”制备,装置如图所示。
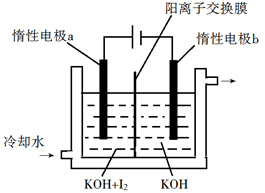
写出电解时阴极的电极反应式___________________ 电解过程中通过阳离子交换膜的离子主要为_________ ,其迁移方向是_____________ (填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____
(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。

为达到目的,其中石墨为
(2)用零价铁(Fe)去除水体中的硝酸盐(NO
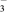 )已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
上图中作负极的物质是
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为

(4)KClO3也可采用“电解法”制备,装置如图所示。

写出电解时阴极的电极反应式
学法题:通过此题的解答,请归纳总结书写电极反应式的方法
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是___________________ 。
(2)Ⅰ中,生成K2MnO4的化学方程式是______________________________ 。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是_________________ 。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是_____________________ 。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4,装置如图:

①b极是______ 极(填“阳”或“阴”),D是_______________ 。
②结合电极反应式简述生成KMnO4的原理:_______________________________ 。
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是______ 。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 +H2SO4 =H2C2O4 +Na2SO4,5H2C2O4 +2MnO4-+6H+=2Mn2++10CO2↑+8H2O,摩尔质量:Na2C2O4 134g•mol-1、KMnO4 158g•mol-1。
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液VmL(杂质不参与反应)。
滴定终点的现象为_______________ ,产品中KMnO4的质量分数的表达式为_____________ 。
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是
(2)Ⅰ中,生成K2MnO4的化学方程式是
(3)Ⅱ中,浸取时用稀KOH溶液的原因是
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4,装置如图:

①b极是
②结合电极反应式简述生成KMnO4的原理:
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 +H2SO4 =H2C2O4 +Na2SO4,5H2C2O4 +2MnO4-+6H+=2Mn2++10CO2↑+8H2O,摩尔质量:Na2C2O4 134g•mol-1、KMnO4 158g•mol-1。
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液VmL(杂质不参与反应)。
滴定终点的现象为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及其与足量氢氧化钠反应生成的NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为________ 在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:________ (填化学式)。
②NaH2PO2是________ (填“正盐”或“酸式盐”),其溶液中离子浓度由大到小的顺序应为________
(2)次磷酸(H3PO2)可以通过电解的方法制备.工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式________
②分析产品室可得到H3PO2的原因________ (结合一定的文字分析)
(1)H3PO2及其与足量氢氧化钠反应生成的NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为
②NaH2PO2是
(2)次磷酸(H3PO2)可以通过电解的方法制备.工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
您最近一年使用:0次



