下列说法正确的是
A. 溶液中: 溶液中: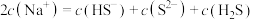 |
B.0.1mol/L的 溶液中: 溶液中: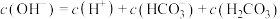 |
C.常温下,pH=3的 溶液与pH=11的NaOH溶液等体积混合后: 溶液与pH=11的NaOH溶液等体积混合后: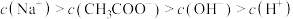 |
D.常温下,NaCN溶液的pH=8,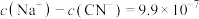 |
更新时间:2023-04-13 16:40:38
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,将NaOH溶液滴加到某二元弱酸H2X溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法错误的是
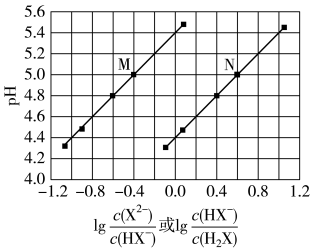

| A.Ka1(H2X)数量级为10-5 | B.当pH=5.0时,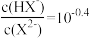 |
| C.NaHX溶液的pH<7 | D.当混合溶液呈中性时,c(X2-)>c(HX-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】常温下,用0.1mol/L氨水滴定10mL浓度均为0.1mol/L的HCl和CH3COOH的混合液,下列说法不正确的是
A.在氨水滴定前,HCl和 的混合液中 的混合液中 |
B.当滴入氨水10mL时,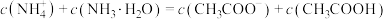 |
C.当滴入氨水20mL时,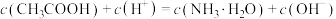 |
D.当溶液呈中性时,氨水滴入量大于20mL, |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】常温下,现有0.1 mol·L-1 NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
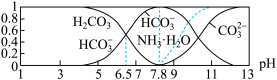

A.当pH=9时,溶液中存在下列关系:c( )>c(NH3·H2O)>c(HC )>c(NH3·H2O)>c(HC )>c( )>c( ) ) |
B.将0.2 mol CO2通入1 L 0.3 mol·L-1 NH3·H2O溶液中充分反应,则有:c(HC )+3c(H2CO3)-c( )+3c(H2CO3)-c( )>0 )>0 |
C.向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时, 和HC 和HC 浓度逐渐减小 浓度逐渐减小 |
D.分析可知,常温下水解平衡常数Kh(HC )的数量级为10-7 )的数量级为10-7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,用0.10mol·L-1NaOH溶液滴定10 mL0.10mol·L-1H2A溶液,测得滴定曲线如图,下列说法正确的是


| A.溶液①中H2A的电离方程式是H2A=2H++A2- |
| B.溶液②中c(HA-)>c(A2-)>c(H2A) |
| C.溶液③中c(Na+)=c(HA-)+c(A2-) |
| D.溶液④中2c(Na+)=c(A2-)+c(HA-)+c(H2A) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,某同学进行下列实验探究Ca(ClO)2的性质。
下列说法正确的是
| 实验步骤和现象 | |
| ⅰ | 取少量Ca(ClO)2溶液于试管中,滴加紫色石蕊溶液,先变蓝后褪色 |
| ⅱ | 取少量Ca(ClO)2溶液于试管中,通入CO2,有白色沉淀生成 |
| ⅲ | 取少量Ca(ClO)2固体于试管中,加入浓盐酸,有黄绿色气体生成 |
| A.0.1 mol/L Ca(ClO)2溶液中存在c(ClO-)>c(Ca2+)>c(OH- )>c(H+) |
| B.根据ⅰ中溶液褪色,说明Ca(ClO)2溶液显碱性 |
| C.根据ⅱ中有白色沉淀生成,说明酸性:HClO>H2CO3 |
| D.根据ⅲ中黄绿色气体生成,说明酸性条件下氧化性:Cl2>ClO- |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】下列有关粒子间关系的说法错误的是
A.0.1 mol/LNa2CO3溶液与0.1 mol/LNaHCO3溶液等体积混合: |
B.等物质的量浓度的NH4HSO4和CH3COONH4溶液中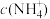 :NH4HSO4>CH3COONH4 :NH4HSO4>CH3COONH4 |
C.0.2 mol/LNaHCO3溶液与0.1 mol/LKOH溶液等体积混合: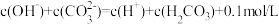 |
D.室温下,NaH2PO4溶液中(pH<7):c( )>c(H3PO4) )>c(H3PO4) |
您最近一年使用:0次



