工业中可利用生产钛白的副产物 和硫铁矿
和硫铁矿 联合制备铁精粉(
联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。
(1) 结构示意图如图。
结构示意图如图。

①铁元素常见的化合价有+2和+3价, 比
比 稳定的因:
稳定的因:________ 。
②下列粒子的中心原子杂化方式与 中S的杂化方式相同的是:
中S的杂化方式相同的是:
A.HCN B. C.
C.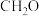 D.
D.
③ 中Fe(Ⅱ)的配位数是
中Fe(Ⅱ)的配位数是_______ , 与
与 的作用力类型是
的作用力类型是_________ 。
(2) 晶体的晶胞形状为立方体,结构如图。
晶体的晶胞形状为立方体,结构如图。
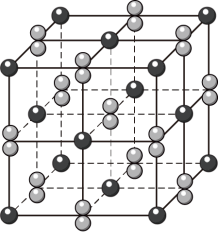
①距离 最近的阳离子有
最近的阳离子有___________ 个, 位于
位于 所形成的
所形成的___________ (填“正四面体”或“正八面体”)空隙。
② 晶体的晶胞参数为a nm,密度为
晶体的晶胞参数为a nm,密度为 ,
, 的摩尔质量为M
的摩尔质量为M  ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
___________ (用含a、ρ、M的代数式表示)。
(3) 加热脱水后生成
加热脱水后生成 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。硫酸工业中,用98%的浓硫酸a吨吸收
在氧气中掺烧可联合制备铁精粉和硫酸。硫酸工业中,用98%的浓硫酸a吨吸收 制得发烟硫酸(化学组成可表示为
制得发烟硫酸(化学组成可表示为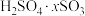 ),可生产
),可生产 质量分数为40%的发烟硫酸
质量分数为40%的发烟硫酸___________ 吨。
 和硫铁矿
和硫铁矿 联合制备铁精粉(
联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。(1)
 结构示意图如图。
结构示意图如图。
①铁元素常见的化合价有+2和+3价,
 比
比 稳定的因:
稳定的因:②下列粒子的中心原子杂化方式与
 中S的杂化方式相同的是:
中S的杂化方式相同的是:A.HCN B.
 C.
C.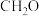 D.
D.
③
 中Fe(Ⅱ)的配位数是
中Fe(Ⅱ)的配位数是 与
与 的作用力类型是
的作用力类型是(2)
 晶体的晶胞形状为立方体,结构如图。
晶体的晶胞形状为立方体,结构如图。
①距离
 最近的阳离子有
最近的阳离子有 位于
位于 所形成的
所形成的②
 晶体的晶胞参数为a nm,密度为
晶体的晶胞参数为a nm,密度为 ,
, 的摩尔质量为M
的摩尔质量为M  ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
(3)
 加热脱水后生成
加热脱水后生成 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。硫酸工业中,用98%的浓硫酸a吨吸收
在氧气中掺烧可联合制备铁精粉和硫酸。硫酸工业中,用98%的浓硫酸a吨吸收 制得发烟硫酸(化学组成可表示为
制得发烟硫酸(化学组成可表示为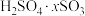 ),可生产
),可生产 质量分数为40%的发烟硫酸
质量分数为40%的发烟硫酸
更新时间:2023-04-19 15:10:12
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】下表为长式周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
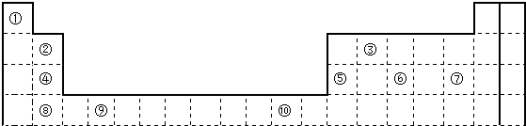
(1)表中属于ds区元素的是________ (填元素符号)。
(2)③和⑦形成的一种常见溶剂的立体构型为________ 。
(3)某元素原子的价层电子排布式为nsnnpn+1,该元素原子的未成对电子数为________ ;该元素与元素①所形成化合物的水溶液显________ 性(填“酸”或“碱”)。
(4)元素④的第一电离能________ 元素⑤(填“>”、“=”、“<”,下同)的第一电离能;元素⑥的电负性________ 元素⑦的电负性。
(5)元素⑦和⑧形成的化合物的电子式为________ 。
(6)元素⑨的基态原子核外电子排布式是________ 。

(1)表中属于ds区元素的是
(2)③和⑦形成的一种常见溶剂的立体构型为
(3)某元素原子的价层电子排布式为nsnnpn+1,该元素原子的未成对电子数为
(4)元素④的第一电离能
(5)元素⑦和⑧形成的化合物的电子式为
(6)元素⑨的基态原子核外电子排布式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)Mn位于元素周期表中第四周期_______ 族。
(2)比较离子半径:F-_______ O2-(填“大于”“等于”或“小于”)。
(3)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是_______ 。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是_______ 。
(5)在周期表中,与Li的化学性质最相似的邻族元素是_______ 。
(6)下列状态的镁中,电离最外层一个电子所需能量最大的是_______(填标号)。
(7)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)_______ I1(Cu)(填“大于”或“小于”)。原因是_______ 。
(8)元素Mn与O中,第一电离能较大的是_______ 。
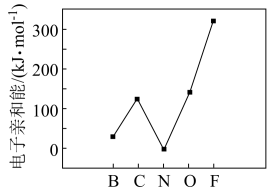
(9)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______ ;氮元素的E1呈现异常的原因是_______ 。
(1)Mn位于元素周期表中第四周期
(2)比较离子半径:F-
(3)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
(5)在周期表中,与Li的化学性质最相似的邻族元素是
(6)下列状态的镁中,电离最外层一个电子所需能量最大的是_______(填标号)。
A. | B.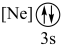 | C.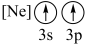 | D. |
(8)元素Mn与O中,第一电离能较大的是
(9)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】[化学—选修3:物质结构与性质]
含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____ ;基态Cu+的核外电子排布式为 ___ 。
(2)化合物(CH3)3N分子中N原子杂化方式为___ ,该物质能溶于水的原因是 ___ 。
(3)PH3分子的键角小于NH3分子的原因是___ ;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式 为____ 。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:

①在一个晶胞中磷原子的配位数为____ 。
②已知磷化硼晶体的密度为ρg/cm3,阿伏伽德罗常数为NA,则B-P键长为____ pm。
③磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑________ 。
含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为
(2)化合物(CH3)3N分子中N原子杂化方式为
(3)PH3分子的键角小于NH3分子的原因是
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:

①在一个晶胞中磷原子的配位数为
②已知磷化硼晶体的密度为ρg/cm3,阿伏伽德罗常数为NA,则B-P键长为
③磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】“天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。75号元素铼Re,熔点仅次于钨,是稀有金属之一。回答:
(1)在元素周期表中,铼与锰在同族,铼原子价层电子表达式为_____ 。
(2)Ni与CO能形成配合物Ni(CO)4(结构如图1所示),该分子中σ键与π键个数比为_____ 。SO2F2的分子结构如图2所示,键角α1>α2的原因主要是_____ 。
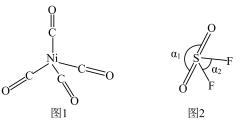
(3)硫酸镍溶于氨水形成[Ni(NH3)4]SO4蓝色溶液,[Ni(NH3)4]SO4中非金属元素H、N、O的电负性由大到小的顺序为_____ ,阴离子 的空间结构是
的空间结构是_____ 。(用文字描述),与 互为等电子体的分子是
互为等电子体的分子是_____ (写一种即可)。
(4)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子配位数为_____ ,铼原子填在氧原子围成的_____ (填“四面体”“立方体"或“八面体”)空隙中,该晶胞的空间利用率为_____ (铼的原子半径为rRepm,氧原子半径为rOpm,列出计算式)。
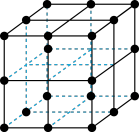
(1)在元素周期表中,铼与锰在同族,铼原子价层电子表达式为
(2)Ni与CO能形成配合物Ni(CO)4(结构如图1所示),该分子中σ键与π键个数比为

(3)硫酸镍溶于氨水形成[Ni(NH3)4]SO4蓝色溶液,[Ni(NH3)4]SO4中非金属元素H、N、O的电负性由大到小的顺序为
 的空间结构是
的空间结构是 互为等电子体的分子是
互为等电子体的分子是(4)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子配位数为
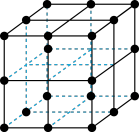
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】2021年10月18日《自然•化学》发表我国科学家研究成果,发现AgCrS2(AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)基态硫原子核外最多有___________ 个电子顺时针旋转。基态铬原子有___________ 种电子运动状态。
(2)氧族元素有氧、硫、硒、碲等元素。这四种元素中,电负性最大的是___________ (填元素符号)。科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。SeO 中硒的杂化轨道类型是
中硒的杂化轨道类型是___________ ,TeO 的空间结构模型为
的空间结构模型为___________ 。H2O、H2S、H2Se、H2Te的键角由大到小的顺序为___________ 。
(3)配合物[Cr(OH)3(H2O)(en)](en为H2NCH2CH2NH2)的中心离子配位数为___________ (Cr与O、N均形成了配位键),1mol该配合物中含___________ molσ键。
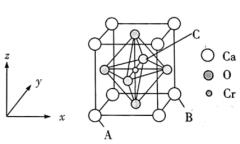
(4)复合材料氧铬酸钙的立方晶胞如图所示。已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为___________ ,1个钙原子与___________ 个氧原子等距离且最近,已知钙和氧的最近距离为apm,则该晶体的密度为___________ g/cm3 (列出计算式即可)
(1)基态硫原子核外最多有
(2)氧族元素有氧、硫、硒、碲等元素。这四种元素中,电负性最大的是
 中硒的杂化轨道类型是
中硒的杂化轨道类型是 的空间结构模型为
的空间结构模型为(3)配合物[Cr(OH)3(H2O)(en)](en为H2NCH2CH2NH2)的中心离子配位数为
(4)复合材料氧铬酸钙的立方晶胞如图所示。已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】铁与镁组成的合金是目前已发现的储氢密度最高的储氢材料之一,回答下列问题:
(1)下列铁的外围电子排布图中,再失去一个电子需要能量最大的是___ (填标号)。
A.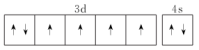 B.
B.
C.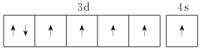 D.
D.
在第四周期过渡元素中,基态原子未成对电子数比铁多的元素为___ (填元素符号)。
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
①(H2NCH2COO)2Fe中含有第二周期元素的第一电离能由大到小的顺序为___ (用元素符号表示),碳原子的杂化类型为__ 。
②甘氨酸H2NCH2COOH的沸点比相同相对分子质量的烷烃大很多,原因是___ 。
(3)硫酸亚铁(FeSO4)可用于制造甘氨酸亚铁,SO 的空间构型为
的空间构型为___ ,二聚体氯化铁分子结构对称,试写出二聚体氯化铁分子的结构__ 。
(4)铁与镁组成的其中一种储氢合金的晶胞结构如图所示(晶胞的边长为dnm)。
①晶胞中铁原子的配位数为__ 。
②图中a处原子的坐标参数为___ ,合金的密度为___ g•cm-3。

(1)下列铁的外围电子排布图中,再失去一个电子需要能量最大的是
A.
 B.
B.
C.
 D.
D.
在第四周期过渡元素中,基态原子未成对电子数比铁多的元素为
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
①(H2NCH2COO)2Fe中含有第二周期元素的第一电离能由大到小的顺序为
②甘氨酸H2NCH2COOH的沸点比相同相对分子质量的烷烃大很多,原因是
(3)硫酸亚铁(FeSO4)可用于制造甘氨酸亚铁,SO
 的空间构型为
的空间构型为(4)铁与镁组成的其中一种储氢合金的晶胞结构如图所示(晶胞的边长为dnm)。
①晶胞中铁原子的配位数为
②图中a处原子的坐标参数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】单晶边缘纳米催化剂技术为工业上有效利用二氧化碳提供了一条经济可行的途径,其中单晶氧化镁负载镍催化剂表现出优异的抗积碳和抗烧结性能。
(1)氧化镁载体及镍催化反应中涉及到 、
、 和
和 等物质。元素Mg、O和C的第一电离能由小到大排序为
等物质。元素Mg、O和C的第一电离能由小到大排序为___________ ;在上述三种物质的分子中碳原子杂化类型不同于其他两种的是___________ ,立体构型为正四面体的分子是___________ ,三种物质中沸点最高的是 ,其原因是
,其原因是___________ 。
(2)Ni与CO在60~80℃时反应生成 气体,在
气体,在 分子中与Ni形成配位键的原子是
分子中与Ni形成配位键的原子是___________ , 晶体类型是
晶体类型是___________ 。
(3)已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgO晶胞边长为0.42nm,则MgO的密度为___________  (保留小数点后一位);相邻
(保留小数点后一位);相邻 之间的最短距离为
之间的最短距离为___________ nm(已知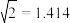 ,
,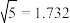 ;结果保留小数点后两位),每个
;结果保留小数点后两位),每个 周围具有该距离的
周围具有该距离的 个数为
个数为___________ 。
(1)氧化镁载体及镍催化反应中涉及到
 、
、 和
和 等物质。元素Mg、O和C的第一电离能由小到大排序为
等物质。元素Mg、O和C的第一电离能由小到大排序为 ,其原因是
,其原因是(2)Ni与CO在60~80℃时反应生成
 气体,在
气体,在 分子中与Ni形成配位键的原子是
分子中与Ni形成配位键的原子是 晶体类型是
晶体类型是(3)已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgO晶胞边长为0.42nm,则MgO的密度为
 (保留小数点后一位);相邻
(保留小数点后一位);相邻 之间的最短距离为
之间的最短距离为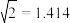 ,
,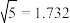 ;结果保留小数点后两位),每个
;结果保留小数点后两位),每个 周围具有该距离的
周围具有该距离的 个数为
个数为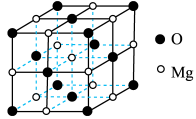
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氧原子的价电子排布图为____ 。
(2)已知:2UO2+5NH4HF2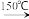 2UF4•2NH4F+3NH3↑+4H2O↑,NH4HF2中存在的化学键类型是
2UF4•2NH4F+3NH3↑+4H2O↑,NH4HF2中存在的化学键类型是____ (填标号)。
(3)已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。
①分解气体产物中属于极性分子的有____ 。
②分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为____ 。
(4)用Mg或Ca还原UF4可得金属铀,其中Mg的熔点高于Ca,原因:____ 。
(5)UO2的晶胞结构如图所示:

①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的____ 空隙中。
②若晶胞参数为apm,UO2摩尔质量为M,晶体的密度为____ g•cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
(1)基态氧原子的价电子排布图为
(2)已知:2UO2+5NH4HF2
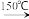 2UF4•2NH4F+3NH3↑+4H2O↑,NH4HF2中存在的化学键类型是
2UF4•2NH4F+3NH3↑+4H2O↑,NH4HF2中存在的化学键类型是| A.离子键 | B.配位键 | C.共价键 | D.范德华力 |
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。①分解气体产物中属于极性分子的有
②分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为(4)用Mg或Ca还原UF4可得金属铀,其中Mg的熔点高于Ca,原因:
(5)UO2的晶胞结构如图所示:

①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的
②若晶胞参数为apm,UO2摩尔质量为M,晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】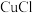 和
和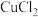 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①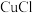 可以由
可以由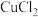 用适当的还原剂如
用适当的还原剂如 等还原制得:
等还原制得:
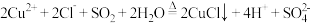
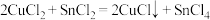
②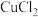 溶液与乙二胺
溶液与乙二胺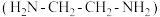 可形成配离子:
可形成配离子:
请回答下列问题:
(1)基态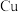 原子的核外电子排布式为
原子的核外电子排布式为_______ ;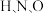 三种元素的电负性由大到小的顺序是
三种元素的电负性由大到小的顺序是_______ 。
(2)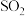 分子的空间构型为
分子的空间构型为_______ ;与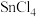 互为等电子体的一种离子的化学式为
互为等电子体的一种离子的化学式为_______ 。
(3)乙二胺分子中氮原子轨道的杂化类型为_______ 。乙二胺和三甲胺 均属于胺,但乙二胺比三甲胺的沸点高得多,原因是
均属于胺,但乙二胺比三甲胺的沸点高得多,原因是_______ 。
(4)②中所形成的配离子中含有的化学键类型有_______。
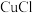 和
和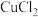 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:①
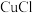 可以由
可以由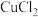 用适当的还原剂如
用适当的还原剂如 等还原制得:
等还原制得: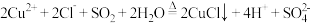
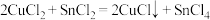
②
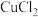 溶液与乙二胺
溶液与乙二胺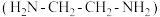 可形成配离子:
可形成配离子:
请回答下列问题:
(1)基态
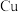 原子的核外电子排布式为
原子的核外电子排布式为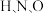 三种元素的电负性由大到小的顺序是
三种元素的电负性由大到小的顺序是(2)
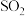 分子的空间构型为
分子的空间构型为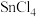 互为等电子体的一种离子的化学式为
互为等电子体的一种离子的化学式为(3)乙二胺分子中氮原子轨道的杂化类型为
 均属于胺,但乙二胺比三甲胺的沸点高得多,原因是
均属于胺,但乙二胺比三甲胺的沸点高得多,原因是(4)②中所形成的配离子中含有的化学键类型有_______。
| A.配位键 | B.极性键 | C.离子键 | D.非极性键 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)写出N基态原子核外电子的空间运动状态有___ 种,与Cu同周期且基态原子核外单电子数与Cu相同的元素还有___ 种。
(2)常见含氮化合物CH3NH2、(CH3)2NH常温下均为气体,已知甲基的供电子能力强于氢原子,沸点较高的是___ ,原因是___ ;NF3中F-N-F键角___ 比NH3中H-N-H键角。(填大于、小于或等于)
(3)将无水硫酸铜溶解在一定量的水中,再加入过量氨水,溶液变为深蓝色,画出该深蓝色离子[Cu(NH3)4(H2O)2]2+的结构___ (不考虑空间构型)。
(4)氮、铜形成的一种化合物,为立方晶系晶体,晶胞参数为apm,沿面对角线投影如图所示:
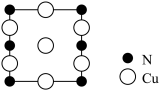
该晶胞中原子的分数坐标为:Cu:(0,0, );(0,
);(0, ,1),(1,0,
,1),(1,0, );(1,
);(1, ,0);(0,1,
,0);(0,1, );(0,
);(0, ,0)……N:(0,0,0):(0,1,1):(1,0,0);(1,1,1);……
,0)……N:(0,0,0):(0,1,1):(1,0,0);(1,1,1);……
则该晶胞中,与Cu原子紧邻的Cu原子有__ 个,令阿伏加德罗常数的值为NA,该晶体的密度为____ g/cm3。(列出计算式)
(1)写出N基态原子核外电子的空间运动状态有
(2)常见含氮化合物CH3NH2、(CH3)2NH常温下均为气体,已知甲基的供电子能力强于氢原子,沸点较高的是
(3)将无水硫酸铜溶解在一定量的水中,再加入过量氨水,溶液变为深蓝色,画出该深蓝色离子[Cu(NH3)4(H2O)2]2+的结构
(4)氮、铜形成的一种化合物,为立方晶系晶体,晶胞参数为apm,沿面对角线投影如图所示:

该晶胞中原子的分数坐标为:Cu:(0,0,
 );(0,
);(0, ,1),(1,0,
,1),(1,0, );(1,
);(1, ,0);(0,1,
,0);(0,1, );(0,
);(0, ,0)……N:(0,0,0):(0,1,1):(1,0,0);(1,1,1);……
,0)……N:(0,0,0):(0,1,1):(1,0,0);(1,1,1);……则该晶胞中,与Cu原子紧邻的Cu原子有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________ 。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________ (用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加入NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________ (选填序号,下同)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________ ,该原子团中 键与
键与 个数的比值为
个数的比值为___________________ 。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:_______________________________ 。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________ 。
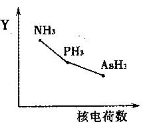
a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______ 。
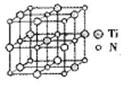
(1)基态Fe2+的核外电子排布式为
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是
(3)Fe(SCN)3溶液中加入NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为
 键与
键与 个数的比值为
个数的比值为(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有

a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】超分子在生命科学和物理学等领域中具有重要意义。由Fe将2个C60分子、2个p—甲酸丁酯吡啶及2个CO分子自组装的超分子结构如图所示。
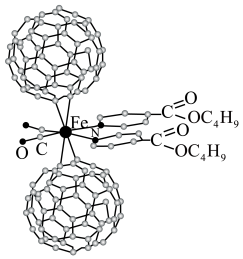
回答下列问题:
(1)基态Fe原子的核外有____ 种不同空间运动状态的电子。
(2)该超分子含有的第二周期元素中,电负性由大到小的顺序是____ 。
(3)该超分子中含有的微粒间作用力有____ (填标号)。
(4)p—甲酸丁酯吡啶配体中C原子的杂化方式是____ (吡啶可看作苯分子中的一个CH原子团被N取代的化合物)。
(5)已知:C60中存在碳碳单、双键,C60中每个碳原子只跟相邻的3个碳原子形成化学键,C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。
①一个C60分子中,五边形的数目有____ 个、碳碳双键的数目有____ 个。
②固体C60与金刚石相比较,熔点较高的是____ ,理由是____ 。
(6)铁的一种立方晶系晶体结构中,每个晶胞平均含有2个Fe,Fe原子坐标是(0,0,0)和( ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是____ 。已知该晶体中距离最近的Fe原子核之间的距离为apm,阿伏加德罗常数是NA,则晶体的密度为____ g·cm-3。

回答下列问题:
(1)基态Fe原子的核外有
(2)该超分子含有的第二周期元素中,电负性由大到小的顺序是
(3)该超分子中含有的微粒间作用力有
| A.共价键 | B.氢键 | C.金属键 | D.配位键 |
(5)已知:C60中存在碳碳单、双键,C60中每个碳原子只跟相邻的3个碳原子形成化学键,C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。
①一个C60分子中,五边形的数目有
②固体C60与金刚石相比较,熔点较高的是
(6)铁的一种立方晶系晶体结构中,每个晶胞平均含有2个Fe,Fe原子坐标是(0,0,0)和(
 ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是
您最近一年使用:0次



