低碳烯烃是指乙烯、丙烯、丁烯,它们是有机合成的重要原料。
(1)我国学者用 催化
催化 加氢合成低碳烯烃,反应过程如图所示:
加氢合成低碳烯烃,反应过程如图所示:
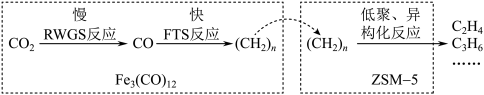
①在 存在下,
存在下, 加氢反应中,RWGS反应的活化能
加氢反应中,RWGS反应的活化能___________ (填“大于”“小于”或“不能判断”)FTS反应的活化能。
②已知:Ⅰ.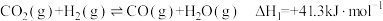
Ⅱ.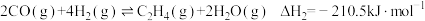
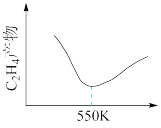
向某密闭容器中加入1mol 和3mol
和3mol ,在一定条件下发生上述反应。研究发现,乙烯的平衡产率随温度变化曲线如图所示,请解释550K以后,曲线变化的原因是
,在一定条件下发生上述反应。研究发现,乙烯的平衡产率随温度变化曲线如图所示,请解释550K以后,曲线变化的原因是___________ 。
③在催化剂存在下,400kPa、500℃条件下,将1mol 和3mol
和3mol 加入某密闭容器中合成低碳烯烃:
加入某密闭容器中合成低碳烯烃: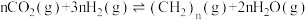 ,40min时反应达到平衡,此时测得的转化率和各含碳产物占所有含碳产物的物质的量分数如下表:
,40min时反应达到平衡,此时测得的转化率和各含碳产物占所有含碳产物的物质的量分数如下表:
反应达到平衡后, 的分压是
的分压是___________ kPa(结果保留三位有效数字,下同),从反应开始到平衡时, 的反应速率是
的反应速率是___________ 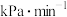 。
。
(2)正丁烷催化脱氢可得到2-丁烯,其有顺反异构,其转化关系如下:
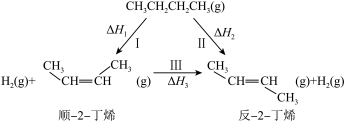
若用 表示反应的体积分数平衡常数(即浓度平衡常数中的浓度用体积分数代替)。上述三个反应的体积分数平衡常数的对数
表示反应的体积分数平衡常数(即浓度平衡常数中的浓度用体积分数代替)。上述三个反应的体积分数平衡常数的对数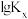 与温度的变化关系如图所示:
与温度的变化关系如图所示:
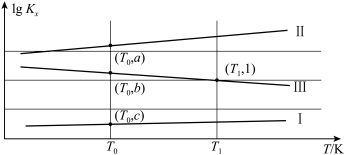
回答下列问题:
①图中b=___________ (用含a、c的代数式表示)。
②在 时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中
时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中 为
为___________ mol。保持恒温恒压下,再向该容器中充入一定量惰性气体He,则反-2-丁烯的体积分数将会___________ (填“增大”“减小”或“不变”)。
(1)我国学者用
 催化
催化 加氢合成低碳烯烃,反应过程如图所示:
加氢合成低碳烯烃,反应过程如图所示:
①在
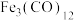 存在下,
存在下, 加氢反应中,RWGS反应的活化能
加氢反应中,RWGS反应的活化能②已知:Ⅰ.
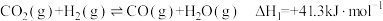
Ⅱ.
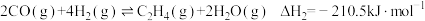
向某密闭容器中加入1mol
 和3mol
和3mol ,在一定条件下发生上述反应。研究发现,乙烯的平衡产率随温度变化曲线如图所示,请解释550K以后,曲线变化的原因是
,在一定条件下发生上述反应。研究发现,乙烯的平衡产率随温度变化曲线如图所示,请解释550K以后,曲线变化的原因是
③在催化剂存在下,400kPa、500℃条件下,将1mol
 和3mol
和3mol 加入某密闭容器中合成低碳烯烃:
加入某密闭容器中合成低碳烯烃: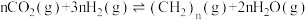 ,40min时反应达到平衡,此时测得的转化率和各含碳产物占所有含碳产物的物质的量分数如下表:
,40min时反应达到平衡,此时测得的转化率和各含碳产物占所有含碳产物的物质的量分数如下表: 的转化率/% 的转化率/% | 各含碳产物占所有含碳产物的物质的量分数/% | ||
 |  | 其他 | |
| 60.0 | 60.0 | 40.0 | 0 |
 的分压是
的分压是 的反应速率是
的反应速率是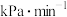 。
。(2)正丁烷催化脱氢可得到2-丁烯,其有顺反异构,其转化关系如下:

若用
 表示反应的体积分数平衡常数(即浓度平衡常数中的浓度用体积分数代替)。上述三个反应的体积分数平衡常数的对数
表示反应的体积分数平衡常数(即浓度平衡常数中的浓度用体积分数代替)。上述三个反应的体积分数平衡常数的对数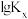 与温度的变化关系如图所示:
与温度的变化关系如图所示:
回答下列问题:
①图中b=
②在
 时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中
时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中 为
为
2023·山东聊城·一模 查看更多[3]
更新时间:2023-05-12 15:34:35
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】甲烷-CO2重整反应可以得到用途广泛的合成气,已知方程式如下。回答下列问题:
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
(1)相关物质的燃烧热数据如下表所示:
① ΔH=___________ kJ·mol-1
② 用Ni基双金属催化,反应的活化能降低,ΔH___________ (填“变大”、“变小”或者“不变”)
(2)控制其它条件不变,改变温度对合成气中甲烷质量分数的影响如图。

若充入a molCH4,经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为___________ mol/h(用a表示);假设A为平衡态,此时压强为2MPa,平衡常数Kp=___________ (用平衡分压代替平衡浓度,分压=总压x物质的量分数,保留2位小数)。
(3)甲烷的重整反应速率可以表示为η=k·p(CH4) [p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是___________ 。
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)已知在高温的条件下,会发生如下副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ·mol-1,且温度越高副反应的转化率越高,化学上称之为“温度的选择性”。不同n(CO2)/n(CH4)配比随温度变化对平衡时n(H2)/n(CO)配比的影响如图所示。

按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因___________ 。
(5)一定温度下反应会出现积碳现象而降低催化剂活性。如图是Ni基双金属催化剂抗积碳的示意图。

结合图示:
①写出一个可能的积碳反应方程式___________ 。
② 金属钴能有效消碳的原因是___________ 。
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
(1)相关物质的燃烧热数据如下表所示:
| 物质 | CH4(g) | CO(g) | H2(g) |
| 燃烧热(kJ·mol-1) | 890.3 | 283.0 | 285.8 |
② 用Ni基双金属催化,反应的活化能降低,ΔH
(2)控制其它条件不变,改变温度对合成气中甲烷质量分数的影响如图。

若充入a molCH4,经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为
(3)甲烷的重整反应速率可以表示为η=k·p(CH4) [p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)已知在高温的条件下,会发生如下副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ·mol-1,且温度越高副反应的转化率越高,化学上称之为“温度的选择性”。不同n(CO2)/n(CH4)配比随温度变化对平衡时n(H2)/n(CO)配比的影响如图所示。

按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因
(5)一定温度下反应会出现积碳现象而降低催化剂活性。如图是Ni基双金属催化剂抗积碳的示意图。

结合图示:
①写出一个可能的积碳反应方程式
② 金属钴能有效消碳的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】研究含N、S的污染排放物并妥善处理和利用,意义重大。回答下列问题:
(1) 尾气先用氨水吸收生成
尾气先用氨水吸收生成 ,反应为
,反应为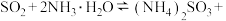
 ,再将
,再将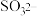 氧化为
氧化为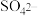 ,最终实现副产氮肥,变废为宝。两种氧化方案如下:
,最终实现副产氮肥,变废为宝。两种氧化方案如下:
方案1: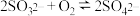
方案2: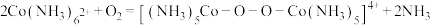 ,
,
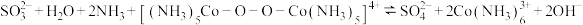 。
。
30℃时,分别向两相同容器中加入100L 0.4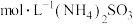 溶液,加入足量相同物质的量的氧化剂,测得
溶液,加入足量相同物质的量的氧化剂,测得 的氧化率X(%)随时间的变化如图所示。
的氧化率X(%)随时间的变化如图所示。
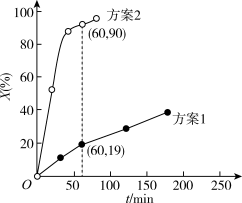
据上述图象判断,氧化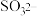 为
为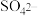 的能力是
的能力是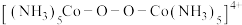
____ (填“大于”或“小于”) ,可能的原因是
,可能的原因是___ 。
②60min内测得方案2体系中用 表示的反应速率为
表示的反应速率为__  。
。
(2)方案2中, 会被氧化成
会被氧化成 ,而
,而 不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加
不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加 将
将 还原成
还原成 ,同时生成
,同时生成 。反应历程如下:
。反应历程如下:
i: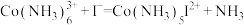
ii:_____
iii:
iv: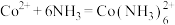
则第ii步反应为____ 。
(3)利用废气中的 将(2)中生成的
将(2)中生成的 还原成
还原成 ,以实现
,以实现 再生。反应的离子方程式为
再生。反应的离子方程式为____ 。
 再生后,实现了利用方案2完整地氧化
再生后,实现了利用方案2完整地氧化 为
为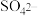 的过程,则整个过程中起催化剂作用的是
的过程,则整个过程中起催化剂作用的是___ (填离子符号)。
(4)关于微生物电化学系统处理含氮废水的研究快速发展,如图是一种新型的浸没式双极室脱盐-反硝化电池。由阳极室和阴极室组成,中间由质子交换膜隔开,阳极室中的有机物则被微生物氧化降解产生电子和质子,其中的 通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成
通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成 。
。
①微生物电化学系统处理有机含氮废水的优点是____ 。
②写出负极发生反应的电极反应式:_____ 。

(1)
 尾气先用氨水吸收生成
尾气先用氨水吸收生成 ,反应为
,反应为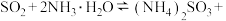
 ,再将
,再将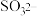 氧化为
氧化为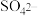 ,最终实现副产氮肥,变废为宝。两种氧化方案如下:
,最终实现副产氮肥,变废为宝。两种氧化方案如下:方案1:
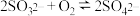
方案2:
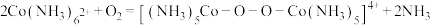 ,
,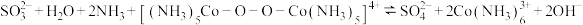 。
。30℃时,分别向两相同容器中加入100L 0.4
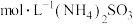 溶液,加入足量相同物质的量的氧化剂,测得
溶液,加入足量相同物质的量的氧化剂,测得 的氧化率X(%)随时间的变化如图所示。
的氧化率X(%)随时间的变化如图所示。
据上述图象判断,氧化
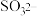 为
为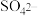 的能力是
的能力是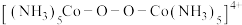
 ,可能的原因是
,可能的原因是②60min内测得方案2体系中用
 表示的反应速率为
表示的反应速率为 。
。(2)方案2中,
 会被氧化成
会被氧化成 ,而
,而 不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加
不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加 将
将 还原成
还原成 ,同时生成
,同时生成 。反应历程如下:
。反应历程如下:i:
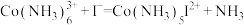
ii:_____
iii:

iv:
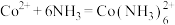
则第ii步反应为
(3)利用废气中的
 将(2)中生成的
将(2)中生成的 还原成
还原成 ,以实现
,以实现 再生。反应的离子方程式为
再生。反应的离子方程式为 再生后,实现了利用方案2完整地氧化
再生后,实现了利用方案2完整地氧化 为
为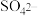 的过程,则整个过程中起催化剂作用的是
的过程,则整个过程中起催化剂作用的是(4)关于微生物电化学系统处理含氮废水的研究快速发展,如图是一种新型的浸没式双极室脱盐-反硝化电池。由阳极室和阴极室组成,中间由质子交换膜隔开,阳极室中的有机物则被微生物氧化降解产生电子和质子,其中的
 通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成
通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成 。
。①微生物电化学系统处理有机含氮废水的优点是
②写出负极发生反应的电极反应式:

您最近一年使用:0次
【推荐3】以乙烯、丙烯为代表的低碳烯烃是化学工业的最基本原料。回答下列问题:
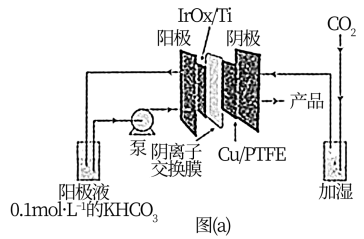
(1)一种电解还原CO2制乙烯的装置如图(a)所示,阴极上生成乙烯的电极反应式为___________ 。
(2)丙烷脱氢制烯烃反应及其常压下平衡常数自然对数值lnKp随温度(T)的变化如图(b)所示:

主反应:
Ⅰ.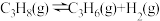
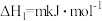
副反应:
Ⅱ.

Ⅲ.
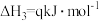
Ⅳ.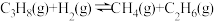

①图中属于吸热反应的是___________ (填标号)。
② =
=___________  。
。
③若只发生反应Ⅱ,则在w点时(若总压强为1MPa)丙烷的转化率为___________ (已知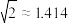 )。
)。
(3)甲醇乙烯烷基化制备丙烯主要反应有:
Ⅰ.

Ⅱ.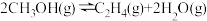
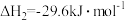
Ⅲ.
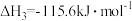
在总压强为0.2MPa,起始时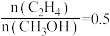 时,平衡时各物质的物质的量分数(yi)随温度变化如图(c)所示;起始时不同的
时,平衡时各物质的物质的量分数(yi)随温度变化如图(c)所示;起始时不同的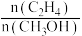 与平衡时各物质的物质的量分数(yi)之间的关系如图(d)所示。
与平衡时各物质的物质的量分数(yi)之间的关系如图(d)所示。
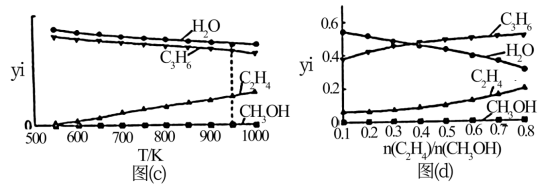
①图(c)中丙烯分压最大值不超过___________ MPa;温度高于550K时,随温度升高,yi(C2H4)不断增大的原因是___________ 。
②图(d)中随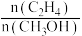 的增大,yi(H2O)不断减小的原因是
的增大,yi(H2O)不断减小的原因是___________ 。
③下列说法正确的是___________ (填字母)。
A.恒温下改变压强,丙烯的平衡产率不变
B.生产丙烯时,升高温度有利于丙烯的生成
C.实际生产中改进催化剂的选择性有利于提高丙烯的产率
D.其它条件不变时,适当增大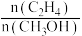 ,有利于提高丙烯的平衡产率
,有利于提高丙烯的平衡产率
(1)一种电解还原CO2制乙烯的装置如图(a)所示,阴极上生成乙烯的电极反应式为

(2)丙烷脱氢制烯烃反应及其常压下平衡常数自然对数值lnKp随温度(T)的变化如图(b)所示:

主反应:
Ⅰ.
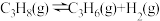
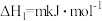
副反应:
Ⅱ.


Ⅲ.

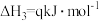
Ⅳ.
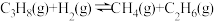

①图中属于吸热反应的是
②
 =
= 。
。③若只发生反应Ⅱ,则在w点时(若总压强为1MPa)丙烷的转化率为
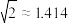 )。
)。(3)甲醇乙烯烷基化制备丙烯主要反应有:
Ⅰ.


Ⅱ.
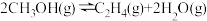
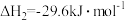
Ⅲ.

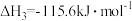
在总压强为0.2MPa,起始时
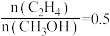 时,平衡时各物质的物质的量分数(yi)随温度变化如图(c)所示;起始时不同的
时,平衡时各物质的物质的量分数(yi)随温度变化如图(c)所示;起始时不同的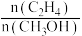 与平衡时各物质的物质的量分数(yi)之间的关系如图(d)所示。
与平衡时各物质的物质的量分数(yi)之间的关系如图(d)所示。
①图(c)中丙烯分压最大值不超过
②图(d)中随
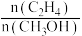 的增大,yi(H2O)不断减小的原因是
的增大,yi(H2O)不断减小的原因是③下列说法正确的是
A.恒温下改变压强,丙烯的平衡产率不变
B.生产丙烯时,升高温度有利于丙烯的生成
C.实际生产中改进催化剂的选择性有利于提高丙烯的产率
D.其它条件不变时,适当增大
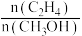 ,有利于提高丙烯的平衡产率
,有利于提高丙烯的平衡产率
您最近一年使用:0次
【推荐1】汽车尾气中含有CO和NOx,减轻其对大气的污染成为科研工作的热点问题。回答下列问题:
(1)已知下列热化学方程式:CO(g)+2H2(g)⇌CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
则ΔH1=_________ kJ·mol-1。
(2)用活化后的V2O5作催化剂,氨气可将NO还原成N2。
①V2O5能改变反应速率是通过改变________ 实现的。
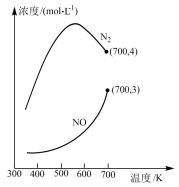
②在1L的刚性密闭容器中分别充入6 mol NO、6 mol NH3和适量O2,控制不同温度,均反应tmin,测得容器中部分含氮气体浓度随温度的变化如图所示。NO浓度始终增大的原因可能是______ 。700K时,0~tmin内,体系中氨气的平均反应速率为______ (用含t的式子表示)。
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应的热化学方程式为:2NO2(g)+4CO(g)⇌4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
在此温度下,反应的平衡常数Kp =________ kPa-1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡________ (填“右移” “左移”或“不移动”)。
(1)已知下列热化学方程式:CO(g)+2H2(g)⇌CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
则ΔH1=
(2)用活化后的V2O5作催化剂,氨气可将NO还原成N2。
①V2O5能改变反应速率是通过改变
②在1L的刚性密闭容器中分别充入6 mol NO、6 mol NH3和适量O2,控制不同温度,均反应tmin,测得容器中部分含氮气体浓度随温度的变化如图所示。NO浓度始终增大的原因可能是

(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应的热化学方程式为:2NO2(g)+4CO(g)⇌4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 压强/kPa | 75 | 73.4 | 71.96 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp =
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】煤的综合利用是一个减少污染、提高燃料利用率的重要课题,其常用的方法包括煤的气化、液化以及转化为有机产品等。请回答下列问题:
(1)已知:I.C(s)、CO(g)、H2(g)的燃烧热依次为△H1=-393.5kJ·mol-1、△H2=-283.0kJ·mol-1、△H3=-285.8kJ·mol-1
II.H2O(l)=H2O(g)△H4=+44.0kJ·mol-1
则煤气化主要反应C(s)+H2O(g) CO(g)+H2(g)的△H=
CO(g)+H2(g)的△H=___ 。
(2)现在一恒温的刚性容器中加入足量煤,并通入1mol水蒸气,发生反应C(s)+H2O(g) CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有
CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
①气体的密度保持不变;②断裂2molH-O键的同时生成1molH-H键;③CO的体积分数保持不变;④气体的平均摩尔质量不变;⑤CO与H2的比例保持不变;⑥容器的压强保持不变。
(3)气化后,将水煤气CO与H2化合CO(g)+2H2(g) CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=
CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___ ;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___ v逆(填“大于”“小于”或“等于”)。
(4)关于CO(g)+2H2(g) CH3OH(g),下列说法正确的是
CH3OH(g),下列说法正确的是___ (填字母)。
A.加压有利于速率加快和平衡向正反应方向移动
B.甲醇的平衡体积分数随着CO与H2投料比的增大而增大
C.使用催化性能好的催化剂,可提高H2的平衡转化率
D.在恒温恒容条件下达到平衡后,通入Ar,平衡向逆反应方向移动
E.已知E[CO(g)+2H2(g)]>E[CH3OH(g)](E表示物质的能量),则降温有利于提高正反应进行的程度
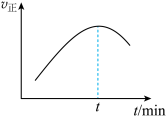
(5)在一特殊的恒容容器中,充入一定量的CO(g)与H2(g)来模拟CO(g)+2H2(g) CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为
CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___ ;t之后v正又逐渐减小的原因为___ 。
(6)煤经过一系列转化还可得到草酸。常温下,向某浓度的草酸溶液中加入一定量某浓度的NaOH溶液,所得溶液中c(HC2O4-)=c(C2O42-),则此时溶液的pH=___ (已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)。
(1)已知:I.C(s)、CO(g)、H2(g)的燃烧热依次为△H1=-393.5kJ·mol-1、△H2=-283.0kJ·mol-1、△H3=-285.8kJ·mol-1
II.H2O(l)=H2O(g)△H4=+44.0kJ·mol-1
则煤气化主要反应C(s)+H2O(g)
 CO(g)+H2(g)的△H=
CO(g)+H2(g)的△H=(2)现在一恒温的刚性容器中加入足量煤,并通入1mol水蒸气,发生反应C(s)+H2O(g)
 CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有
CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有①气体的密度保持不变;②断裂2molH-O键的同时生成1molH-H键;③CO的体积分数保持不变;④气体的平均摩尔质量不变;⑤CO与H2的比例保持不变;⑥容器的压强保持不变。
(3)气化后,将水煤气CO与H2化合CO(g)+2H2(g)
 CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=
CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=(4)关于CO(g)+2H2(g)
 CH3OH(g),下列说法正确的是
CH3OH(g),下列说法正确的是A.加压有利于速率加快和平衡向正反应方向移动
B.甲醇的平衡体积分数随着CO与H2投料比的增大而增大
C.使用催化性能好的催化剂,可提高H2的平衡转化率
D.在恒温恒容条件下达到平衡后,通入Ar,平衡向逆反应方向移动
E.已知E[CO(g)+2H2(g)]>E[CH3OH(g)](E表示物质的能量),则降温有利于提高正反应进行的程度
(5)在一特殊的恒容容器中,充入一定量的CO(g)与H2(g)来模拟CO(g)+2H2(g)
 CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为
CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为
(6)煤经过一系列转化还可得到草酸。常温下,向某浓度的草酸溶液中加入一定量某浓度的NaOH溶液,所得溶液中c(HC2O4-)=c(C2O42-),则此时溶液的pH=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】煤是重要的化石燃料和化工原料,有关煤的综合利用得到广泛深入的研究。其中煤的气化是煤的综合利用的重要途径。
煤的催化气化生成CO, 主要反应为①C(s)+CO2(g) 2CO(g) △H
2CO(g) △H
碱金属催化剂显示出了优越的催化性能。Mckee和Chatterji在1975年提出了由碱金属的氧化还原循环的氧传递机理:
②K2CO3(s)+2C(s) 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol
③2K(g)+CO2(g) K2O(s)+CO(g) △H2=-98.4 k/mol
K2O(s)+CO(g) △H2=-98.4 k/mol
④K2O(s)+CO2(g) K2CO3(s) △H3=-456.0 kJ/mol
K2CO3(s) △H3=-456.0 kJ/mol
(1) △H=_____________ 。

(2)在2L的密闭容器中投入3molC和3molCO2,在催化剂的作用下发生反应①,平衡时CO的气体体积分数φ(CO)随温度和压强的变化曲线如图1所示,根据图象回答问题:
①若在温度为900℃,压强为P3的条件下,经过10min反应达到平衡,则0~10min内的反应速率v(CO)为_____________ 。
②该可逆反应达到平衡状态的标志是_____________ (填字母)
A.v(CO)正=2v(CO2)逆 B.CO2和CO的浓度之比为1∶2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间而变化
③图中压强的大小顺序_______________ ,判断理由是_______________ 。
④可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算(分压=总压×物质的量分数)。反应①在图中A点的总压强为1MPa,则A点的平衡常数Kp=_____________ 。
(3) 化石燃料燃烧易造成污染,“湿式吸收法”利用吸收剂与SO2发生反应从而达到燃料脱硫的目的。下列适合作该法吸收剂的是___________ (填序号) 。
A.氨水 B.Na2SO4溶液 C.Na2CO3溶液 D.NaHSO4溶液
煤的催化气化生成CO, 主要反应为①C(s)+CO2(g)
 2CO(g) △H
2CO(g) △H碱金属催化剂显示出了优越的催化性能。Mckee和Chatterji在1975年提出了由碱金属的氧化还原循环的氧传递机理:
②K2CO3(s)+2C(s)
 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol③2K(g)+CO2(g)
 K2O(s)+CO(g) △H2=-98.4 k/mol
K2O(s)+CO(g) △H2=-98.4 k/mol④K2O(s)+CO2(g)
 K2CO3(s) △H3=-456.0 kJ/mol
K2CO3(s) △H3=-456.0 kJ/mol(1) △H=

(2)在2L的密闭容器中投入3molC和3molCO2,在催化剂的作用下发生反应①,平衡时CO的气体体积分数φ(CO)随温度和压强的变化曲线如图1所示,根据图象回答问题:
①若在温度为900℃,压强为P3的条件下,经过10min反应达到平衡,则0~10min内的反应速率v(CO)为
②该可逆反应达到平衡状态的标志是
A.v(CO)正=2v(CO2)逆 B.CO2和CO的浓度之比为1∶2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间而变化
③图中压强的大小顺序
④可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算(分压=总压×物质的量分数)。反应①在图中A点的总压强为1MPa,则A点的平衡常数Kp=
(3) 化石燃料燃烧易造成污染,“湿式吸收法”利用吸收剂与SO2发生反应从而达到燃料脱硫的目的。下列适合作该法吸收剂的是
A.氨水 B.Na2SO4溶液 C.Na2CO3溶液 D.NaHSO4溶液
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】二氧化碳加氢可转化为二甲醚( ),既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
),既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
(1) 加氢合成甲醇以及甲醇脱水生成二甲醚的热化学方程式如下:
加氢合成甲醇以及甲醇脱水生成二甲醚的热化学方程式如下:


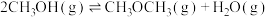
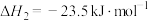
则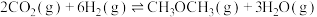 的
的
___________  。
。
(2)向一容积为2L的恒容密闭容器中通入2 moL 和6 mol
和6 mol  ,一定温度下发生反应
,一定温度下发生反应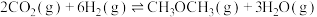 。起始总压为p Pa,20 min时达到化学平衡状态,测得
。起始总压为p Pa,20 min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时总压为___________ Pa。
②达到化学平衡状态时,下列有关叙述正确的是___________ (填标号)。
A.
B.容器内气体压强不再发生改变
C.向容器内通入少量氦气,则平衡向正反应方向移动
D.向容器内再通入1 mol 和3 mol
和3 mol  ,重新达到平衡后,
,重新达到平衡后, 的体积分数增大
的体积分数增大
③0~20 min内,用 表示的平均反应速率
表示的平均反应速率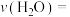
___________ , 的平衡浓度
的平衡浓度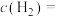
___________ 。该温度下,反应的平衡常数
___________ 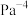 (用含p的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)工业上,以一定比例混合的 与
与 的混合气体以一定流速分别通过填充有催化剂I、催化剂II的反应器,发生反应
的混合气体以一定流速分别通过填充有催化剂I、催化剂II的反应器,发生反应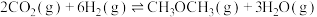 。
。 转化率与温度的关系如图所示。在催化剂II作用下,温度高于
转化率与温度的关系如图所示。在催化剂II作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是___________ 。

 ),既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
),既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:(1)
 加氢合成甲醇以及甲醇脱水生成二甲醚的热化学方程式如下:
加氢合成甲醇以及甲醇脱水生成二甲醚的热化学方程式如下:

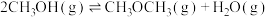
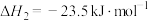
则
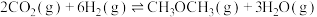 的
的
 。
。(2)向一容积为2L的恒容密闭容器中通入2 moL
 和6 mol
和6 mol  ,一定温度下发生反应
,一定温度下发生反应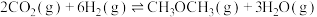 。起始总压为p Pa,20 min时达到化学平衡状态,测得
。起始总压为p Pa,20 min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时总压为
②达到化学平衡状态时,下列有关叙述正确的是
A.

B.容器内气体压强不再发生改变
C.向容器内通入少量氦气,则平衡向正反应方向移动
D.向容器内再通入1 mol
 和3 mol
和3 mol  ,重新达到平衡后,
,重新达到平衡后, 的体积分数增大
的体积分数增大③0~20 min内,用
 表示的平均反应速率
表示的平均反应速率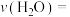
 的平衡浓度
的平衡浓度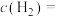

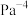 (用含p的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(3)工业上,以一定比例混合的
 与
与 的混合气体以一定流速分别通过填充有催化剂I、催化剂II的反应器,发生反应
的混合气体以一定流速分别通过填充有催化剂I、催化剂II的反应器,发生反应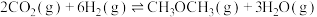 。
。 转化率与温度的关系如图所示。在催化剂II作用下,温度高于
转化率与温度的关系如图所示。在催化剂II作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】恒温恒容条件下,向密闭容器中加入一定量X,发生反应:①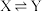
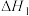 ,②
,②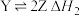 ΔH2,图甲为该体系中X、Y、Z浓度随时间变化的曲线。反应②的速率
ΔH2,图甲为该体系中X、Y、Z浓度随时间变化的曲线。反应②的速率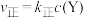 ,
, ,式中
,式中 、
、 为速率常数。图乙为②的速率常数
为速率常数。图乙为②的速率常数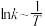 曲线。
曲线。

(1)表示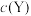 的曲线为
的曲线为_____ 。
(2)从 反应②用Y表示
反应②用Y表示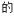 化学反应速率为
化学反应速率为_____ 。
(3)反应①与反应②到达平衡的时间_____ (填“相等”或“不相等”),该温度下,反应②的化学平衡常数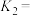
_____ (用含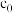 、
、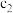 、
、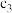 的式子来表示)
的式子来表示)
(4)由图乙可知,
_____ 0(填“>”或“<”), 时
时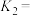
_____ 
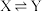
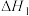 ,②
,②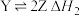 ΔH2,图甲为该体系中X、Y、Z浓度随时间变化的曲线。反应②的速率
ΔH2,图甲为该体系中X、Y、Z浓度随时间变化的曲线。反应②的速率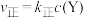 ,
, ,式中
,式中 、
、 为速率常数。图乙为②的速率常数
为速率常数。图乙为②的速率常数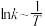 曲线。
曲线。
(1)表示
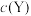 的曲线为
的曲线为(2)从
 反应②用Y表示
反应②用Y表示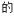 化学反应速率为
化学反应速率为(3)反应①与反应②到达平衡的时间
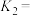
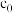 、
、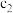 、
、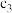 的式子来表示)
的式子来表示)(4)由图乙可知,

 时
时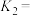

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】I.甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。
相关化学键的键能数据
在一定温度下,利用催化剂将CO2和H2合成CH3OH。已知各反应物、产物均为气体。回答下列问题:
(1)写出CO2和H2反应生成CH3OH和水的热化学方程式:___________ 。
(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为 ,
,
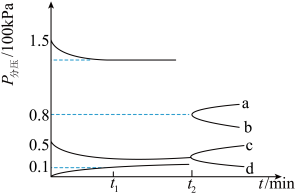
①此时用H2压强表示0-t1时间内的反应速率v(H2)=___________ kPa·min-1。
②t2时将容器体积迅速压缩为原来的一半,图中能正确表示压缩体积后CO2分压变化趋势的曲线是___________ (用图中a、b、c、d表示)。
若其它条件不变,T1°C时测得平衡体系的压强为plkPa;T2°C时,测得平衡体系的压强为p2kPa,若p1>p2,则T1___________ T2(填“>”、“<”或“无法确定)。
II.环氧丙烷( ,简写为PO)也是一种重要的工业原料,利用丙烯(C3H6)气相直接环氧化是未来工业生产的趋势,寻找合适的催化剂是目前实验研究的热点。
,简写为PO)也是一种重要的工业原料,利用丙烯(C3H6)气相直接环氧化是未来工业生产的趋势,寻找合适的催化剂是目前实验研究的热点。
(3)选用Au/TS-1为催化剂,发生丙烯气相直接环氧化反应为:C3H6(g)+ H2(g)+ O2(g)
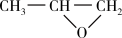 (g)+ H2O(g) ;
(g)+ H2O(g) ;
副反应如下:
C3H6(g) + H2(g) + O2(g) CH3CH2CHO(g) + H2O(g)
CH3CH2CHO(g) + H2O(g)
C3H6(g) + O2(g) CH2=CHCHO(g) + H2O(g)
CH2=CHCHO(g) + H2O(g)
为探究TS-1的粒径对Au/TS-1催化活性的影响,恒温200℃、恒压p kPa条件下,C3H6与H2、O2各20.0 mmol通入反应装置中,t min后部分组分的物质的量如下表所示:
当粒径为240 nm, t min时反应恰好达到平衡状态,则C3H6的总转化率为___________ ,若H2的总转化率为α,则环氧化反应的平衡常数Kp为___________ kPa-1。
相关化学键的键能数据
| 化学键 | C=O | H-H | C-H | C-O | H-O |
| 键能E/(kJ·mol-1) | 806 | 436 | 413 | 343 | 465 |
(1)写出CO2和H2反应生成CH3OH和水的热化学方程式:
(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为
 ,
,
①此时用H2压强表示0-t1时间内的反应速率v(H2)=
②t2时将容器体积迅速压缩为原来的一半,图中能正确表示压缩体积后CO2分压变化趋势的曲线是
若其它条件不变,T1°C时测得平衡体系的压强为plkPa;T2°C时,测得平衡体系的压强为p2kPa,若p1>p2,则T1
II.环氧丙烷(
 ,简写为PO)也是一种重要的工业原料,利用丙烯(C3H6)气相直接环氧化是未来工业生产的趋势,寻找合适的催化剂是目前实验研究的热点。
,简写为PO)也是一种重要的工业原料,利用丙烯(C3H6)气相直接环氧化是未来工业生产的趋势,寻找合适的催化剂是目前实验研究的热点。(3)选用Au/TS-1为催化剂,发生丙烯气相直接环氧化反应为:C3H6(g)+ H2(g)+ O2(g)

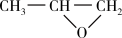 (g)+ H2O(g) ;
(g)+ H2O(g) ;副反应如下:
C3H6(g) + H2(g) + O2(g)
 CH3CH2CHO(g) + H2O(g)
CH3CH2CHO(g) + H2O(g)C3H6(g) + O2(g)
 CH2=CHCHO(g) + H2O(g)
CH2=CHCHO(g) + H2O(g)为探究TS-1的粒径对Au/TS-1催化活性的影响,恒温200℃、恒压p kPa条件下,C3H6与H2、O2各20.0 mmol通入反应装置中,t min后部分组分的物质的量如下表所示:
| 粒径大小/nm | 240 | 450 | 810 | 1130 | |
| 物质的量 /mmol | PO | 1.80 | 1.45 | 1.09 | 0.672 |
| 所有C3副产物 | 0.20 | 0.32 | 0.05 | 0.092 | |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)⇌N2(g)+CO2(g) ∆H,在T1℃时,反应进行到不同时间测得各物质的浓度如表:
①根据图表数据分析T1 ℃时,该反应在0~10 min内的平均反应速率v(NO)=_____ mol·L-1·min-1;计算该反应的平衡常数K=_______ 。
②若30 min后只改变某一条件,据表中的数据判断改变的条件可能是_____ (填字母编号)。
A.通入一定量的NO B.适当缩小容器的体积
C.加入合适的催化剂 D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率_______ (填“升高”或“降低”),∆H______ 0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1 kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出CH3OCH3(g)和H2O(g)转化为CO2(g)和H2(g)的热化学方程式_______
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______ 。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(HCO )∶c(CO
)∶c(CO ) =
) =______ 。[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用1LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_____ 。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp (BaCO3)=1×10 -10]。(忽略溶液体积的变化)
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)⇌N2(g)+CO2(g) ∆H,在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
| N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
②若30 min后只改变某一条件,据表中的数据判断改变的条件可能是
A.通入一定量的NO B.适当缩小容器的体积
C.加入合适的催化剂 D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1 kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出CH3OCH3(g)和H2O(g)转化为CO2(g)和H2(g)的热化学方程式
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(HCO
 )∶c(CO
)∶c(CO ) =
) =②欲用1LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】苯乙烯是一种重要的有机化工原料,可广泛用于合成橡胶,工程塑料及制药等。工业上可通过乙苯催化脱氢来制取苯乙烯,反应方程式如下:
___________ 。
(2)下列关于该反应的说法不正确的是___________。
(3)工业上通入过热水蒸气 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应
①反应中通入水蒸气的作用是___________
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为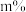 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
___________ (分压 总压
总压 物质的量分数)
物质的量分数)
(4)保持温度为 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应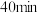 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线___________ 。

 ;
;

| 物质 | 乙苯 | 苯乙烯 | 氢气 |
燃烧热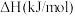 |  |  |  |
| A.高温、低压有利于该反应平衡正向进行 |
| B.高温恒压条件下,乙苯可能会裂解产生积碳覆盖在催化剂的表面,使催化效果下降 |
| C.恒温恒容条件下,反应达到平衡后,向体系中再充入乙苯蒸气,乙苯的转化率将增大 |
| D.选择合适的催化剂可以缩短达到平衡的时间,可使乙苯的平衡转化率变大 |
 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应①反应中通入水蒸气的作用是
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为
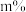 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
 总压
总压 物质的量分数)
物质的量分数)(4)保持温度为
 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应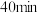 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】含硫化合物在能源、材料及环境等工业领域均有广泛的应用。
Ⅰ.工业废气 分解可制取
分解可制取 。
。
(1)已知热化学方程式:
ⅰ.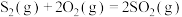

ⅱ.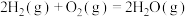

ⅲ.

 热分解反应
热分解反应 的
的
___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)一定温度下,2mol 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为___________  ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
___________ 。
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:
ⅳ.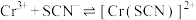
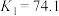
ⅴ.

(3)根据以上络合反应,下列说法正确的有___________(填字母)。
(4)常温下,某研究小组配制了起始浓度 、
、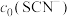 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、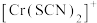 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随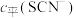 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。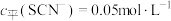 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为___________ ;A点时,溶液中 的平衡浓度为
的平衡浓度为___________ (列出计算式即可)。
②在某电镀工艺中, 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺________ (写出计算过程)。
Ⅰ.工业废气
 分解可制取
分解可制取 。
。(1)已知热化学方程式:
ⅰ.
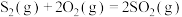

ⅱ.
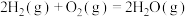

ⅲ.


 热分解反应
热分解反应 的
的
 、
、 、
、 的式子表示)。
的式子表示)。(2)一定温度下,2mol
 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为 ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中
 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:ⅳ.
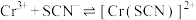
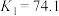
ⅴ.


(3)根据以上络合反应,下列说法正确的有___________(填字母)。
| A.加水稀释后,溶液中离子的总数减少 |
B.加入少量 固体,溶液中含铬微粒总数不变 固体,溶液中含铬微粒总数不变 |
C.反应 的平衡常数 的平衡常数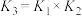 |
D.溶液中 减小, 减小, 与 与 浓度的比值减小 浓度的比值减小 |
(4)常温下,某研究小组配制了起始浓度
 、
、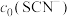 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、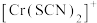 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随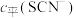 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。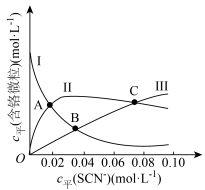
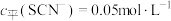 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为 的平衡浓度为
的平衡浓度为②在某电镀工艺中,
 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
您最近一年使用:0次



