硒( )是人体必需微量元素之一,含硒化合物在材料领域具有重要应用。一种具有聚集诱导发光效应的含
)是人体必需微量元素之一,含硒化合物在材料领域具有重要应用。一种具有聚集诱导发光效应的含 分子(IV)合成路线如下:
分子(IV)合成路线如下:

(1) 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,根据结构解释其原因:
,根据结构解释其原因:_______ 。
(3)关于I~Ⅳ四种物质中,下列说法正确的有_______ 。
a.I中仅有 键,其中的
键,其中的 键为非极性键
键为非极性键
b.Ⅱ易溶于水,其分子式为
c.Ⅲ、Ⅳ中C均为 杂化,S、N、
杂化,S、N、 均为
均为 杂化
杂化
d.I~Ⅳ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有_______ 。
(5)推测硒的两种含氧酸的酸性强弱为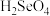
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(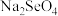 )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为_______ 。
(6)我国科学家发展了一种理论计算方法,可利用晶体衍射实验获得的结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为_______ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, )。
)。
 )是人体必需微量元素之一,含硒化合物在材料领域具有重要应用。一种具有聚集诱导发光效应的含
)是人体必需微量元素之一,含硒化合物在材料领域具有重要应用。一种具有聚集诱导发光效应的含 分子(IV)合成路线如下:
分子(IV)合成路线如下:
(1)
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,根据结构解释其原因:
,根据结构解释其原因:(3)关于I~Ⅳ四种物质中,下列说法正确的有
a.I中仅有
 键,其中的
键,其中的 键为非极性键
键为非极性键b.Ⅱ易溶于水,其分子式为

c.Ⅲ、Ⅳ中C均为
 杂化,S、N、
杂化,S、N、 均为
均为 杂化
杂化d.I~Ⅳ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)推测硒的两种含氧酸的酸性强弱为
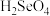
 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(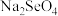 )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为(6)我国科学家发展了一种理论计算方法,可利用晶体衍射实验获得的结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, )。
)。
更新时间:2023-05-28 16:32:38
|
相似题推荐
【推荐1】硒(Se)被国内外医药界和营养学界尊称为“生命的火种”,享有“长寿元素”“抗癌之王”“心脏守护神”“天然解毒剂”等美誉。硒在电子工业中可用作光电管、太阳能电池,硒元素形成的多种化合物也有重要作用。
(1)硒和硫同为VIA族元素,基态硒原子的价层电子排布式为___________ ,单质硒的熔点为221℃,其晶体类型___________ 。
(2)与硒元素相邻的同周期元素有砷和溴,则这三种元素的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(3) 的立体构型是
的立体构型是___________ ;写出一种与 互为等电子体的分子
互为等电子体的分子___________ (写化学式)。
(4)H2Se水溶液比H2S水溶液的酸性___________ ,原因是___________ 。
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:___________ ;
②H2SeO4比H2SeO3酸性强的原因:______ ;
(6)硒化锌是一种重要的半导体材料,其晶胞结构如图所示(白色球表示Se原子),该晶胞中硒原子的配位数为___________ ;若该晶胞的密度为dg·cm—3,硒化锌的摩尔质量为Mg·mol,用NA表示阿伏加 德罗常数的值,则S2—与Zn2+的最短距离为___________ pm。

(1)硒和硫同为VIA族元素,基态硒原子的价层电子排布式为
(2)与硒元素相邻的同周期元素有砷和溴,则这三种元素的第一电离能由小到大的顺序为
(3)
 的立体构型是
的立体构型是 互为等电子体的分子
互为等电子体的分子(4)H2Se水溶液比H2S水溶液的酸性
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
(6)硒化锌是一种重要的半导体材料,其晶胞结构如图所示(白色球表示Se原子),该晶胞中硒原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】硒是稀散非金属之一,在光敏材料、电解锰行业催化剂和半导体材料等方面有广泛应用,其在元素周期表中相对位置关系如图所示:
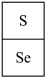
回答下列问题:
(1)基态硒原子的核外电子排布式为____________ 。单质硒的熔点为221℃,其晶体类型____________ 。
(2)根据元素周期律,电负性:Se______ S,第一电离能Ga______ As。(填“>”“<”或“=”),Se所在主族元素对应氢化物沸点最低的是______ (填化学式)。
(3)硒的含氧酸有H2SeO3,H2SeO4。酸性:H2SeO3______ H2SeO4(填“>”“<”或“=”)
(4)SeO3是一种无色晶状物,空气中易吸潮。请问Se原子的杂化方式为_____ ,SeO3的空间构型为_____ 。
(5)硒化锌材料是一种黄色透明的多晶材料,用于制造透红外线材料及红外线光学仪器,其晶胞如图所示(其中白色球表示硒原子),Zn原子的配位数为______ ,已知晶胞边长参数为anm,NA表示阿伏加德罗常数,则紧邻的Se2-与Zn2+之间的距离为______ nm(列出表达式),硒化锌的密度为______ g·cm-3(列出计算式)。
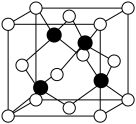

回答下列问题:
(1)基态硒原子的核外电子排布式为
(2)根据元素周期律,电负性:Se
(3)硒的含氧酸有H2SeO3,H2SeO4。酸性:H2SeO3
(4)SeO3是一种无色晶状物,空气中易吸潮。请问Se原子的杂化方式为
(5)硒化锌材料是一种黄色透明的多晶材料,用于制造透红外线材料及红外线光学仪器,其晶胞如图所示(其中白色球表示硒原子),Zn原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】海洋是元素的摇篮,海水中含有大量卤族元素。NaCl的晶胞结构示意图(晶胞边长为a nm)和晶胞截面图如下所示。

(1)元素Na的价电子被激发到相邻高能级后形成激发态Na原子,其价电子轨道表示式为___________ 。
(2)除了NaCl,Cl元素还能形成多种价态的化合物,如NaClO、NaClO2、NaClO3、NaClO4,这四种钠盐对应的酸的酸性依次增强,试解释HClO4的酸性强于HClO3的原因:___________ 。
(3)在适当的条件下,电解NaCl水溶液可制得NaClO3。
①NaCl水溶液中,不存在的微粒间作用力有___________ (填标号)。
A.离子键 B.极性键 C.配位键 D.氢键 E.范德华力
②根据价层电子对互斥理论,预测 的空间构型为
的空间构型为___________ ,写出一个 的等电子体的化学符号
的等电子体的化学符号___________ 。
(4)在NaCl晶体中,Na+位于Cl-所围成的___________ (填立体构型)的中心,该多面体的边长是___________ nm。
(5)Na+半径与Cl-半径的比值是___________ ( 保留小数点后三位, =1. 414)。
=1. 414)。

(1)元素Na的价电子被激发到相邻高能级后形成激发态Na原子,其价电子轨道表示式为
(2)除了NaCl,Cl元素还能形成多种价态的化合物,如NaClO、NaClO2、NaClO3、NaClO4,这四种钠盐对应的酸的酸性依次增强,试解释HClO4的酸性强于HClO3的原因:
(3)在适当的条件下,电解NaCl水溶液可制得NaClO3。
①NaCl水溶液中,不存在的微粒间作用力有
A.离子键 B.极性键 C.配位键 D.氢键 E.范德华力
②根据价层电子对互斥理论,预测
 的空间构型为
的空间构型为 的等电子体的化学符号
的等电子体的化学符号(4)在NaCl晶体中,Na+位于Cl-所围成的
(5)Na+半径与Cl-半径的比值是
 =1. 414)。
=1. 414)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】某盐的组成可表示为3[H3ON5]·3[NH4N5] ·NH4Cl,回答下列问题。
(1)氯原子的电子排布式为_______ 。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_____ 。氮元素的E1呈现异常的原因是___________ 。

(3)经X射线衍射测得化合物3[H3ON5]·3[NH4N5] ·NH4Cl的晶体结构,其局部结构如图(b)所示。
①H3O+中心原子的杂化类型为______ ,NH 的空间构型为
的空间构型为_____________ 。
②3[H3ON5]●3[NH4N5] ·NH4Cl中阴离子N 中的σ键总数为
中的σ键总数为____ 。 分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则N
),则N 中的大π键应表示为
中的大π键应表示为____________ 。
③图(b)中虚线代表氢键,其中表示式为(NH )N-H…Cl、
)N-H…Cl、______ 、______ 。
(4)3[H3ON5]●3[NH4N5] ·NH4Cl的晶体密度为dg/cm3,其立方晶胞参数为a nm,晶胞中含有y个3[H3ON5]●3[NH4N5] ·NH4Cl单元,该单元的相对质量为M,则y的计算表达式为______ 。
(1)氯原子的电子排布式为
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是

(3)经X射线衍射测得化合物3[H3ON5]·3[NH4N5] ·NH4Cl的晶体结构,其局部结构如图(b)所示。
①H3O+中心原子的杂化类型为
 的空间构型为
的空间构型为②3[H3ON5]●3[NH4N5] ·NH4Cl中阴离子N
 中的σ键总数为
中的σ键总数为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则N
),则N 中的大π键应表示为
中的大π键应表示为③图(b)中虚线代表氢键,其中表示式为(NH
 )N-H…Cl、
)N-H…Cl、(4)3[H3ON5]●3[NH4N5] ·NH4Cl的晶体密度为dg/cm3,其立方晶胞参数为a nm,晶胞中含有y个3[H3ON5]●3[NH4N5] ·NH4Cl单元,该单元的相对质量为M,则y的计算表达式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】钇钡铜氧(YBa2Cu3O7-x)是一种高温超导材料(其中Y显+3价,Cu显+2、+3价),最早是将BaCO3、Y2(CO3)3和CuCO3混合在高温下反应制备的。
请回答下列问题:
(1)Y(钇)是一种重要的稀土金属,与Sc(钪)同族相邻。则Y原子核外有___________ 个价电子。Y位于元素周期表的___________ 区。
(2)在BaCO3中,CO32-的空间构型为___________ ,C原子采取___________ 杂化;BaCO3、CaCO3受热分解分别生成BaO、CaO,BaO、CaO熔点较高的是___________ (填化学式)。
(3)基态Cu3+的核外电子排布式为___________ 。
(4)若YBa2Cu3O7-x(0≤x≤0.5)材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=___________ 。
(5)铜有两种氧化物:CuO和Cu2O,后者比前者的热稳定性强,原因是___________ 。
(6)如图是某种超导材料A的晶胞结构示意图,其化学式为___________ 。若A的摩尔质量为M g·mol-1,阿伏伽德罗常数的值为NA,晶胞参数为apm、apm、bpm,则晶体的密度为___________ g·cm-3。
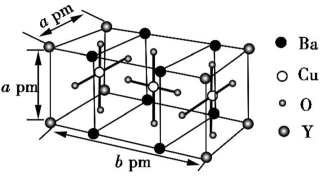
请回答下列问题:
(1)Y(钇)是一种重要的稀土金属,与Sc(钪)同族相邻。则Y原子核外有
(2)在BaCO3中,CO32-的空间构型为
(3)基态Cu3+的核外电子排布式为
(4)若YBa2Cu3O7-x(0≤x≤0.5)材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=
(5)铜有两种氧化物:CuO和Cu2O,后者比前者的热稳定性强,原因是
(6)如图是某种超导材料A的晶胞结构示意图,其化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铁、铜、锌是重要的过渡元素,其化合物种类繁多,具有广泛的用途。
(1)血红素是由中心Fe2+及配体卟啉衍生物组合成大环配位化合物,结构如图所示:

①Fe2+的电子排布式为___________ 。
②血红素中C、N、O的第一电离能由大到小分别为___________ 。
(2)合成氨工业常用醋酸二氨合铜[Cu(NH3)2]Ac溶液吸收对合成氨反应的催化剂有毒害的气体CO。
①写出一个与CO互为等电子体的离子:_______ 。
②醋酸二氨合铜水解生成的醋酸(HAc)的结构式为 ,则HAc分子中π键和σ键的数目之比为
,则HAc分子中π键和σ键的数目之比为_______ ,HAc中碳原子的杂化类型为______ ,分子中键角α______ (填“>”“<”或“=”)键角β。
(3)工业上一般利用闪锌矿(主要成分是ZnS)为原料制备锌,ZnS的晶胞结构如图所示,则锌的配位数为________ ;已知图中立方体棱长为acm,则该晶体的密度为________ g/cm3(写出计算式,设阿伏加德罗常数的值为NA)。

(1)血红素是由中心Fe2+及配体卟啉衍生物组合成大环配位化合物,结构如图所示:

①Fe2+的电子排布式为
②血红素中C、N、O的第一电离能由大到小分别为
(2)合成氨工业常用醋酸二氨合铜[Cu(NH3)2]Ac溶液吸收对合成氨反应的催化剂有毒害的气体CO。
①写出一个与CO互为等电子体的离子:
②醋酸二氨合铜水解生成的醋酸(HAc)的结构式为
 ,则HAc分子中π键和σ键的数目之比为
,则HAc分子中π键和σ键的数目之比为(3)工业上一般利用闪锌矿(主要成分是ZnS)为原料制备锌,ZnS的晶胞结构如图所示,则锌的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】阿散酸( )是一种饲料添加剂,能溶于Na2CO3溶液中。常含有H3AsO3、NaCl等杂质。
)是一种饲料添加剂,能溶于Na2CO3溶液中。常含有H3AsO3、NaCl等杂质。
(1)基态As原子核外电子排布式为___ 。
(2)CO 中心原子杂化轨道的杂化类型为
中心原子杂化轨道的杂化类型为___ ,AsO 的空间构型为
的空间构型为__ (用文字描述)。
(3)与AsO 互为等电子体的分子为
互为等电子体的分子为___ (填化学式)。
(4)Ge、As、Se三种元素的第一电离能由小到大的顺序为__ 。
(5)NaCl晶体在50~300GPa的高压下和Na或Cl2反应,可以形成不同的晶体。其中一种晶体的晶胞如图,该晶体的化学式为___ 。
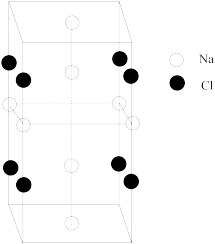
 )是一种饲料添加剂,能溶于Na2CO3溶液中。常含有H3AsO3、NaCl等杂质。
)是一种饲料添加剂,能溶于Na2CO3溶液中。常含有H3AsO3、NaCl等杂质。(1)基态As原子核外电子排布式为
(2)CO
 中心原子杂化轨道的杂化类型为
中心原子杂化轨道的杂化类型为 的空间构型为
的空间构型为(3)与AsO
 互为等电子体的分子为
互为等电子体的分子为(4)Ge、As、Se三种元素的第一电离能由小到大的顺序为
(5)NaCl晶体在50~300GPa的高压下和Na或Cl2反应,可以形成不同的晶体。其中一种晶体的晶胞如图,该晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大。X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态。请回答下列问题:
(1)R基态原子的外围电子排布式为____ ,其基态原子有__ 种能量不同的电子。
(2)元素X、Y、Z的第一电离能由小到大的顺序为(用元素符号表示)____ 。
(3)与XYZ-互为等电子体微粒的化学式为______ (写出一种即可),XYZ-的中心原子的杂化方式为_____ 。
(4)R2+与NH3形成的配离子中,提供孤对电子的原子是__ 。
(5)已知Z、R能形成两种化合物,其晶胞如图所示,甲的化学式为__ ,乙的化学式为__ ;高温时,甲易转化为乙的原因为_____________ 。
(6)若甲晶体中一个晶胞的边长为a pm,则甲晶体的密度为______ g·cm-3(写出含a的表达式,用NA表示阿伏伽德罗常数的值)。
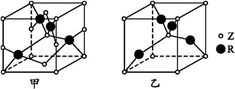
(1)R基态原子的外围电子排布式为
(2)元素X、Y、Z的第一电离能由小到大的顺序为(用元素符号表示)
(3)与XYZ-互为等电子体微粒的化学式为
(4)R2+与NH3形成的配离子中,提供孤对电子的原子是
(5)已知Z、R能形成两种化合物,其晶胞如图所示,甲的化学式为
(6)若甲晶体中一个晶胞的边长为a pm,则甲晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价电子排布式为_______ ,基态氧原子的价层电子排布式不能表示为2s22px22py2,因为这违背了_______ 原理(规则)。
(2)[B(OH)4]-中硼原子的杂化轨道类型为______ ,氧原子的价层电子对互斥模型是_____ 。[Sn(OH)6] 2-中,Sn与O之间的化学键不可能是_____ 。
a.π键 b.σ键 c.配位键 d.极性键
(3)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式_______ ,并写出一种与氨硼烷互为等电子体的分子_______ (填化学式)。
(4)已知硼酸(H3BO3)为一元弱酸,写出硼酸表现一元弱酸性的电离方程式________ 。
(5)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较高的是_______ (填化学式),其原因是___________ 。
(6)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则2号砷原子的坐标为______ 。已知阿伏加 德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______ g·cm-3(列出含a、NA的计算式即可)。

(1)基态Sn原子价电子排布式为
(2)[B(OH)4]-中硼原子的杂化轨道类型为
a.π键 b.σ键 c.配位键 d.极性键
(3)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式
(4)已知硼酸(H3BO3)为一元弱酸,写出硼酸表现一元弱酸性的电离方程式
(5)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较高的是
(6)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则2号砷原子的坐标为

您最近一年使用:0次
【推荐1】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第________ 周期________ 族。
(2)C、N、O三种元素的第一电离能由大到小的顺序为________________ 。
(3)Cu+的电子排布式为________________________ ,其在酸性溶液中不稳定,可发生歧化反应生成Cu 2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O________________________________________ 。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是________ ,乙醛分子中H﹣C﹣O的键角________ 乙醇分子中的H﹣C﹣O的键角(填“大于”、“等于”或“小于”)。
(5)[Cu(H2O)4]2+中的两个H2O被Cl-取代有两种不同的结构,则[Cu(H2O)4]2+的结构为________ 形。
(6)Cu3N的晶胞结构如图,N3﹣的配位数为________ ,Cu+半径为a pm,N3﹣半径为bpm,Cu3N的密度________________ g/cm3。(阿伏加德罗为常数用NA表示)(1pm=10﹣10 cm)

(1)N位于周期表中第
(2)C、N、O三种元素的第一电离能由大到小的顺序为
(3)Cu+的电子排布式为
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是
(5)[Cu(H2O)4]2+中的两个H2O被Cl-取代有两种不同的结构,则[Cu(H2O)4]2+的结构为
(6)Cu3N的晶胞结构如图,N3﹣的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】(1)某短周期金属元素R的部分电离能情况如图Ⅰ所示,则元素 R 位于周期表第_______ 族,其基态原子的电子排布式是_______ 。图Ⅱ中A、B、C、D是四种不同主族元素的气态氢化物,其中 A 比 B 分子沸点高的可能原因是_______ 。

(2)图Ⅱ中 C 物质能与很多化合物通过配位键发生相互作用。例如:C 与第二周期中的另一种元素的氢化物相互作用得到的化合物 X 是科学家潜心研究的一种储氢材料,X 是乙烷的等电子体;加热 X 会缓慢释放 H2,转变为化合物 Y,Y 是乙烯的等电子体。
①化合物 C 的分子立体构型为_______ ,X 的结构式为_______ (必须标明配位键)。
②形成 C 物质的中心原子在 X、Y 分子中的杂化方式分别是_______ ,Y 分子中σ键和π键数目之比为_______ 。
(3)过渡金属钛有“生物金属”之称,其化合态以+4价最稳定。回答下列问题:
①工业上通过蒸馏还原 TiCl4制得单质钛。常温下 TiCl4是一种有刺激性臭味的无色液体,熔点-23.2 ℃,沸点136.2 ℃,推断 TiCl4属于_______ 晶体。
②Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色)、[TiCl(H2O)5]Cl2·H2O(绿色),两者配位数_______ (填“相同”或“不同”),绿色晶体中配体是_______ 。
③TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常为链状聚合形式的阳离子,其结构形式如图Ⅲ,化学式为_______ 。

④TiO2与BaCO3一起熔融可制得偏钛酸钡,该物质热稳定性好,介电常数高,是制造大容量电容器的极好材料。该晶体晶胞的结构示意图如图Ⅳ。请写出制备偏钛酸钡的化学方程式:_______ 。

(2)图Ⅱ中 C 物质能与很多化合物通过配位键发生相互作用。例如:C 与第二周期中的另一种元素的氢化物相互作用得到的化合物 X 是科学家潜心研究的一种储氢材料,X 是乙烷的等电子体;加热 X 会缓慢释放 H2,转变为化合物 Y,Y 是乙烯的等电子体。
①化合物 C 的分子立体构型为
②形成 C 物质的中心原子在 X、Y 分子中的杂化方式分别是
(3)过渡金属钛有“生物金属”之称,其化合态以+4价最稳定。回答下列问题:
①工业上通过蒸馏还原 TiCl4制得单质钛。常温下 TiCl4是一种有刺激性臭味的无色液体,熔点-23.2 ℃,沸点136.2 ℃,推断 TiCl4属于
②Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色)、[TiCl(H2O)5]Cl2·H2O(绿色),两者配位数
③TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常为链状聚合形式的阳离子,其结构形式如图Ⅲ,化学式为

④TiO2与BaCO3一起熔融可制得偏钛酸钡,该物质热稳定性好,介电常数高,是制造大容量电容器的极好材料。该晶体晶胞的结构示意图如图Ⅳ。请写出制备偏钛酸钡的化学方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】KMnO4是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的___ 区,基态Mn2+的核外电子排布式可表示为___ 。
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为___ 。
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为___ 。C2O 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是___ 。
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是___ 。
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。

①β—MnSe中Mn的配位数为___ 。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为___ pm。
 +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:(1)按电子排布K位于元素周期表的
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为
 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。

①β—MnSe中Mn的配位数为
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为
您最近一年使用:0次



