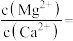元素铬( )在溶液中主要以
)在溶液中主要以 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(1)在 溶液中加入过量
溶液中加入过量 溶液,溶液由蓝紫色变为绿色,写出相应的离子方程式:
溶液,溶液由蓝紫色变为绿色,写出相应的离子方程式:___________ 。
(2) 和
和 在溶液中可相互转化:
在溶液中可相互转化: (反应A)。室温下,初始浓度为
(反应A)。室温下,初始浓度为 的
的 溶液中
溶液中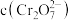 随
随 的变化如图所示(整个过程中溶液体积保持不变)。
的变化如图所示(整个过程中溶液体积保持不变)。
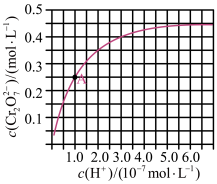
①由图可知,溶液 减小,
减小, 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”)。根据A点数据,计算出反应A的平衡常数为___________ 。
②升高温度,溶液中 的平衡转化率减小;则反应A的
的平衡转化率减小;则反应A的
___________ (填“>”或“<”)0。
③向酸性 溶液中加水,有同学认为溶液中所有离子的浓度都减小,你是否同意并说明理由
溶液中加水,有同学认为溶液中所有离子的浓度都减小,你是否同意并说明理由___________ 。
④向酸性 溶液(橙色)中加入少量氢氧化钠固体(忽略溶液体积的变化),振荡后立即观察到溶液变为黄色,该结果不足以证明
溶液(橙色)中加入少量氢氧化钠固体(忽略溶液体积的变化),振荡后立即观察到溶液变为黄色,该结果不足以证明 浓度的减小使得反应A的平衡逆向移动,理由是:
浓度的减小使得反应A的平衡逆向移动,理由是:___________ 。
(3)在化学分析中采用 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中 为
为___________  。(已知
。(已知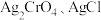 的
的 分别为
分别为 和
和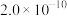 )
)
(4)向酸性 溶液中加入乙醇(乙醇被氧化为乙酸),溶液变为蓝紫色,反应的离子方程式为
溶液中加入乙醇(乙醇被氧化为乙酸),溶液变为蓝紫色,反应的离子方程式为___________ 。
 )在溶液中主要以
)在溶液中主要以 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:(1)在
 溶液中加入过量
溶液中加入过量 溶液,溶液由蓝紫色变为绿色,写出相应的离子方程式:
溶液,溶液由蓝紫色变为绿色,写出相应的离子方程式:(2)
 和
和 在溶液中可相互转化:
在溶液中可相互转化: (反应A)。室温下,初始浓度为
(反应A)。室温下,初始浓度为 的
的 溶液中
溶液中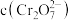 随
随 的变化如图所示(整个过程中溶液体积保持不变)。
的变化如图所示(整个过程中溶液体积保持不变)。
①由图可知,溶液
 减小,
减小, 的平衡转化率
的平衡转化率②升高温度,溶液中
 的平衡转化率减小;则反应A的
的平衡转化率减小;则反应A的
③向酸性
 溶液中加水,有同学认为溶液中所有离子的浓度都减小,你是否同意并说明理由
溶液中加水,有同学认为溶液中所有离子的浓度都减小,你是否同意并说明理由④向酸性
 溶液(橙色)中加入少量氢氧化钠固体(忽略溶液体积的变化),振荡后立即观察到溶液变为黄色,该结果不足以证明
溶液(橙色)中加入少量氢氧化钠固体(忽略溶液体积的变化),振荡后立即观察到溶液变为黄色,该结果不足以证明 浓度的减小使得反应A的平衡逆向移动,理由是:
浓度的减小使得反应A的平衡逆向移动,理由是:(3)在化学分析中采用
 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中 为
为 。(已知
。(已知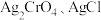 的
的 分别为
分别为 和
和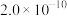 )
)(4)向酸性
 溶液中加入乙醇(乙醇被氧化为乙酸),溶液变为蓝紫色,反应的离子方程式为
溶液中加入乙醇(乙醇被氧化为乙酸),溶液变为蓝紫色,反应的离子方程式为
更新时间:2023-07-13 17:24:11
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】 的转化目前主要有以下两种方法:
的转化目前主要有以下两种方法:
(1)方法①的化学方程式是_______ 。
(2)方法②,将 和
和 的混合气体通入
的混合气体通入 、
、 的混合溶液中反应回收S,物质转化如图所示。下列说法不正确的是_______。
的混合溶液中反应回收S,物质转化如图所示。下列说法不正确的是_______。
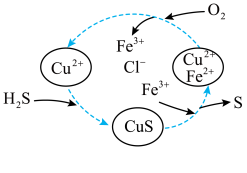
 的转化目前主要有以下两种方法:
的转化目前主要有以下两种方法:| 方法① | 克劳斯燃烧法 | 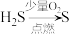 |
| 方法② | 铁盐、铜盐氧化法 |  |
(2)方法②,将
 和
和 的混合气体通入
的混合气体通入 、
、 的混合溶液中反应回收S,物质转化如图所示。下列说法不正确的是_______。
的混合溶液中反应回收S,物质转化如图所示。下列说法不正确的是_______。
A. 和 和 反应的离子方程式为 反应的离子方程式为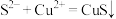 |
B. 在转化过程中发生的反应为 在转化过程中发生的反应为 |
C.整个反应过程中溶液的pH值变小(不考虑产生 的稀释效果) 的稀释效果) |
D.提高混合气体中 的比例可防止生成的硫单质中混有 的比例可防止生成的硫单质中混有 |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】氧化还原反应在高中化学中是一类重要的反应类型。FeCl3、KClO3是中学化学中常用的氧化剂。回答下列问题:
(1)下列基本反应类型中一定属于氧化还原反应的是_______(填字母)。
(2)实验室迅速制备少量氯气可利用如下反应:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)。
①上述反应中被还原的元素为_______ (填元素符号)。
②MnO 与Fe2+反应生成Mn2+,反应后Fe2+转化为
与Fe2+反应生成Mn2+,反应后Fe2+转化为_______ ,Fe2+发生_______ 反应(填“氧化”或“还原”。)
③配平以下化学方程式并用双线桥标出电子转移的方向和数目:_______ 。
口KMnO4+口HCl(浓)→口KCl+口MnCl2+口Cl2↑+口H2O(未配平)
(3)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用2FeCl3+Cu=CaCl2+2X表示。
①上式中X的化学式为_______ 。
②若有32g铜被氧化,则参与反应的FeCl3的质量为_______ g。
③该反应的离子方程式为_______ 。
(1)下列基本反应类型中一定属于氧化还原反应的是_______(填字母)。
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
①上述反应中被还原的元素为
②MnO
 与Fe2+反应生成Mn2+,反应后Fe2+转化为
与Fe2+反应生成Mn2+,反应后Fe2+转化为③配平以下化学方程式并用双线桥标出电子转移的方向和数目:
口KMnO4+口HCl(浓)→口KCl+口MnCl2+口Cl2↑+口H2O(未配平)
(3)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用2FeCl3+Cu=CaCl2+2X表示。
①上式中X的化学式为
②若有32g铜被氧化,则参与反应的FeCl3的质量为
③该反应的离子方程式为
您最近一年使用:0次
【推荐3】二氧化氯(ClO2)是国际公认的广谱、高效和安全的杀菌剂。
(1)制备C1O2的一种方法是在酸性条件下用草酸(碳的价态+3价)和氯酸钠反应,配平该反应的化学方程式,并标出电子转移的方向和数目:________ 。
_____H2C2O4+_____NaClO3+____H2SO4→_____ Na2SO4+___CO2↑+_____ClO2↑+___ H2O
(2)上述反应中被氧化的元素是____ ,氧化产物是_____ 。
(3)若反应中生成1.12L(标况) ClO2,转移电子数目为________ 。
(4)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,计算ClO2的消毒能力是等质量Cl2的_____ 倍(保留2位小数)。
(5)若以NaClO2为原料制备ClO2,需要加入具有____ (填“氧化性”或“还原性”)的物质。
(1)制备C1O2的一种方法是在酸性条件下用草酸(碳的价态+3价)和氯酸钠反应,配平该反应的化学方程式,并标出电子转移的方向和数目:
_____H2C2O4+_____NaClO3+____H2SO4→_____ Na2SO4+___CO2↑+_____ClO2↑+___ H2O
(2)上述反应中被氧化的元素是
(3)若反应中生成1.12L(标况) ClO2,转移电子数目为
(4)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,计算ClO2的消毒能力是等质量Cl2的
(5)若以NaClO2为原料制备ClO2,需要加入具有
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,即2NO+2CO 2CO2+N2。
2CO2+N2。
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度如表(CO2和N2的起始浓度为0)。
回答下列问题:
(1)已知在上述反应中,反应物总能量大于生成物总能量,则正反应是___ 反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率:v(N2)=___ 。
(3)t1℃时该反应的平衡常数表达式:K=___ 。
(4)假设在密闭容器中该反应达到平衡后,改变下列条件,能提高NO转化率的是___ (选填答案编号)。
a.选用更有效的催化剂 b.升高反应体系的温度
c.降低反应体系的温度 d.缩小容器的体积
 2CO2+N2。
2CO2+N2。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度如表(CO2和N2的起始浓度为0)。
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4,mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(×10-3,mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
回答下列问题:
(1)已知在上述反应中,反应物总能量大于生成物总能量,则正反应是
(2)前3s内的平均反应速率:v(N2)=
(3)t1℃时该反应的平衡常数表达式:K=
(4)假设在密闭容器中该反应达到平衡后,改变下列条件,能提高NO转化率的是
a.选用更有效的催化剂 b.升高反应体系的温度
c.降低反应体系的温度 d.缩小容器的体积
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】氢能是一种清洁能源,按照生产过程中的碳排放情况分为灰氢、蓝氢和绿氢。
(1)煤的气化制得灰氢 :C(s)+H2O(g)  CO(g)+H2(g)。该反应的平衡常数表达式K=
CO(g)+H2(g)。该反应的平衡常数表达式K=_______ 。该方法生产过程有CO2排放。
(2)甲烷水蒸气催化重整制得蓝氢 ,步骤如下。
I.H2的制取:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
①为提高CH4的平衡转化率,可采取的措施有_______ (写出两条即可)。
II.H2的富集:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
②已知830℃时,该反应的平衡常数K=1。在容积不变的的密闭容器中,将2molCO与8molH2O混合加热到830℃,反应达平衡时CO的转化率为_______ 。
III.用 吸收
吸收 实现低碳排放。
实现低碳排放。 消耗率随时间变化关系如图所示。
消耗率随时间变化关系如图所示。

③比较温度高低:T1_______ T2(填“>”或“<”)。
(3)热化学硫碘循环分解水制得绿氢 ,全程零碳排放。反应如下:
反应i:SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) ∆H1=-82kJ·mol−1
反应ii:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ∆H2=+544kJ·mol−1
反应iii:……
反应ⅰ~iii循环实现分解水:2H2O(g)=2H2(g)+O2(g) ∆H=+484kJ·mol−1。写出反应iii的热化学方程式_______ 。
(1)煤的气化制得
 CO(g)+H2(g)。该反应的平衡常数表达式K=
CO(g)+H2(g)。该反应的平衡常数表达式K=(2)甲烷水蒸气催化重整制得
I.H2的制取:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0①为提高CH4的平衡转化率,可采取的措施有
II.H2的富集:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0②已知830℃时,该反应的平衡常数K=1。在容积不变的的密闭容器中,将2molCO与8molH2O混合加热到830℃,反应达平衡时CO的转化率为
III.用
 吸收
吸收 实现低碳排放。
实现低碳排放。 消耗率随时间变化关系如图所示。
消耗率随时间变化关系如图所示。
③比较温度高低:T1
(3)热化学硫碘循环分解水制得
反应i:SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) ∆H1=-82kJ·mol−1
反应ii:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ∆H2=+544kJ·mol−1
反应iii:……
反应ⅰ~iii循环实现分解水:2H2O(g)=2H2(g)+O2(g) ∆H=+484kJ·mol−1。写出反应iii的热化学方程式
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】二氧化碳与氢气催化合成甲醇,发生的反应为: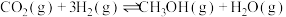
(1)已知:
计算上述反应的
___________  。
。
(2)一定条件下,往2L恒容密闭容器中充入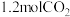 和
和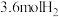 ,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制下图:
,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制下图:

( 时,图中c点转化率为66.67%,即转化了2/3)
时,图中c点转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是___________ (填“反应I”,“反应II”,“反应III”)。
② 的b点υ(正)
的b点υ(正)___________ υ(逆) (填“>”,“<”,“=”)。
③ 的a点转化率比
的a点转化率比 的c点高的原因是
的c点高的原因是___________ 。
④求温度为 时,该反应的平衡常数K
时,该反应的平衡常数K__________ 。写出计算过程(结果保留三位有效数字)。
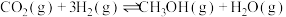
(1)已知:
| 化学键 | H−H | C−O | C=O | H−O | C−H |
| 键能/kJ∙mol-1 | 436 | 326 | 803 | 464 | 414 |
计算上述反应的

 。
。(2)一定条件下,往2L恒容密闭容器中充入
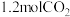 和
和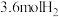 ,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制下图:
,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制下图:| 相同时间内CO2转化率 |  |  |  |  |  |
| 反应I | 65% | 77% | 80% | 80% | 66.67% |
| 反应II | 56% | 67% | 76% | 80% | 66.67% |
| 反应III | 48% | 62% | 72% | 80% | 66.67% |

(
 时,图中c点转化率为66.67%,即转化了2/3)
时,图中c点转化率为66.67%,即转化了2/3)①催化剂效果最佳的反应是
②
 的b点υ(正)
的b点υ(正)③
 的a点转化率比
的a点转化率比 的c点高的原因是
的c点高的原因是④求温度为
 时,该反应的平衡常数K
时,该反应的平衡常数K
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】温度为 ,在三个容积均为
,在三个容积均为 的恒容密闭容器中仅发生反应
的恒容密闭容器中仅发生反应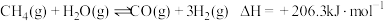 ,该反应中,正反应速率为
,该反应中,正反应速率为 ,逆反应速率为
,逆反应速率为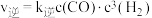 ,
, 、
、 为速率常数,受温度影响。已知
为速率常数,受温度影响。已知 时,
时, ,则该温度下,平衡常数
,则该温度下,平衡常数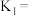
_______ ;当温度改变为 时,若
时,若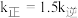 ,则
,则
_______ (填“>”“=”或“<”) 。
。
 ,在三个容积均为
,在三个容积均为 的恒容密闭容器中仅发生反应
的恒容密闭容器中仅发生反应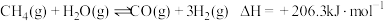 ,该反应中,正反应速率为
,该反应中,正反应速率为 ,逆反应速率为
,逆反应速率为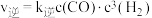 ,
, 、
、 为速率常数,受温度影响。已知
为速率常数,受温度影响。已知 时,
时, ,则该温度下,平衡常数
,则该温度下,平衡常数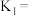
 时,若
时,若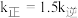 ,则
,则
 。
。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g) △H=+131.3 kJ·mol-1,△S=+133.7 J·mol-1·K-1。
H2(g)+CO(g) △H=+131.3 kJ·mol-1,△S=+133.7 J·mol-1·K-1。
①该反应在低温下_________ (填“能”或“不能”)自发进行。
②写出该反应的平衡常数表达式_________ 。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400℃时,2NH3(g) N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=_________ (填数值)。
②400℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)_________ v逆(N2)(填“>”、“<”“=”或“不能确定”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡_________ 移动(填“向左”、“向右”或“不”);加入催化剂,反应的△H_________ (填“增大”、“减小”或“不改变”)。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)
 H2(g)+CO(g) △H=+131.3 kJ·mol-1,△S=+133.7 J·mol-1·K-1。
H2(g)+CO(g) △H=+131.3 kJ·mol-1,△S=+133.7 J·mol-1·K-1。①该反应在低温下
②写出该反应的平衡常数表达式
(2)已知在400℃时,N2(g)+3H2(g)
 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。①在400℃时,2NH3(g)
 N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=②400℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】在一个2L的恒容密闭容器中,加入3molA和1molB发生如下反应:3A(g)+B(g) 2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应是___ 反应(填“吸热”或“放热”),D的状态是__ (填“气态”或“非气态”)。
(2)达到平衡时,A的转化率为___ ,此温度下的平衡常数K=___ (保留两位小数)。
(3)若加入适量B,则A的转化率将___ (填“增大”“减小”或“不变”,下同),化学平衡常数将__ 。
(4)若B是有色物质,A、C均为无色物质,则上述反应达到平衡后:
①再加入适量A时,混合物的颜色___ (填“变浅”“变深”或“不变”,下同);
②再加入适量C时,混合物的颜色__ 。
 2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应是
(2)达到平衡时,A的转化率为
(3)若加入适量B,则A的转化率将
(4)若B是有色物质,A、C均为无色物质,则上述反应达到平衡后:
①再加入适量A时,混合物的颜色
②再加入适量C时,混合物的颜色
您最近一年使用:0次
【推荐1】碳和硫的化合物在生产生活中的应用非常广泛。
⑴用生物质热解气(主要成分为CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g) + SO2 (g) = S(g) + 2CO2(g) ΔH1 = +8.0kJ/mol
2CO(g) + O2 (g) = 2CO2(g) ΔH2 = -566.0kJ/mol
2H2 (g) + O2 (g) = 2H2O (g) ΔH3 = -483.6kJ/mol
则2H2 (g) + SO2 (g) = S(g) + 2 H2O (g) ΔH4 =________
⑵欲用1L Na2CO3溶液将6.99gBaSO4固体全部转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为________ 。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11, Ksp(BaCO3)=1×10-10]
(3)在25 ℃时,将a mol/L的氨水溶液与0.02mol/L的HCl溶液等体积混合后溶液呈中性,则氨水的电离平衡常数Kb =________ 。
⑴用生物质热解气(主要成分为CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g) + SO2 (g) = S(g) + 2CO2(g) ΔH1 = +8.0kJ/mol
2CO(g) + O2 (g) = 2CO2(g) ΔH2 = -566.0kJ/mol
2H2 (g) + O2 (g) = 2H2O (g) ΔH3 = -483.6kJ/mol
则2H2 (g) + SO2 (g) = S(g) + 2 H2O (g) ΔH4 =
⑵欲用1L Na2CO3溶液将6.99gBaSO4固体全部转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
(3)在25 ℃时,将a mol/L的氨水溶液与0.02mol/L的HCl溶液等体积混合后溶液呈中性,则氨水的电离平衡常数Kb =
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s) 3Ca2+(aq)+2PO43﹣(aq)
3Ca2+(aq)+2PO43﹣(aq)
(1)溶度积Ksp=_________________ ;
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10﹣6 mol•L﹣1,c(PO43﹣)=1.58×10﹣6 mol•L﹣1,Ksp=___________ .
 3Ca2+(aq)+2PO43﹣(aq)
3Ca2+(aq)+2PO43﹣(aq)(1)溶度积Ksp=
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10﹣6 mol•L﹣1,c(PO43﹣)=1.58×10﹣6 mol•L﹣1,Ksp=
您最近一年使用:0次

 ,还含有少量
,还含有少量 、
、 、
、 、
、 、
、 、
、 的流程如图所示,回答下列问题。
的流程如图所示,回答下列问题。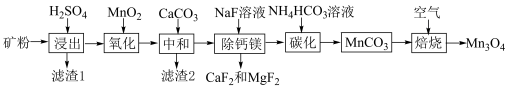
 ,
,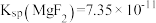 。
。