含氮污染物的有效去除和资源的充分利用是重要研究课题,回答下列问题:
(1)利用工业尾气NO2与O3反应制备新型硝化剂N2O5,过程涉及以下反应:
Ⅰ.2O3(g)=3O2(g)△H1 平衡常数为K1
Ⅱ.4NO2(g)+O2(g)=2N2O5(g)△H2 平衡常数为K2
Ⅲ.2NO2(g)+O3(g)=N2O5(g)+O2(g)△H3平衡常数为K3
平衡常数K与温度T的函数关系为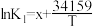 、
、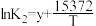 、
、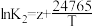 ,其中x、y、z为常数。
,其中x、y、z为常数。
①K1=________ (用含K2、K3的等式表示)。
②反应△H2________ 0 (填>或<),反应Ⅰ________ (填“高温“、“低温”或“任意温度”)下能自发进行。
③平衡常数与温度的函数关系式和②中一致,则 的取值范围是
的取值范围是________ 。(填序号)
A.<-2 B.-2~0 C.0~2 D.>2
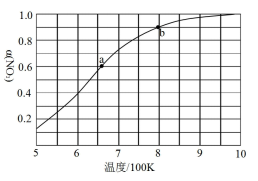
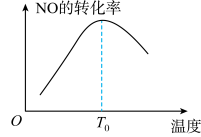
(2)NH3与O2作用分别生成N2、NO和N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去,将一定比例的NH3和N2的混合气体以一定的流速通过装有催化剂的反应管,NH3的转化率、N2的选择性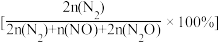 与温度的关系如图所示。
与温度的关系如图所示。
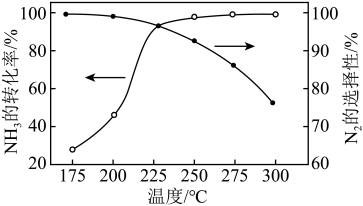
①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化合物的含量____ (填“增大”或“减小“)。
②综合上述信息,需研发________ (填“高温“或“低温“)下N2选择性和催化效果更高的催化剂,能更有效除去尾气中的NH3。
(3)在催化剂条件下发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始体系中气体分压p(CO)=p(NO)且p(CO2)=2p(N2),测得反应体系中CO和N2的分压随时间变化情况如表所示。
200℃时,该反应的化学平衡常数Kp=_______ (kPa)-1[Kp表示平衡常数计算表达式中用分压代替浓度计算所得的值],该反应的△H_________ 0(填“>“或“<“)。
(1)利用工业尾气NO2与O3反应制备新型硝化剂N2O5,过程涉及以下反应:
Ⅰ.2O3(g)=3O2(g)△H1 平衡常数为K1
Ⅱ.4NO2(g)+O2(g)=2N2O5(g)△H2 平衡常数为K2
Ⅲ.2NO2(g)+O3(g)=N2O5(g)+O2(g)△H3平衡常数为K3
平衡常数K与温度T的函数关系为
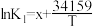 、
、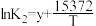 、
、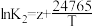 ,其中x、y、z为常数。
,其中x、y、z为常数。①K1=
②反应△H2
③平衡常数与温度的函数关系式和②中一致,则
 的取值范围是
的取值范围是A.<-2 B.-2~0 C.0~2 D.>2
(2)NH3与O2作用分别生成N2、NO和N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去,将一定比例的NH3和N2的混合气体以一定的流速通过装有催化剂的反应管,NH3的转化率、N2的选择性
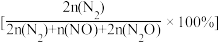 与温度的关系如图所示。
与温度的关系如图所示。
①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化合物的含量
②综合上述信息,需研发
(3)在催化剂条件下发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始体系中气体分压p(CO)=p(NO)且p(CO2)=2p(N2),测得反应体系中CO和N2的分压随时间变化情况如表所示。
| 时间/min | 0 | 30 | 60 | 120 | 180 | |
| 200℃ | CO的分压/kPa | 4 | 8.8 | 13 | 20 | 20 |
| N2的分压/kPa | 48 | 45.6 | 43.5 | 40 | 40 | |
| 300℃ | CO的分压/kPa | 100 | 69.0 | 48 | 48 | 48 |
| N2的分压/kPa | 10 | 25.5 | 36 | 36 | 36 | |
更新时间:2023-06-20 16:59:17
|
相似题推荐
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐1】人体内的血红蛋白(Hb)与肌红蛋白(Mb)均可结合 ,血红蛋白(Hb)与
,血红蛋白(Hb)与 结合的过程存在如下反应:
结合的过程存在如下反应:
①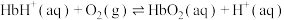

②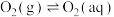

③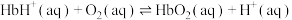

回答下列问题:
(1)
___________ 0(填“>”“<”),
___________ (用 、
、 表示)
表示)
(2)科研人员仅对于反应①进行模拟研究发现,37℃,pH=7.4时氧气分压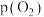 与达到平衡时
与达到平衡时 与
与 的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为
的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为___________ (在下图中绘出)。
(3)已知:气液平衡体系中,例如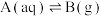 平衡常数表达式为:
平衡常数表达式为: 。则37℃,pH=7.4时,反应①的平衡常数为
。则37℃,pH=7.4时,反应①的平衡常数为___________ 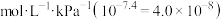
(4)高压氧舱常用于CO中毒治疗。若控制氧分压为80kPa,则37℃,pH=7.4时,达到平衡时 与氧气的结合度α(转化率)为
与氧气的结合度α(转化率)为___________ %(保留一位小数)。
(5)血液中还同时存在反应④: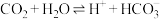 ,则氧分压
,则氧分压___________ (填“高”或“低”)有利于 排出体外。
排出体外。
(6)血液向肌肉细胞输送氧气时还存在反应⑤: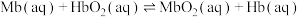 ,由
,由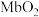 向肌肉细胞快速提供氧气。正常人Mb含量为
向肌肉细胞快速提供氧气。正常人Mb含量为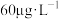 ,Hb含量为
,Hb含量为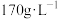 。下列说法正确的是___________。
。下列说法正确的是___________。
 ,血红蛋白(Hb)与
,血红蛋白(Hb)与 结合的过程存在如下反应:
结合的过程存在如下反应:①
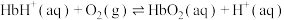

②
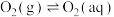

③
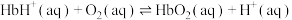

回答下列问题:
(1)


 、
、 表示)
表示)(2)科研人员仅对于反应①进行模拟研究发现,37℃,pH=7.4时氧气分压
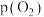 与达到平衡时
与达到平衡时 与
与 的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为
的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为
(3)已知:气液平衡体系中,例如
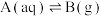 平衡常数表达式为:
平衡常数表达式为: 。则37℃,pH=7.4时,反应①的平衡常数为
。则37℃,pH=7.4时,反应①的平衡常数为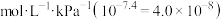
(4)高压氧舱常用于CO中毒治疗。若控制氧分压为80kPa,则37℃,pH=7.4时,达到平衡时
 与氧气的结合度α(转化率)为
与氧气的结合度α(转化率)为(5)血液中还同时存在反应④:
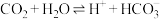 ,则氧分压
,则氧分压 排出体外。
排出体外。(6)血液向肌肉细胞输送氧气时还存在反应⑤:
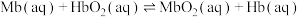 ,由
,由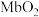 向肌肉细胞快速提供氧气。正常人Mb含量为
向肌肉细胞快速提供氧气。正常人Mb含量为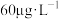 ,Hb含量为
,Hb含量为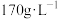 。下列说法正确的是___________。
。下列说法正确的是___________。| A.Hb结合氧气的能力强于Mb |
B.高氧分压下,血液中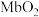 浓度增加 浓度增加 |
| C.高海拔居民体内Mb的含量偏高 |
| D.肌肉细胞中Mb浓度不变时,氧气运输达平衡 |
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐2】当发动机工作时, 反应产生的NO尾气是主要污染物之一, NO的脱除方法和转化机理是当前研究的热点。请回答下列问题:
(1)已知: 2NO(g)+O2 (g) =2NO2(g) △H1=-113kJ/mol
6NO2(g)+O3(g)=3N2O5(g) △H2=-227 kJ/mol
4NO2 (g)+O2(g)=2N2O5(g) △H3=-57 kJ/mol
则 2O3(g)= 3O2(g)是_______ 反应 (填 “放热” 或 “吸热” ), 以上 O3氧化脱除氮氧化物的总反应是NO(g)+O3(g)=NO2(g)+O2(g) △H4=_______ kJ/mol。
(2)已知: 2NO(g)+O2(g) ⇋ 2NO2(g)的反应历程分两步:
①表中k1、 k2、 k3、 k4是只随温度变化的常数, 温度升高将使其数值_______ (填 “增大” 或 “减小” )。
②反应I瞬间建立平衡, 因此决定2NO(g)+O2(g)⇌2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1_______ Ea2(填 “>”“<” 或 “=” ), 请依据有效碰撞理论微观探析其原因_______ 。
③一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)的速率方程为v正=k·c2 (NO)·c(O2),则k=_______ (用k1、 k2、k3表示)。
(3)将一定量的 NO2放入恒容密闭容器中发生下列反应:2NO2(g)⇌2NO(g)+O2(g), 测得其平衡转化率α(NO2)随温度变化如图所示, 从 b 点到 a 点降温平衡将向_______ 移动。若图中 a点对应温度下, NO2的起始压强为 160kPa, 则该温度下反应的分压平衡常数 Kp= _______ (用平衡分压代替平衡浓度计算, 分压=总压×物质的量分数)。
(1)已知: 2NO(g)+O2 (g) =2NO2(g) △H1=-113kJ/mol
6NO2(g)+O3(g)=3N2O5(g) △H2=-227 kJ/mol
4NO2 (g)+O2(g)=2N2O5(g) △H3=-57 kJ/mol
则 2O3(g)= 3O2(g)是
(2)已知: 2NO(g)+O2(g) ⇋ 2NO2(g)的反应历程分两步:
| 步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
| I | 2NO(g)⇌N2O2(g)(快) | Ea1 | v1正=k1·c2(NO) | v1逆=k2·c(N2O2) |
| II | N2O2(g)+O2(g)⇌2NO2(g)(慢) | Ea2 | v2正=k3·c(N2O2)·c(O2) | v2逆=k4·c2(NO2) |
①表中k1、 k2、 k3、 k4是只随温度变化的常数, 温度升高将使其数值
②反应I瞬间建立平衡, 因此决定2NO(g)+O2(g)⇌2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1
③一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)的速率方程为v正=k·c2 (NO)·c(O2),则k=
(3)将一定量的 NO2放入恒容密闭容器中发生下列反应:2NO2(g)⇌2NO(g)+O2(g), 测得其平衡转化率α(NO2)随温度变化如图所示, 从 b 点到 a 点降温平衡将向

您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】尿素  是常用的化肥与工业原料,其生产与应用有着重要的意义。
是常用的化肥与工业原料,其生产与应用有着重要的意义。
(1)尿素生产一般控制在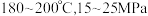 下进行,主要涉及下列反应:
下进行,主要涉及下列反应:
反应1
反应2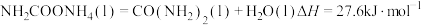
反应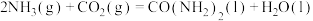 的
的
___________ 。
(2) 具有强还原性,生产尿素过程中,常通入适量氧气防止镍制容器表面的金属钝化膜
具有强还原性,生产尿素过程中,常通入适量氧气防止镍制容器表面的金属钝化膜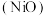 被破坏。
被破坏。
① 与
与 反应产生
反应产生 的化学方程式为
的化学方程式为___________ 。
②生产时通入的 气体中常混有少量
气体中常混有少量 。有氧气存在的条件下,
。有氧气存在的条件下, 腐蚀反应容器的速率会更快,其原因是
腐蚀反应容器的速率会更快,其原因是___________ 。
(3)尿素在结晶过程中主要副反应是尿素发生脱氨反应。其反应历程如下:
反应3 CO(NH2)2(l)=HNCO(g)+NH3(g) (快反应)
反应4 HNCO(g)+CO(NH2)2(l)=(H2NCO)2NH(l)(缩二脲) (慢反应)
①在缩二脲的结构式( )中圈出电子云密度最小的氢原子
)中圈出电子云密度最小的氢原子___________ 。
②在尿素结晶过程中,反应3可视为处于平衡状态。实验表明,在合成尿素的体系中, 的浓度越高,缩二脲生成速率越慢,其原因是
的浓度越高,缩二脲生成速率越慢,其原因是___________ 。
(4)含结晶水的 晶体表面存在结构“
晶体表面存在结构“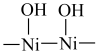 ”,用加热后的
”,用加热后的  晶体作催化剂,以
晶体作催化剂,以 为原料,电解
为原料,电解 溶液可获得尿素。
溶液可获得尿素。
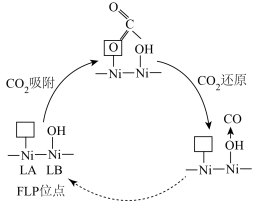
①生成尿素的电极方程式为___________ 。
②加热后的 晶体表面会产生
晶体表面会产生 位点,
位点, 位点与
位点与 位点共同形成
位点共同形成 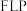 位点,其催化机理(部分)如图所示。实验表明,在
位点,其催化机理(部分)如图所示。实验表明,在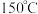 下加热
下加热  晶体得到的催化剂催化效果最好,温度过高或过低催化效果会降低的原因是
晶体得到的催化剂催化效果最好,温度过高或过低催化效果会降低的原因是___________ 。
③电解质溶液中若存在 极大地降低催化剂的活性,原因是
极大地降低催化剂的活性,原因是___________ 。
 是常用的化肥与工业原料,其生产与应用有着重要的意义。
是常用的化肥与工业原料,其生产与应用有着重要的意义。(1)尿素生产一般控制在
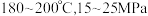 下进行,主要涉及下列反应:
下进行,主要涉及下列反应:反应1

反应2
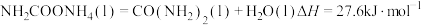
反应
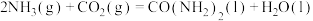 的
的
(2)
 具有强还原性,生产尿素过程中,常通入适量氧气防止镍制容器表面的金属钝化膜
具有强还原性,生产尿素过程中,常通入适量氧气防止镍制容器表面的金属钝化膜 被破坏。
被破坏。①
 与
与 反应产生
反应产生 的化学方程式为
的化学方程式为②生产时通入的
 气体中常混有少量
气体中常混有少量 。有氧气存在的条件下,
。有氧气存在的条件下, 腐蚀反应容器的速率会更快,其原因是
腐蚀反应容器的速率会更快,其原因是(3)尿素在结晶过程中主要副反应是尿素发生脱氨反应。其反应历程如下:
反应3 CO(NH2)2(l)=HNCO(g)+NH3(g) (快反应)
反应4 HNCO(g)+CO(NH2)2(l)=(H2NCO)2NH(l)(缩二脲) (慢反应)
①在缩二脲的结构式(
 )中圈出电子云密度最小的氢原子
)中圈出电子云密度最小的氢原子②在尿素结晶过程中,反应3可视为处于平衡状态。实验表明,在合成尿素的体系中,
 的浓度越高,缩二脲生成速率越慢,其原因是
的浓度越高,缩二脲生成速率越慢,其原因是(4)含结晶水的
 晶体表面存在结构“
晶体表面存在结构“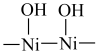 ”,用加热后的
”,用加热后的  晶体作催化剂,以
晶体作催化剂,以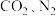 为原料,电解
为原料,电解 溶液可获得尿素。
溶液可获得尿素。
①生成尿素的电极方程式为
②加热后的
 晶体表面会产生
晶体表面会产生 位点,
位点, 位点与
位点与 位点共同形成
位点共同形成 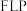 位点,其催化机理(部分)如图所示。实验表明,在
位点,其催化机理(部分)如图所示。实验表明,在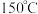 下加热
下加热  晶体得到的催化剂催化效果最好,温度过高或过低催化效果会降低的原因是
晶体得到的催化剂催化效果最好,温度过高或过低催化效果会降低的原因是③电解质溶液中若存在
 极大地降低催化剂的活性,原因是
极大地降低催化剂的活性,原因是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐1】将 转化为
转化为 、
、 等燃料,可以有效缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
等燃料,可以有效缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
 还原
还原 的热化学方程式如下:
的热化学方程式如下:
Ⅰ:
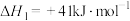
Ⅱ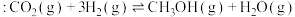
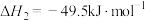
(1)已知反应Ⅰ、Ⅱ的平衡常数分别为 、
、 。由盖斯定律可知,
。由盖斯定律可知, 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为_______ ,其平衡常数
_______ (用 、
、 表示)。
表示)。
(2)若反应Ⅰ的正反应活化能表示为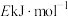 ,则
,则
_______ (填“>”、“<”或“=”)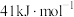 。
。
(3) 、初始压强为
、初始压强为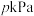 时,向
时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生反应Ⅰ,
,发生反应Ⅰ, 达到平衡时,测得
达到平衡时,测得 的物质的量为
的物质的量为 。
。
①平衡时 的体积分数
的体积分数
_______ (填分数),
_______ (用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
②下列措施既能加快反应速率又能提高 平衡转化率的是
平衡转化率的是_______ (填字母)。
A.升高反应温度 B.增大 的浓度
的浓度
C.分离出 D.缩小容器容积
D.缩小容器容积
③ 时,向
时,向 密闭容器中充入
密闭容器中充入 和一定量的
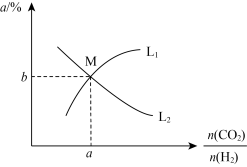
和一定量的 ,发生反应Ⅰ,两种气体的平衡转化率
,发生反应Ⅰ,两种气体的平衡转化率 与起始反应物的物质的量之比[
与起始反应物的物质的量之比[ ]的关系如图所示。能表示
]的关系如图所示。能表示 平衡转化率的曲线是
平衡转化率的曲线是_______ (填“ ”或“
”或“ ”),
”), 点的纵坐标
点的纵坐标
_______ (结果精确至 )。
)。
 转化为
转化为 、
、 等燃料,可以有效缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
等燃料,可以有效缓解能源危机,同时可以减少温室气体,实现“双碳目标”。 还原
还原 的热化学方程式如下:
的热化学方程式如下:Ⅰ:

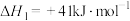
Ⅱ
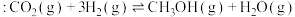
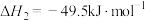
(1)已知反应Ⅰ、Ⅱ的平衡常数分别为
 、
、 。由盖斯定律可知,
。由盖斯定律可知, 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为
 、
、 表示)。
表示)。(2)若反应Ⅰ的正反应活化能表示为
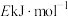 ,则
,则
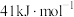 。
。(3)
 、初始压强为
、初始压强为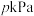 时,向
时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生反应Ⅰ,
,发生反应Ⅰ, 达到平衡时,测得
达到平衡时,测得 的物质的量为
的物质的量为 。
。①平衡时
 的体积分数
的体积分数

 物质的量分数)。
物质的量分数)。②下列措施既能加快反应速率又能提高
 平衡转化率的是
平衡转化率的是A.升高反应温度 B.增大
 的浓度
的浓度C.分离出
 D.缩小容器容积
D.缩小容器容积③
 时,向
时,向 密闭容器中充入
密闭容器中充入 和一定量的
和一定量的 ,发生反应Ⅰ,两种气体的平衡转化率
,发生反应Ⅰ,两种气体的平衡转化率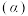 与起始反应物的物质的量之比[
与起始反应物的物质的量之比[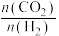 ]的关系如图所示。能表示
]的关系如图所示。能表示 平衡转化率的曲线是
平衡转化率的曲线是 ”或“
”或“ ”),
”), 点的纵坐标
点的纵坐标
 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐2】研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。下列说法能说明恒温恒容条件下的反应;2NO(g)+2CO(g)=N2(g)+ 2CO2(g)△H=-746.5 kJ·mol-1已达到化学平衡的是
2CO2(g)△H=-746.5 kJ·mol-1已达到化学平衡的是 ___________________ 。
A.单位时间内消耗了2molNO的同时消耗的2molCO
B.CO与CO2的物质的量浓度相等的状态
C.气体密度保持不变的状态
D.气体平均摩尔质量保持不变的状态
(2)NO2与SO2混合可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)。
SO3(g)+NO(g)。
将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示。由图(纵轴代表正反应速率)可知下列说法正确的是____________ (填字母)。

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
(3)CO在实际中有以下应用:用Li2CO3和Na2CO3熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气作为正极助燃气,制得在650℃下工作的燃料电池。完成有关的电极反应式。
负极反应式:2CO+2CO 一4e-=4CO2 正极反应式:
一4e-=4CO2 正极反应式:_______________________________ 。
(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:

请回答:①甲烷燃料电池的负极反应式是_________________________________________ 。
②当A中消耗0.15 mol氧气时,B中____ 极(填”a”或”b”)增重_____ g。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。下列说法能说明恒温恒容条件下的反应;2NO(g)+2CO(g)=N2(g)+
 2CO2(g)△H=-746.5 kJ·mol-1已达到化学平衡的是
2CO2(g)△H=-746.5 kJ·mol-1已达到化学平衡的是 A.单位时间内消耗了2molNO的同时消耗的2molCO
B.CO与CO2的物质的量浓度相等的状态
C.气体密度保持不变的状态
D.气体平均摩尔质量保持不变的状态
(2)NO2与SO2混合可发生反应:NO2(g)+SO2(g)
 SO3(g)+NO(g)。
SO3(g)+NO(g)。将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示。由图(纵轴代表正反应速率)可知下列说法正确的是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
(3)CO在实际中有以下应用:用Li2CO3和Na2CO3熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气作为正极助燃气,制得在650℃下工作的燃料电池。完成有关的电极反应式。
负极反应式:2CO+2CO
 一4e-=4CO2 正极反应式:
一4e-=4CO2 正极反应式:(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:

请回答:①甲烷燃料电池的负极反应式是
②当A中消耗0.15 mol氧气时,B中
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】 中氢含量高,是一种优良的小分子储氢载体,也是一种重要的化工原料。
中氢含量高,是一种优良的小分子储氢载体,也是一种重要的化工原料。
(1)已知:①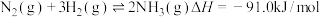
② 的燃烧热为
的燃烧热为
则 的燃烧热为
的燃烧热为
_________  。
。
(2) 热分解可制
热分解可制 :
: 。
。
①在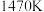 、
、 反应条件下,将
反应条件下,将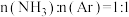 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为_________ ,平衡常数
_________  (保留3位有效数字)。
(保留3位有效数字)。
②在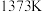 、
、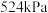 反应条件下,对于
反应条件下,对于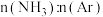 分别为4∶1、1∶1、1∶4的
分别为4∶1、1∶1、1∶4的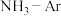 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如图所示。
转化率随时间的变化如图所示。
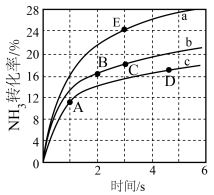
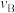 (逆)
(逆)_________ 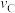 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。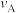
_________ 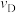 (填“>”、“<”或“=”)。曲线
(填“>”、“<”或“=”)。曲线 中,在0~3s之间,
中,在0~3s之间, 分压的平均变化率为
分压的平均变化率为_________  。
。
(3)合成氨是人工固氮最重要的途径。
①传统铁触媒催化会面临两难问题:高温可增大反应速率,但 的平衡产率较低。我国科研人员研制了Ti-H(Ⅱ)-Fe(Ⅰ)双温催化剂,通过光辐射产生温差,如体系温度为
的平衡产率较低。我国科研人员研制了Ti-H(Ⅱ)-Fe(Ⅰ)双温催化剂,通过光辐射产生温差,如体系温度为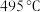 时,
时, (Ⅰ)的温度为
(Ⅰ)的温度为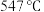 ,而Ti-H(Ⅱ)的温度为
,而Ti-H(Ⅱ)的温度为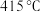 ,可解决该问题。
,可解决该问题。
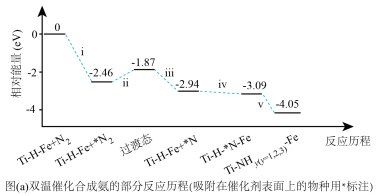
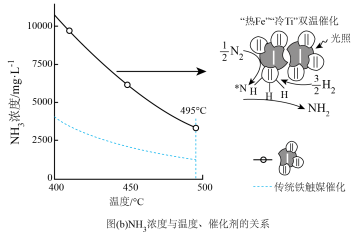
下列说法正确的是_________ (填序号)。
A.ⅰ为氮氮三键的断裂过程,ⅰ、ⅱ、ⅲ在高温区发生
B.ⅳ为 原子由Fe区域向Ti-H区域的传递过程
原子由Fe区域向Ti-H区域的传递过程
C.“热 ”高于体系温度,
”高于体系温度, 在表面断裂,有利于提高合成氨反应速率
在表面断裂,有利于提高合成氨反应速率
D.“冷Ti”低于体系温度,氨气在其表面生成,有利于提高氨的平衡产率
②以 和
和 为原料通过电化学方法也能实现合成氨,反应装置如图所示
为原料通过电化学方法也能实现合成氨,反应装置如图所示

阳极的电极反应为_________ 。同温同压下,相同时间内,若进口I的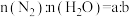 ,出口I处气体体积为进口I处的
,出口I处气体体积为进口I处的 倍,则
倍,则 的转化率为
的转化率为_________ (用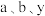 表示)。
表示)。
 中氢含量高,是一种优良的小分子储氢载体,也是一种重要的化工原料。
中氢含量高,是一种优良的小分子储氢载体,也是一种重要的化工原料。(1)已知:①
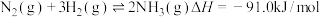
②
 的燃烧热为
的燃烧热为
则
 的燃烧热为
的燃烧热为
 。
。(2)
 热分解可制
热分解可制 :
: 。
。①在
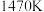 、
、 反应条件下,将
反应条件下,将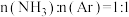 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为
 (保留3位有效数字)。
(保留3位有效数字)。②在
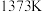 、
、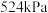 反应条件下,对于
反应条件下,对于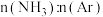 分别为4∶1、1∶1、1∶4的
分别为4∶1、1∶1、1∶4的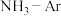 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如图所示。
转化率随时间的变化如图所示。
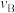 (逆)
(逆)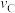 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。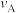
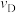 (填“>”、“<”或“=”)。曲线
(填“>”、“<”或“=”)。曲线 中,在0~3s之间,
中,在0~3s之间, 分压的平均变化率为
分压的平均变化率为 。
。(3)合成氨是人工固氮最重要的途径。
①传统铁触媒催化会面临两难问题:高温可增大反应速率,但
 的平衡产率较低。我国科研人员研制了Ti-H(Ⅱ)-Fe(Ⅰ)双温催化剂,通过光辐射产生温差,如体系温度为
的平衡产率较低。我国科研人员研制了Ti-H(Ⅱ)-Fe(Ⅰ)双温催化剂,通过光辐射产生温差,如体系温度为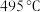 时,
时, (Ⅰ)的温度为
(Ⅰ)的温度为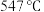 ,而Ti-H(Ⅱ)的温度为
,而Ti-H(Ⅱ)的温度为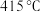 ,可解决该问题。
,可解决该问题。

下列说法正确的是
A.ⅰ为氮氮三键的断裂过程,ⅰ、ⅱ、ⅲ在高温区发生
B.ⅳ为
 原子由Fe区域向Ti-H区域的传递过程
原子由Fe区域向Ti-H区域的传递过程C.“热
 ”高于体系温度,
”高于体系温度, 在表面断裂,有利于提高合成氨反应速率
在表面断裂,有利于提高合成氨反应速率D.“冷Ti”低于体系温度,氨气在其表面生成,有利于提高氨的平衡产率
②以
 和
和 为原料通过电化学方法也能实现合成氨,反应装置如图所示
为原料通过电化学方法也能实现合成氨,反应装置如图所示
阳极的电极反应为
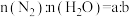 ,出口I处气体体积为进口I处的
,出口I处气体体积为进口I处的 倍,则
倍,则 的转化率为
的转化率为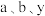 表示)。
表示)。
您最近一年使用:0次
【推荐1】我国科学家首次实现利用甲烷在温和条件下高选择性氧化制甲醇。
反应Ⅰ: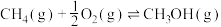

反应Ⅱ: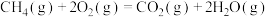
(1)已知:①
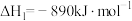
②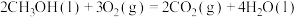
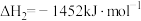
③
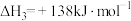
上述反应Ⅰ中的
___________  。
。
(2)在密闭容器中投入2mol 和1mol
和1mol ,起始投料量不变,在不同温度、压强下做平行实验,测得
,起始投料量不变,在不同温度、压强下做平行实验,测得 的平衡体积分数与温度、压强的关系如图所示:
的平衡体积分数与温度、压强的关系如图所示:

①由图可知,当 时,以反应
时,以反应___________ (填“Ⅰ”或“Ⅱ”)为主,理由是___________ ;
② 时,三条曲线几乎相连的原因可能是
时,三条曲线几乎相连的原因可能是___________ ;
③a、b、c由大到小排序为___________ 。
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a) 、
、 的体积比为2:1以及(b)
的体积比为2:1以及(b) 、
、 、
、 (
( 的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性=
的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性= ]如表所示:
]如表所示:
①投料b能显著提高甲醇选择性的原因是___________ 。
②向上述刚性密闭容器中按照体积比2:1:8充入 、
、 和
和 ,在450K下达到平衡状态时,
,在450K下达到平衡状态时, 的转化率为50%,
的转化率为50%, 的选择性为90%,则副反应的压强平衡常数
的选择性为90%,则副反应的压强平衡常数
___________ (计算结果保留1位小数)。
(4)我国科学家研发新型催化剂,利用电催化法实现甲烷转化成甲醇,装置如图所示:

交换膜M的名称是___________ ;阳极的电极反应式为___________ 。
反应Ⅰ:
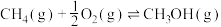

反应Ⅱ:
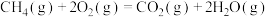
(1)已知:①

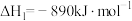
②
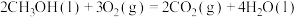
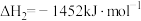
③

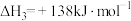
上述反应Ⅰ中的

 。
。(2)在密闭容器中投入2mol
 和1mol
和1mol ,起始投料量不变,在不同温度、压强下做平行实验,测得
,起始投料量不变,在不同温度、压强下做平行实验,测得 的平衡体积分数与温度、压强的关系如图所示:
的平衡体积分数与温度、压强的关系如图所示:
①由图可知,当
 时,以反应
时,以反应②
 时,三条曲线几乎相连的原因可能是
时,三条曲线几乎相连的原因可能是③a、b、c由大到小排序为
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a)
 、
、 的体积比为2:1以及(b)
的体积比为2:1以及(b) 、
、 、
、 (
( 的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性=
的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性= ]如表所示:
]如表所示:| 投料方式 | a | b |
 的选择性/% 的选择性/% | 90 | 15 |
 的选择性/% 的选择性/% | 10 | 85 |
①投料b能显著提高甲醇选择性的原因是
②向上述刚性密闭容器中按照体积比2:1:8充入
 、
、 和
和 ,在450K下达到平衡状态时,
,在450K下达到平衡状态时, 的转化率为50%,
的转化率为50%, 的选择性为90%,则副反应的压强平衡常数
的选择性为90%,则副反应的压强平衡常数
(4)我国科学家研发新型催化剂,利用电催化法实现甲烷转化成甲醇,装置如图所示:

交换膜M的名称是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐2】我国承诺 2030年前做到“碳达峰和碳中和”,这里的碳主要指CO2, CO2与我们生活和生产息息相关。请回答:
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g) CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1
II. CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
副反应:
III. CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
IV. 2CH3OH(g) CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
请回答:
①△H3=________ kJ·mol-1。
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x= ,则理论上x=
,则理论上x=_______ 时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是___________ 。
(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g) CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
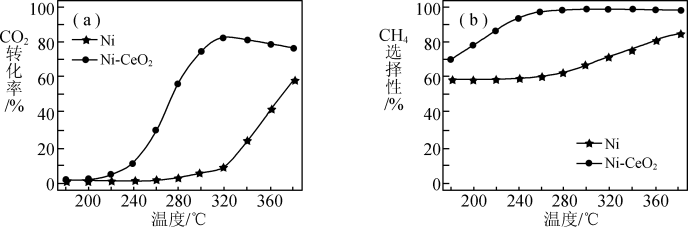
下列说法正确的是 。
(3)CO2可以与环氧丙烷反应合成碳酸丙烯酯:
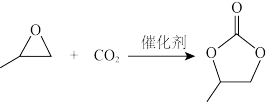 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1
通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):
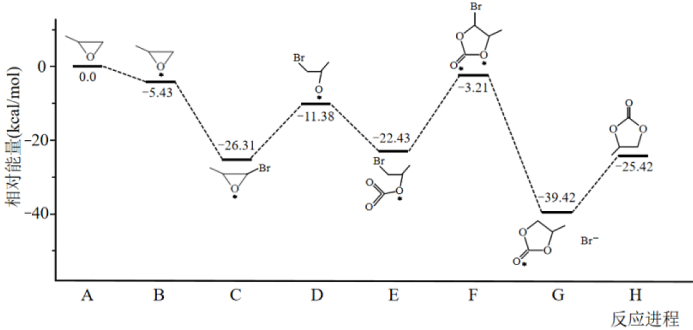
①决定总反应速率大小的步骤是______ (用图中字母表示), 该步骤的能垒(活化能)为_________ 。
②下列说法正确的是__________ 。
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
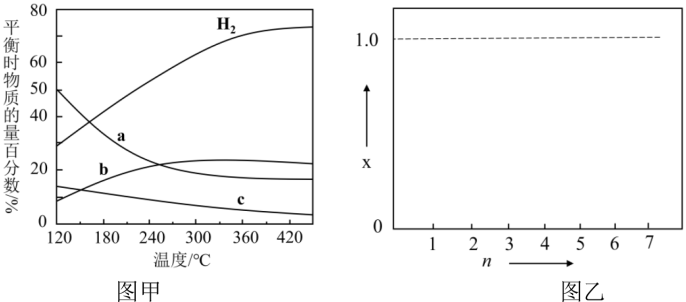
在120°C达到平衡时,CO2的转化率为________ ;若H2和CO2的物质的量之比为 n:1 (n≥3)进行投料,温度控制为120°C,相应平衡体系中CO2的转化率为x,在图乙中绘制x随n (n≥3 )变化的示意图________ (标出曲线的起点坐标)。
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g)
 CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1II. CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1副反应:
III. CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3IV. 2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1请回答:
①△H3=
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x=
 ,则理论上x=
,则理论上x=(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
下列说法正确的是 。
| A.高于320°C后,以Ni- CeO2为催化剂,CO2转化率略有下降的原因一定是CO2甲烷化反应已达平衡,升高温度平衡右移 |
| B.高于320°C后,以Ni为催化剂,CO2转化率上升的原因一定是CO2甲烷化反应速率较慢,升高温度反应速率加快,反应相同时间时CO2转化率增加 |
| C.工业上应选择的催化剂是Ni- CeO2 |
| D.工业上应使用的合适温度为360°C |
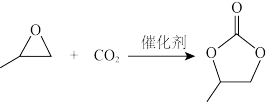 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):

①决定总反应速率大小的步骤是
②下列说法正确的是
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
在120°C达到平衡时,CO2的转化率为
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】甲酸是基本有机化工原料之一,广泛应用于农药、皮革、染料、医药和橡胶等工业。在较高温度或有催化剂存在下,它会分解成CO和 或
或 和
和 。
。
反应Ⅰ: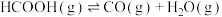

反应Ⅱ: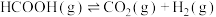
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的 =
=___________  。
。
(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。
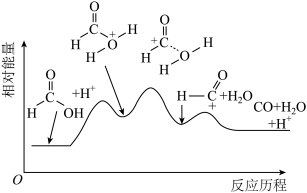
该反应的催化剂为___________ ,该反应历程中速率最慢步骤的化学方程式为___________ 。
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体, 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
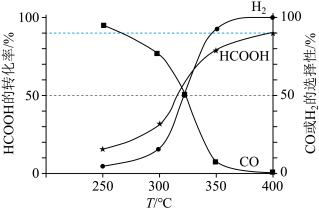
①400℃时,反应Ⅱ的平衡常数 =
=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×体积分数;结果保留小数点后1位)。
②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:___________ 。
(4)已知:25℃时, 的电离平衡常数
的电离平衡常数 ,
, ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。
①将100mL 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL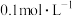 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:___________ 。
②25℃时,当溶液中 时,溶液中
时,溶液中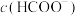 =
=___________  。
。
 或
或 和
和 。
。反应Ⅰ:
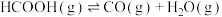

反应Ⅱ:
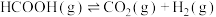
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的
 =
= 。
。(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。

该反应的催化剂为
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,
 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
①400℃时,反应Ⅱ的平衡常数
 =
=②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:
(4)已知:25℃时,
 的电离平衡常数
的电离平衡常数 ,
, ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。①将100mL
 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL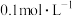 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:②25℃时,当溶液中
 时,溶液中
时,溶液中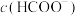 =
= 。
。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐1】工业合成氨对粮食增产、增加人口具重要价值。1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g)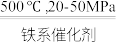 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:
已知:化学反应吉布斯自由能变化量ΔG=ΔH -TΔS (通常温度区间,ΔH和ΔS可视为常量),ΔG与压力平衡常数Kp的关系为:lgKp = 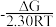 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
(1)298K时,合成氨反应______ (选填“能”或“不能”)自发进行,理由是___________ 。
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是______ 。
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g) 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是________ 。298K时,合成氨反应的压力平衡常数Kp(298K )=______ (保留2位有效数字);向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正_____ v逆(填“>”、“<”或“=”)。图中a点混合气体平均相对分子质量为18.75,a点对应温度(T4)下反应的平衡常数Kp=______ (保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数),由此知T4
物质的量分数),由此知T4______ 298K,(选填“>”、“<”或“=”)。

(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。
①铜氨溶液吸收CO的适宜生产条件是_________ 。
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是_________ 。
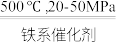 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:| ΔH(kJ·mol-1) | -92.2 |
| ΔS(J·K-1·mol-1) | -198.2 |
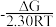 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。(1)298K时,合成氨反应
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g)
 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是 物质的量分数),由此知T4
物质的量分数),由此知T4
(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
| A.过程表明在化学反应中存在化学键的断裂与形成 |
| B.催化剂能改变化学反应的历程,使反应物化学键更易断裂,活化分子百分比增多 |
| C.过程①③④会放出能量,过程②需吸收能量 |
| D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3
 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。①铜氨溶液吸收CO的适宜生产条件是
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐2】汽车尾气中含有 CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
Ⅰ.已知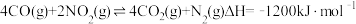
(1)该反应在___________ (填“高温、低温或任何温度”)下能自发进行。
(2)对于该反应,改变某一反应条件(温度 T1>T2),下列图象正确的是 ___________(填标号)。
(3)某实验小组模拟上述净化过程,一定温度下,在 2L 的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲___________ 乙(填“>、=、<或不确定”,下同)。
②甲中 CO 的转化率为 50%,该反应的平衡常数为___________ 。
Ⅱ.柴油汽车尾气中的碳烟(C)和 NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与 NO 的相关数据结果如图所示。
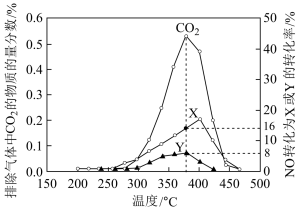
(4)375℃时,测得排出的气体中含 amol O2和 0.0525 mol CO2,已知 X 为 N2,Y 为 N2O,则 a=___________ 。
(5)实验过程中采用 NO 模拟 NOx,而不采用 NO2的原因是___________ 。
Ⅰ.已知
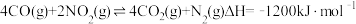
(1)该反应在
(2)对于该反应,改变某一反应条件(温度 T1>T2),下列图象正确的是 ___________(填标号)。
A. | B.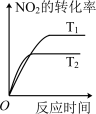 |
C.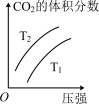 | D.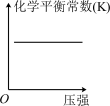 |
①N2的平衡体积分数:甲
②甲中 CO 的转化率为 50%,该反应的平衡常数为
Ⅱ.柴油汽车尾气中的碳烟(C)和 NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与 NO 的相关数据结果如图所示。

| 模拟尾气 | 气体(10mol) | 碳烟 | ||
| NO | O2 | He | ||
| 物质的量(mol) | 0.025 | 0.5 | 9.475 | 一定量 |
(5)实验过程中采用 NO 模拟 NOx,而不采用 NO2的原因是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】NOx、CO 都是常见的空气污染物,研究它们的处理方法对环境保护有重要的意义。
(1)用催化剂将NO和CO转化为N2和CO2是处理尾气的重要方式之一。在298K,101kPa时,相关反应如下:
I:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H1= -751 kJ·mol-1,△S=-197.5J·mol -1K-1
2CO2(g)+N2(g) △H1= -751 kJ·mol-1,△S=-197.5J·mol -1K-1
Ⅱ:4NO(g) N2O(g)+O2(g)
N2O(g)+O2(g)
Ⅲ:2CO(g)+O2(g) 2CO2(g)
2CO2(g)
请回答:
①反应I在298K时能否自发进行_______ (填“能”或者“否”)。
②目前汽车排气管内部装有三元催化器,尾气中反应物或生成物浓度随温度变化如图2、图3 所示。

请选择使用三元催化剂的最佳温度______________ ,并说明理由___________________________ 。
③为探究温度对催化剂催化效果的影响,将固定比例 NO、CO 混合气体,以一定流速通过三元催化剂排气管,相同时间内测量尾气中 NO 的含量,得到脱氮率随温度变化如图所示,已知图中 BC 段为平衡状态,且平衡脱氮率为 m-n×10 -4T2,100℃≤T≤1000℃,m、n 为常数。下列说法不正确的是_______ 。
A.平衡脱氮率 m-n×10 -4T2表达式中:m=0.69,n=2.5×10-3
B.CD 段处于平衡状态,因反应 I 正向放热,升温平衡逆向移动,故脱氮率降低
C.D 点平衡脱氮率为 44%
D.BA 段因温度下降,催化剂活性降低,故平衡脱氮率下降

(2)工业上也可用 CH4在催化剂作用下还原 NO 消除污染,其反应为CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H<0。相同时间测得 NO 的转化率随反应温度变化的情况如图所示。请在图中画出其他条件不变,增大压强(催化剂未失活)情况下,NO 的转化率随温度变化的图像
2N2(g)+CO2(g)+2H2O(g) △H<0。相同时间测得 NO 的转化率随反应温度变化的情况如图所示。请在图中画出其他条件不变,增大压强(催化剂未失活)情况下,NO 的转化率随温度变化的图像_______ 。
(3)一种焦炭催化 CO 还原 NO 反应的历程如下,请补充完整相关基元反应(“*”表示吸附态):
A.NO NO*
NO*
B.2NO* ON-NO*
ON-NO*
C.___________
D.ON-NO-CO* ON-N*+CO2
ON-N*+CO2
E.___________
(1)用催化剂将NO和CO转化为N2和CO2是处理尾气的重要方式之一。在298K,101kPa时,相关反应如下:
I:2NO(g)+2CO(g)
 2CO2(g)+N2(g) △H1= -751 kJ·mol-1,△S=-197.5J·mol -1K-1
2CO2(g)+N2(g) △H1= -751 kJ·mol-1,△S=-197.5J·mol -1K-1Ⅱ:4NO(g)
 N2O(g)+O2(g)
N2O(g)+O2(g) Ⅲ:2CO(g)+O2(g)
 2CO2(g)
2CO2(g) 请回答:
①反应I在298K时能否自发进行
②目前汽车排气管内部装有三元催化器,尾气中反应物或生成物浓度随温度变化如图2、图3 所示。

请选择使用三元催化剂的最佳温度
③为探究温度对催化剂催化效果的影响,将固定比例 NO、CO 混合气体,以一定流速通过三元催化剂排气管,相同时间内测量尾气中 NO 的含量,得到脱氮率随温度变化如图所示,已知图中 BC 段为平衡状态,且平衡脱氮率为 m-n×10 -4T2,100℃≤T≤1000℃,m、n 为常数。下列说法不正确的是
A.平衡脱氮率 m-n×10 -4T2表达式中:m=0.69,n=2.5×10-3
B.CD 段处于平衡状态,因反应 I 正向放热,升温平衡逆向移动,故脱氮率降低
C.D 点平衡脱氮率为 44%
D.BA 段因温度下降,催化剂活性降低,故平衡脱氮率下降

(2)工业上也可用 CH4在催化剂作用下还原 NO 消除污染,其反应为CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) △H<0。相同时间测得 NO 的转化率随反应温度变化的情况如图所示。请在图中画出其他条件不变,增大压强(催化剂未失活)情况下,NO 的转化率随温度变化的图像
2N2(g)+CO2(g)+2H2O(g) △H<0。相同时间测得 NO 的转化率随反应温度变化的情况如图所示。请在图中画出其他条件不变,增大压强(催化剂未失活)情况下,NO 的转化率随温度变化的图像
(3)一种焦炭催化 CO 还原 NO 反应的历程如下,请补充完整相关基元反应(“*”表示吸附态):
A.NO
 NO*
NO* B.2NO*
 ON-NO*
ON-NO* C.
D.ON-NO-CO*
 ON-N*+CO2
ON-N*+CO2E.
您最近一年使用:0次



