已知:
(1)浓度均为 的下列四种溶液,
的下列四种溶液, 由小到大排列的顺序是______
由小到大排列的顺序是______
(2)①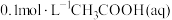 加水稀释过程中,下列数据变大的是
加水稀释过程中,下列数据变大的是___________ (选填编号)。
A. B.
B. C.
C. D.
D. E.
E.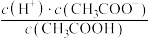
②将 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,稀释后
,稀释后 ;醋酸
;醋酸___________ 盐酸(选填编号,下同)。稀释后溶液中水的电离程度:醋酸___________ 盐酸。
A.> B.< C.=
③25℃时,将 与
与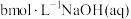 等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示
等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示 的电离平衡常数
的电离平衡常数 =
=___________ 。
④向 浓度均为
浓度均为 的
的 和
和 的混合液中加入等体积
的混合液中加入等体积 的
的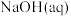 ,充分反应后混合溶液呈
,充分反应后混合溶液呈___________ (选填编号);
a.酸性 B.碱性 C.中性
混合液中离子浓度由大到小的顺序为___________ 。
(3)用 和
和 的强酸和强碱混合,使
的强酸和强碱混合,使 ,则酸、碱溶液的体积比为
,则酸、碱溶液的体积比为___________ 。
(4)①将少量 通入
通入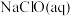 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
②将 通入
通入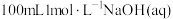 中,用溶液中微粒的浓度符号完成下列等式。
中,用溶液中微粒的浓度符号完成下列等式。
___________ 。
③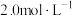 的氨水溶液中,
的氨水溶液中,
___________  。将
。将 通入该氨水中,当溶液中
通入该氨水中,当溶液中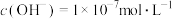 时,则溶液中
时,则溶液中
___________  (选填编号)。
(选填编号)。
A.> B.< C.=
 |  |  |  |  |
| 电离平衡常数 |  |   |  |  |
 的下列四种溶液,
的下列四种溶液, 由小到大排列的顺序是______
由小到大排列的顺序是______A. | B. | C. | D. |
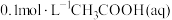 加水稀释过程中,下列数据变大的是
加水稀释过程中,下列数据变大的是A.
 B.
B. C.
C. D.
D. E.
E.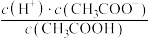
②将
 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,稀释后
,稀释后 ;醋酸
;醋酸A.> B.< C.=
③25℃时,将
 与
与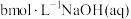 等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示
等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示 的电离平衡常数
的电离平衡常数 =
=④向
 浓度均为
浓度均为 的
的 和
和 的混合液中加入等体积
的混合液中加入等体积 的
的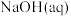 ,充分反应后混合溶液呈
,充分反应后混合溶液呈a.酸性 B.碱性 C.中性
混合液中离子浓度由大到小的顺序为
(3)用
 和
和 的强酸和强碱混合,使
的强酸和强碱混合,使 ,则酸、碱溶液的体积比为
,则酸、碱溶液的体积比为(4)①将少量
 通入
通入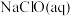 发生反应的离子方程式为
发生反应的离子方程式为②将
 通入
通入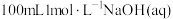 中,用溶液中微粒的浓度符号完成下列等式。
中,用溶液中微粒的浓度符号完成下列等式。
③
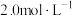 的氨水溶液中,
的氨水溶液中,
 。将
。将 通入该氨水中,当溶液中
通入该氨水中,当溶液中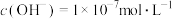 时,则溶液中
时,则溶液中
 (选填编号)。
(选填编号)。A.> B.< C.=
更新时间:2023-10-17 11:20:09
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】向某温度下两份体积均为10mL的纯水中分别滴加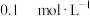 的
的 溶液和
溶液和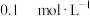 的
的 溶液,所加溶液的体积随
溶液,所加溶液的体积随 的变化如下图所示(溶液的体积能加和),请回答下列问题:
的变化如下图所示(溶液的体积能加和),请回答下列问题:

(1)e点溶液的 ,则此温度下,
,则此温度下,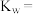
___________ 。
(2)a点溶液中由水电离的
___________  ,
, 的电离平衡常数
的电离平衡常数
___________ 。
(3)d点溶液的
___________ 。(已知 )
)
(4)a、b、c、d四点水的电离程度由大到小的顺序为___________ 。
(5)等体积的a点和d点的溶液混合后,溶液显___________ (填“酸”、“碱”或“中”)性,等体积的a点和c点的溶液混合后,溶液显___________ (填“酸”、“碱”或“中”)性。
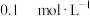 的
的 溶液和
溶液和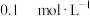 的
的 溶液,所加溶液的体积随
溶液,所加溶液的体积随 的变化如下图所示(溶液的体积能加和),请回答下列问题:
的变化如下图所示(溶液的体积能加和),请回答下列问题:
(1)e点溶液的
 ,则此温度下,
,则此温度下,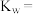
(2)a点溶液中由水电离的

 ,
, 的电离平衡常数
的电离平衡常数
(3)d点溶液的

 )
)(4)a、b、c、d四点水的电离程度由大到小的顺序为
(5)等体积的a点和d点的溶液混合后,溶液显
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka=__________ ;
(2)0.1mol·L-1的H2SO4中水电离出的c(H+)为_________ ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为____________ ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是____________ ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka=
(2)0.1mol·L-1的H2SO4中水电离出的c(H+)为
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5;H2CO3的电离常数Ka1=4.2×10-7、Ka2=5.6×10-11
(1)①用离子方程式解释碳酸氢钠水溶液显碱性的原因_____________________________ 。
②常温下,物质的量浓度相同的下列四种溶液:a.碳酸钠溶液 b.醋酸钠溶液 c.氢氧化钠溶液 d.氢氧化钡溶液,其pH由大到小的顺序是_______________________________ (填序号)。
(2)某温度下,将pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应溶液中水的电离程度由大到小的顺序为________________________ ;该醋酸溶液稀释过程中,下列各量一定变小的是_____________ 。

a.c(H+) b.c(OH-) c.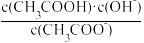 d.
d. 
(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,则在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液pH=________ 。
已知室温下:Ka(CH3COOH)=1.7×10-5;H2CO3的电离常数Ka1=4.2×10-7、Ka2=5.6×10-11
(1)①用离子方程式解释碳酸氢钠水溶液显碱性的原因
②常温下,物质的量浓度相同的下列四种溶液:a.碳酸钠溶液 b.醋酸钠溶液 c.氢氧化钠溶液 d.氢氧化钡溶液,其pH由大到小的顺序是
(2)某温度下,将pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应溶液中水的电离程度由大到小的顺序为

a.c(H+) b.c(OH-) c.
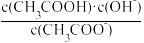 d.
d. 
(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,则在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液pH=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka___ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___ (填序号)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___ (填序号)。
a. b.
b.
c. d.
d.
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液c(H2CO3)___ c(CO32-)(填“>、<或=”),原因是___ 。
(5)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中:
① =
=___ (填“精确数值”,下同)。
②c(CH3COO-)-c(Na+)=___ mol/L。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka
(2)下列四种离子结合质子能力由大到小的顺序是
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是
a.
 b.
b.
c.
 d.
d.
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液c(H2CO3)
(5)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中:
①
 =
=②c(CH3COO-)-c(Na+)=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________________ 。
②体积相同、c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____________ ;
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是___________ ;此时c(HCN)/c(CN-)=______________ 。
(3)已知CaCO3的Ksp=2.8×l0-9,现将浓度为5.6×l0-4mol/LNa2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为__________ mol/L。
(1)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是
②体积相同、c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是
(3)已知CaCO3的Ksp=2.8×l0-9,现将浓度为5.6×l0-4mol/LNa2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】25℃时,电离平衡常数:
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:________________ ;(填编号)
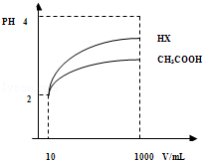
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数_____________ (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_________________ ,稀释后,HX溶液中水电离出来的c(H+)_______ 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________ ;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=____________________ .(填准确数值).
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数

(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】回答下列问题:
(1)某二元酸(分子式用 表示)在水中的电离方程式是:
表示)在水中的电离方程式是: ;
; 在0.1
在0.1 的
的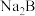 溶液中,下列粒子浓度关系式正确的是_______。
溶液中,下列粒子浓度关系式正确的是_______。
(2)亚磷酸( )是具有强还原性的二元弱酸,请写出其电离方程式:
)是具有强还原性的二元弱酸,请写出其电离方程式:_______ 。某温度下,0.10 的
的 溶液的pH为1.6,即
溶液的pH为1.6,即 ,则第一步电离平衡常数
,则第一步电离平衡常数
_______ ( 第二步电离忽略不计,列出计算式);向此
第二步电离忽略不计,列出计算式);向此 溶液中滴加NaOH溶液至中性,所得溶液中:
溶液中滴加NaOH溶液至中性,所得溶液中:
_______  (填“>”、“<”或“=”,下同);在
(填“>”、“<”或“=”,下同);在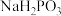 溶液中,
溶液中,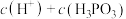
_______ 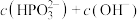 。
。
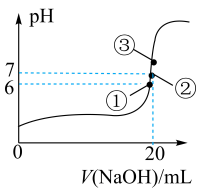
(3)25℃时,在20mL 0.1 氢氟酸中加入V mL 0.1
氢氟酸中加入V mL 0.1 NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是_______。
NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是_______。
(4)25℃时, 和
和 水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:
水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:

①以酚酞为指示剂(变色范围pH8.2∼10.0),将NaOH溶液逐滴加入到 溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______ ;
② 第二步电离的电离常数为
第二步电离的电离常数为 ,则
,则
_______ ( )。
)。
(1)某二元酸(分子式用
 表示)在水中的电离方程式是:
表示)在水中的电离方程式是: ;
; 在0.1
在0.1 的
的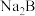 溶液中,下列粒子浓度关系式正确的是_______。
溶液中,下列粒子浓度关系式正确的是_______。A. | B.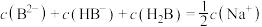 |
C. | D.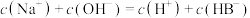 |
(2)亚磷酸(
 )是具有强还原性的二元弱酸,请写出其电离方程式:
)是具有强还原性的二元弱酸,请写出其电离方程式: 的
的 溶液的pH为1.6,即
溶液的pH为1.6,即 ,则第一步电离平衡常数
,则第一步电离平衡常数
 第二步电离忽略不计,列出计算式);向此
第二步电离忽略不计,列出计算式);向此 溶液中滴加NaOH溶液至中性,所得溶液中:
溶液中滴加NaOH溶液至中性,所得溶液中:
 (填“>”、“<”或“=”,下同);在
(填“>”、“<”或“=”,下同);在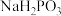 溶液中,
溶液中,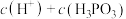
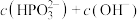 。
。(3)25℃时,在20mL 0.1
 氢氟酸中加入V mL 0.1
氢氟酸中加入V mL 0.1 NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是_______。
NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是_______。
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的 相等 相等 |
B.①点时pH=6,此时溶液中 |
C.②点时,溶液中的 |
D.③点时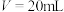 ,此时溶液中 ,此时溶液中 |
(4)25℃时,
 和
和 水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:
水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:
①以酚酞为指示剂(变色范围pH8.2∼10.0),将NaOH溶液逐滴加入到
 溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为②
 第二步电离的电离常数为
第二步电离的电离常数为 ,则
,则
 )。
)。
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】回答下列问题:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________ (填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)______ c(CH3COO-)(填“>”、“=”或“<”,下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________ 性,溶液中c(Na+)________ c(CH3COO-)
(3)常温下将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)________ 0.2 mol·L-1 HCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”,下同)
(4)常温下若将0.2 mol·L-1MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度________ MCl的水解程度。
(5)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH________ 。(填“>7”、“<7”或“无法确定”)
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈
(3)常温下将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)
(4)常温下若将0.2 mol·L-1MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度
(5)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,请回答下列问题。
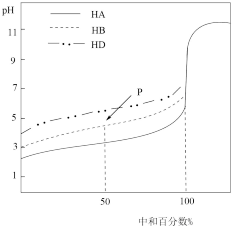
(1)请写出HA溶液与NaOH溶液反应的离子反应方程式____ 。
(2)滴定至P点时,溶液中各微粒(H2O分子除外)的浓度由大到小的关系是____ 。
(3)pH=7时,两溶液中c(B-)____ c(D-)(填“>”“=”或“<”,下同)。
(4)当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)+c(H+)____ c(OH-)。
(5)在常温下,测得NaD溶液的pH=10,则溶液中由水电离出来的c(OH-)____ mol/L。

(1)请写出HA溶液与NaOH溶液反应的离子反应方程式
(2)滴定至P点时,溶液中各微粒(H2O分子除外)的浓度由大到小的关系是
(3)pH=7时,两溶液中c(B-)
(4)当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)+c(H+)
(5)在常温下,测得NaD溶液的pH=10,则溶液中由水电离出来的c(OH-)
您最近一年使用:0次



