 是一种重要的化工产品,被公认为“万能中间体”。
是一种重要的化工产品,被公认为“万能中间体”。Ⅰ.甲醇脱氢法制
 是工业上的一种重要方法,具有工艺流程短、原料单一、反应条件温和等优点。其工艺过程涉及如下反应:
是工业上的一种重要方法,具有工艺流程短、原料单一、反应条件温和等优点。其工艺过程涉及如下反应:反应a:
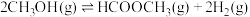

反应b:
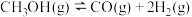
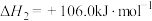
反应c:
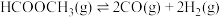
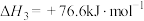
(1)

 。
。(2)一定条件下,在容积为10L的恒容密闭容器中通入

 气体发生上述反应,在不同温度下连续反应4h.测得甲醇的总转化率
气体发生上述反应,在不同温度下连续反应4h.测得甲醇的总转化率 和
和 的选择性
的选择性 随温度变化如图所示。(已知:
随温度变化如图所示。(已知: 的选择性
的选择性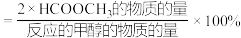 )
)
①553K时,体系中
 的物质的量为
的物质的量为 ,4h内反应速率
,4h内反应速率
 。
。②当温度高于553K时,
 的选择性迅速下降的原因不可能是
的选择性迅速下降的原因不可能是A.升高温度使催化剂活性降低
B.升高温度使反应a逆向移动
C.反应a平衡常数减小
D.温度升高反应b速率加快
E.温度升高反应c速率加快
Ⅱ.在一定条件下可利用甲醇羰基化法制甲酸甲酯,其反应原理可表示为:
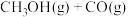
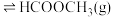
 。
。(3)向体积为2L的密闭容器中充入

 和
和
 ,测得容器内的压强p随时间t的变化关系如下图中ⅰ、ⅱ、ⅲ曲线所示:
,测得容器内的压强p随时间t的变化关系如下图中ⅰ、ⅱ、ⅲ曲线所示: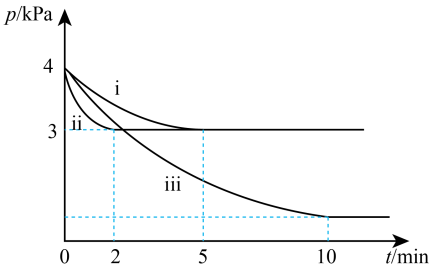
①ⅱ和ⅰ相比,改变的反应条件是
②反应ⅱ在2min时达到平衡,平衡常数
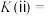
 。在体积和温度不变的条件下,在上述反应达到平衡ⅱ时,再往容器中加入
。在体积和温度不变的条件下,在上述反应达到平衡ⅱ时,再往容器中加入
 和
和
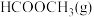 后,
后,
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③反应ⅰ的温度

 。
。
更新时间:2023-10-26 20:13:28
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】工业制氢气的一个重要反应是:CO(s)+ H2O(g) ="=" CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) = CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) = CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)= H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(s)+ H2O(g) = CO2(g) + H2(g)的反应热_______ kJ·mol-1
已知25℃时:C(石墨) +O2 (g) = CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) = CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)= H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(s)+ H2O(g) = CO2(g) + H2(g)的反应热
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态H2O2。当它们混合发生反应时,立即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态H2O2反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为___________ 。
(2)写出H2O2的电子式___________
(3)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态H2O2反应生成液态水时放出的热量是___________ kJ。
(4)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的好处是___________ 。
(5)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+66.4 kJ·mol-1①
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1②
肼和二氧化氮反应的热化学方程式为___________ 。
(1)该反应的热化学方程式为
(2)写出H2O2的电子式
(3)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态H2O2反应生成液态水时放出的热量是
(4)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的好处是
(5)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+66.4 kJ·mol-1①
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1②
肼和二氧化氮反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)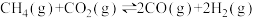

b)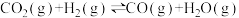

c)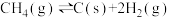

d)

e)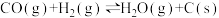

①根据盖斯定律,反应a的
___________ (写出一个代数式即可)。
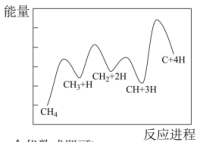
②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中,第___________ 步的反应最慢。
(2)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为: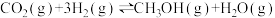 。在起始物
。在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为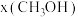 ,在
,在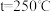 下的
下的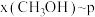 、在
、在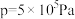 下的
下的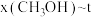 如图所示。
如图所示。
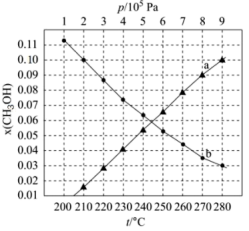
①用各物质的平衡分压[如 的分压可表示为
的分压可表示为 ]表示该反应平衡常数,表达式
]表示该反应平衡常数,表达式
___________ ;
②图中对应等温过程的曲线是___________ ,判断的理由是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率
___________ ,反应条件可能为___________ 或___________ 。
(1)CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)
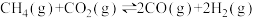

b)
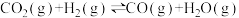

c)
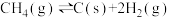

d)


e)
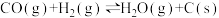

①根据盖斯定律,反应a的

②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

(2)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为:
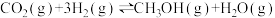 。在起始物
。在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为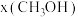 ,在
,在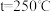 下的
下的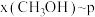 、在
、在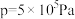 下的
下的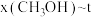 如图所示。
如图所示。
①用各物质的平衡分压[如
 的分压可表示为
的分压可表示为 ]表示该反应平衡常数,表达式
]表示该反应平衡常数,表达式
②图中对应等温过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】游离态的氮经一系列转化可以得到硝酸,如下图所示。
(1)NH3和O2在催化剂作用下反应,其化学方程式是______________ 。
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________ 。
(3)2NO(g)+O2(g) 2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
①2min内,v(O2)=________ mol/(L·min)
②800℃时,该反应的化学平衡常数为__________ 。
③判断该反应达到平衡的依据是(写出2条即可)____________ 。
④已知:ⅰ.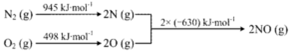
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________ ,温度对于NO生成NO2平衡转化率的影响是:___________________ 。
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________ 。

(1)NH3和O2在催化剂作用下反应,其化学方程式是
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为
(3)2NO(g)+O2(g)
 2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。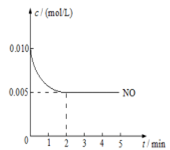
①2min内,v(O2)=
②800℃时,该反应的化学平衡常数为
③判断该反应达到平衡的依据是(写出2条即可)
④已知:ⅰ.

ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:
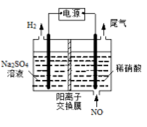
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】向一个固定体积的密闭容器充入2molA和1molB,发生如下反应:2A(g)+B(g) 3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
(1)用A表示2分钟内平均反应速率为___________ 。
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为___________ (填“吸热”或“放热”)反应。
(3)增大B的转化率,可采取的措施是___________ (用序号填空)
①加入A ②加入B ③加压 ④再加入1.6molA+0.8molB ⑤将C分离出容器
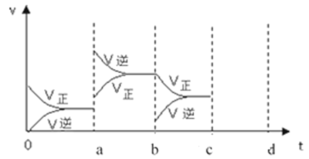
(4)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a点改变的条件可能是___________ ;若升高温度时,请将反应速率变化情况画在c-d处。___________
 3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。(1)用A表示2分钟内平均反应速率为
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为
(3)增大B的转化率,可采取的措施是
①加入A ②加入B ③加压 ④再加入1.6molA+0.8molB ⑤将C分离出容器
(4)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a点改变的条件可能是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入0.2
 ,发生反应:
,发生反应:
 ,甲中
,甲中 的相关量随时间变化如下图所示。
的相关量随时间变化如下图所示。

回答下列问题:
(1)0~3s内,甲容器中 的反应速率增大的原因是
的反应速率增大的原因是___________ 。
(2)甲容器中反应达平衡时,温度若为T℃,此温度下的平衡常数
___________ 。
(3)平衡时,平衡常数K(甲)___________ (填“>”“<”或“=”,下同)K(乙),压强p(甲)___________ p(乙)。

 ,发生反应:
,发生反应:
 ,甲中
,甲中 的相关量随时间变化如下图所示。
的相关量随时间变化如下图所示。
回答下列问题:
(1)0~3s内,甲容器中
 的反应速率增大的原因是
的反应速率增大的原因是(2)甲容器中反应达平衡时,温度若为T℃,此温度下的平衡常数

(3)平衡时,平衡常数K(甲)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g)  2NH3(g) △H<0。
2NH3(g) △H<0。
(1)在一定温度下,向一个2L的恒容密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的物质的量进行检测,得到的数据如下表所示:
①前10min的平均速率ν(H2)为______________________ 。
②一定条件下,上述反应达平衡状态后,将容器的容积压缩到原来的一半,其他条件不变,对平衡体系产生的影响是_______ (填字母序号).
a.c ( H2 )减少 b.正反应速率加快,逆反应速率减慢
c.NH3的物质的量增加 d.重新平衡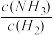 减小
减小
(2)下图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)_______ ,化学平衡常数最大的一段时间是________ 。
a. t0→t1 b.t2→t3 c.t3→t4 d.t5→t6

t4时改变的条件是_______________ 。
 2NH3(g) △H<0。
2NH3(g) △H<0。(1)在一定温度下,向一个2L的恒容密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的物质的量进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| n(NH3)/( mol ) | 0.16 | 0.28 | 0.36 | 0.40 | 0.40 | 0.40 |
①前10min的平均速率ν(H2)为
②一定条件下,上述反应达平衡状态后,将容器的容积压缩到原来的一半,其他条件不变,对平衡体系产生的影响是
a.c ( H2 )减少 b.正反应速率加快,逆反应速率减慢
c.NH3的物质的量增加 d.重新平衡
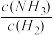 减小
减小(2)下图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)
a. t0→t1 b.t2→t3 c.t3→t4 d.t5→t6

t4时改变的条件是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】我国在应对气候变化工作中取得显著成效,承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将 转化为高附加值产品成为重要的研究课题。
转化为高附加值产品成为重要的研究课题。
Ⅰ.催化还原 制备甲醇
制备甲醇
该过程反应如下:
反应i:
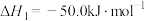
反应ii:

(1)反应的 的
的
_________  。
。
(2)恒温下, 与
与 在恒容密闭容器发生反应i、ii,下列能表明上述反应已达到平衡状态的有_________(填标号)。
在恒容密闭容器发生反应i、ii,下列能表明上述反应已达到平衡状态的有_________(填标号)。
(3)不同条件下,按照 投料,
投料, 的平衡转化率随温度和压强变化如图所示。
的平衡转化率随温度和压强变化如图所示。
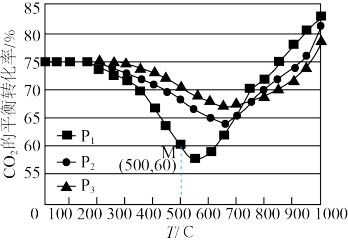
①压强 、
、 、
、 由大到小的顺序是
由大到小的顺序是_________ 。压强为 时,温度高于570℃之后,随着温度升高
时,温度高于570℃之后,随着温度升高 平衡转化率增大的原因是
平衡转化率增大的原因是__________________ 。
②请提出一条可提高 选择性(选择性:生成
选择性(选择性:生成 与消耗
与消耗 的物质的量比)的措施
的物质的量比)的措施_________ 。
③图中 点
点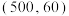 ,此时压强
,此时压强 为
为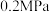 ,
, 的选择性为
的选择性为 。则该温度时反应i的平衡常数
。则该温度时反应i的平衡常数
_________ ( )(分压=总压×物质的量分数)。
)(分压=总压×物质的量分数)。
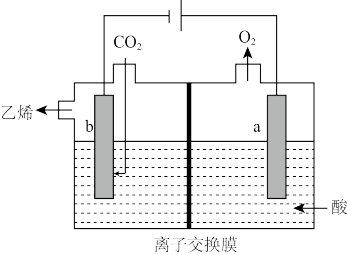
Ⅱ.电化学法还原 制乙烯
制乙烯
(4)其原理如图所示,阴极电极反应式为__________________ 。
 转化为高附加值产品成为重要的研究课题。
转化为高附加值产品成为重要的研究课题。Ⅰ.催化还原
 制备甲醇
制备甲醇该过程反应如下:
反应i:

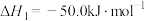
反应ii:


(1)反应的
 的
的
 。
。(2)恒温下,
 与
与 在恒容密闭容器发生反应i、ii,下列能表明上述反应已达到平衡状态的有_________(填标号)。
在恒容密闭容器发生反应i、ii,下列能表明上述反应已达到平衡状态的有_________(填标号)。A.每断裂 键,同时生成 键,同时生成 键 键 |
B.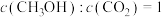 |
| C.混合气体的平均相对分子质量不变 |
| D.混合气体的压强不变 |
 投料,
投料, 的平衡转化率随温度和压强变化如图所示。
的平衡转化率随温度和压强变化如图所示。
①压强
 、
、 、
、 由大到小的顺序是
由大到小的顺序是 时,温度高于570℃之后,随着温度升高
时,温度高于570℃之后,随着温度升高 平衡转化率增大的原因是
平衡转化率增大的原因是②请提出一条可提高
 选择性(选择性:生成
选择性(选择性:生成 与消耗
与消耗 的物质的量比)的措施
的物质的量比)的措施③图中
 点
点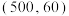 ,此时压强
,此时压强 为
为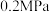 ,
, 的选择性为
的选择性为 。则该温度时反应i的平衡常数
。则该温度时反应i的平衡常数
 )(分压=总压×物质的量分数)。
)(分压=总压×物质的量分数)。Ⅱ.电化学法还原
 制乙烯
制乙烯(4)其原理如图所示,阴极电极反应式为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】乙酸是基本的有机化工原料,乙酸制氢具有重要意义,制氢过程发生如下反应:
热裂解反应I:CH3COOH(g)⇌2CO(g)+2H2(g) ΔH1
脱羧基反应Ⅱ:CH3COOH(g)⇌CO2(g)+CH4(g) ΔH2
在恒容密闭容器中,加入一定量乙酸蒸气制氢,在相同时间测得温度与气体产率的关系如图:
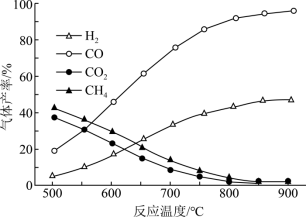
(1)约650℃之前,氢气产率低于甲烷的原因是_______ 。
(2)分析图像知该容器中还发生了其他的副反应,理由是_______ 。
(3)若保持其他条件不变,在乙酸蒸气中掺杂一定量水,氢气的产率显著提高,而CO的产率下降,请用化学方程式表示可能发生的反应:_______ 。
热裂解反应I:CH3COOH(g)⇌2CO(g)+2H2(g) ΔH1
脱羧基反应Ⅱ:CH3COOH(g)⇌CO2(g)+CH4(g) ΔH2
在恒容密闭容器中,加入一定量乙酸蒸气制氢,在相同时间测得温度与气体产率的关系如图:

(1)约650℃之前,氢气产率低于甲烷的原因是
(2)分析图像知该容器中还发生了其他的副反应,理由是
(3)若保持其他条件不变,在乙酸蒸气中掺杂一定量水,氢气的产率显著提高,而CO的产率下降,请用化学方程式表示可能发生的反应:
您最近一年使用:0次



