我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。因此将 转化为高附加值化学品成为科学家研究的重要课题。
转化为高附加值化学品成为科学家研究的重要课题。 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应Ⅰ:
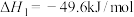
反应Ⅱ: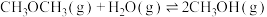

反应Ⅲ:

请回答下列问题:
(1)
___________  。
。
(2)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是___________。
(3)反应 在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的
在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的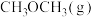 和
和 ,反应到某时刻时测得各组分浓度如下,'此时
,反应到某时刻时测得各组分浓度如下,'此时
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)反应Ⅲ能够自发进行的条件是___________ (填“较低温度”“较高温度”或“任何温度”)。
(5)在恒定压强、 温度下,将6mol
温度下,将6mol 和12mol
和12mol 充入2L的密闭容器中发生Ⅰ、Ⅲ反应,5min后反应达到平衡状态,此时
充入2L的密闭容器中发生Ⅰ、Ⅲ反应,5min后反应达到平衡状态,此时 物质的量为2mol
物质的量为2mol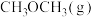 的物质的量为0.5mol;则
的物质的量为0.5mol;则 温度时反应Ⅰ的平衡常数Kc的计算式为
温度时反应Ⅰ的平衡常数Kc的计算式为________ 。
(6)恒压下将 和
和 按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内
按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内 的选择性和产率随温度的变化如下图。其中:
的选择性和产率随温度的变化如下图。其中: 的选择性
的选择性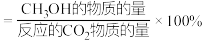
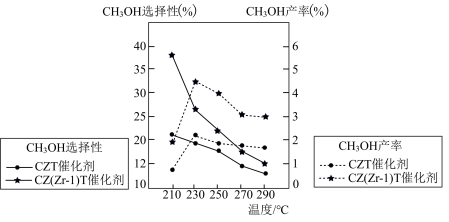
①在上述条件下合成甲醇的工业条件是________ 。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr―1)T
②温度高于230℃, 平衡转化率随温度升高而下降可能的原因是
平衡转化率随温度升高而下降可能的原因是________ 。
 转化为高附加值化学品成为科学家研究的重要课题。
转化为高附加值化学品成为科学家研究的重要课题。 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:反应Ⅰ:

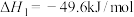
反应Ⅱ:
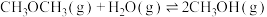

反应Ⅲ:


请回答下列问题:
(1)

 。
。(2)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是___________。
| A.混合气体的密度不再变化 | B.混合气体的平均相对分子质量不再变化 |
C.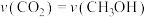 | D.容器的压强不再变化 |
(3)反应
 在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的
在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的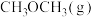 和
和 ,反应到某时刻时测得各组分浓度如下,'此时
,反应到某时刻时测得各组分浓度如下,'此时
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)| 物质 | 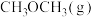 |  |  |
浓度 | 1.8 | 1.8 | 0.4 |
(4)反应Ⅲ能够自发进行的条件是
(5)在恒定压强、
 温度下,将6mol
温度下,将6mol 和12mol
和12mol 充入2L的密闭容器中发生Ⅰ、Ⅲ反应,5min后反应达到平衡状态,此时
充入2L的密闭容器中发生Ⅰ、Ⅲ反应,5min后反应达到平衡状态,此时 物质的量为2mol
物质的量为2mol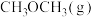 的物质的量为0.5mol;则
的物质的量为0.5mol;则 温度时反应Ⅰ的平衡常数Kc的计算式为
温度时反应Ⅰ的平衡常数Kc的计算式为(6)恒压下将
 和
和 按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内
按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内 的选择性和产率随温度的变化如下图。其中:
的选择性和产率随温度的变化如下图。其中: 的选择性
的选择性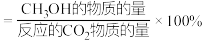

①在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr―1)T
②温度高于230℃,
 平衡转化率随温度升高而下降可能的原因是
平衡转化率随温度升高而下降可能的原因是
23-24高三上·辽宁沈阳·期中 查看更多[3]
更新时间:2023-11-30 10:42:49
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H3=________ kJ/mol(用含a、b的代数式表示)。
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g) CO(g)+H2O(g)。
CO(g)+H2O(g)。
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0~15 min内平均反应速率v(H2)=______ ,此条件下该反应的平衡常数K=______ 。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是:y______ z(填“>”、“<”或“=”),且y=______ (用含x、w的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g) C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:
C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:

则△H_____ 0(填“>”、“<”或“=”),压强p1、p2、p3从大到小的顺序是________ 。
(3)CO可被NO2氧化:CO+NO2 CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________ 。
Ⅰ.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H3=
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)
 CO(g)+H2O(g)。
CO(g)+H2O(g)。| 容器 | 反应物 |
| 甲 | 8 mol CO2(g)、16 mol H2(g) |
| 乙 | w mol CO2(g)、x mol H2(g)、y mol CO(g)、z mol H2O(g) |
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0~15 min内平均反应速率v(H2)=
欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是:y
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)
 C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:
C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:
则△H
(3)CO可被NO2氧化:CO+NO2
 CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。回答下列问题:
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,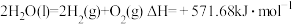 ,
,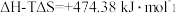 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是_______ 。
(2)已知反应: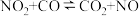
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为_______ (用含K的式子表示)。
②下图是该反应中能量变化示意图。
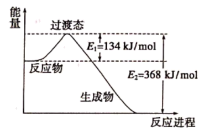
则 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为_______ , 和
和 反应的热化学方程式为
反应的热化学方程式为_______ 。
(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①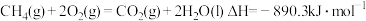
②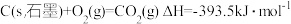
③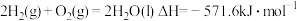
则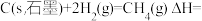
_______ 。
(4)已知一些化学键的键能数据如表所示:
请根据键能数据写出 和
和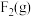 反应生成
反应生成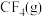 和
和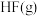 的热化学方程式:
的热化学方程式:_______ 。
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,
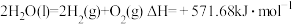 ,
,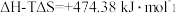 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是(2)已知反应:
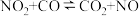
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为
②下图是该反应中能量变化示意图。

则
 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为 和
和 反应的热化学方程式为
反应的热化学方程式为(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①
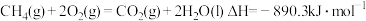
②
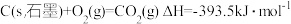
③
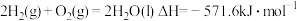
则
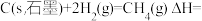
(4)已知一些化学键的键能数据如表所示:
| 化学键 |  |  |  |  |
键能/ | 414 | 489 | 565 | 155 |
请根据键能数据写出
 和
和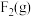 反应生成
反应生成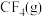 和
和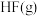 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s) + 3O2(g)=2Fe2O3(s) ∆H=-1648kJ·mol-1;
②C(s) +O2(g)=CO2(g) ∆H=- 393 kJ·mol-1;
③2Fe(s) +2C(s) +3O2(g)=2FeCO3(s) ∆H=-1480kJ·mol-1;
则4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ∆H=______ 。
(2)已知在某种含铁催化剂作用下发生下列反应:CO(g) +3H2(g)⇌CH4(g)+ H2O(g) △H<0。一定温度下和压强条件下,把1molCO和3molH2加入到压强为5p0的恒压密闭容器中,测得不同时间CO的体积分数φ(CO)如下表:
①能判断该反应是否已达到平衡状态的依据是______ (填字母)。
A.混合气体的密度不再发生变化 B.3v正(CO)=v正(H2)
C.反应1molCO的同时生成1molCH4 D. CH4的体积分数不再改变
②达到平衡时H2的转化率为______ ;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=______ (已知:气体分压=气体总压×体积分数)。
③若下图表示该反应中H2的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由低到高的顺序是______ 。

(3)甲醇在催化剂条件下可以直接被氧化成甲酸。常温下,甲酸的电离常数K=1.0×10-4,20.00mL0.1000mol·L-1NaOH溶液与等体积一定浓度的甲酸溶液混合,所得溶液中c(HCOOH)=c(HCOO-),则此时溶液的pH=______ ,溶液中离子浓度由小到大的顺序为______ 。
(1)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s) + 3O2(g)=2Fe2O3(s) ∆H=-1648kJ·mol-1;
②C(s) +O2(g)=CO2(g) ∆H=- 393 kJ·mol-1;
③2Fe(s) +2C(s) +3O2(g)=2FeCO3(s) ∆H=-1480kJ·mol-1;
则4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ∆H=
(2)已知在某种含铁催化剂作用下发生下列反应:CO(g) +3H2(g)⇌CH4(g)+ H2O(g) △H<0。一定温度下和压强条件下,把1molCO和3molH2加入到压强为5p0的恒压密闭容器中,测得不同时间CO的体积分数φ(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| φ(CO) | 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①能判断该反应是否已达到平衡状态的依据是
A.混合气体的密度不再发生变化 B.3v正(CO)=v正(H2)
C.反应1molCO的同时生成1molCH4 D. CH4的体积分数不再改变
②达到平衡时H2的转化率为
③若下图表示该反应中H2的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由低到高的顺序是

(3)甲醇在催化剂条件下可以直接被氧化成甲酸。常温下,甲酸的电离常数K=1.0×10-4,20.00mL0.1000mol·L-1NaOH溶液与等体积一定浓度的甲酸溶液混合,所得溶液中c(HCOOH)=c(HCOO-),则此时溶液的pH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如下图所示。已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41 kJ·mol−1
CO2(g)+H2(g) ΔH1= -41 kJ·mol−1
CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
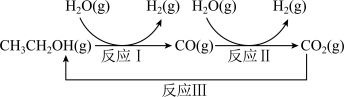
反应 Ⅰ 的热化学方程式为_________ 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1 mol CO2和3mol H2,在500℃下发生发应, 实验测得CO2和
实验测得CO2和 的物质的量(n)随时间变化如图1所示:
的物质的量(n)随时间变化如图1所示:
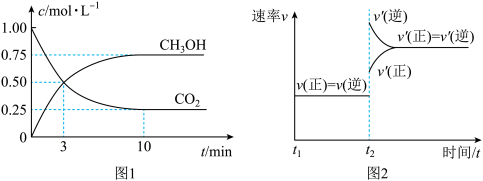
①500℃达平衡时, 物质的量分数为
物质的量分数为____________ 。图2是改变温度时速率随时间变化的示意图,则该反应的正反应为____________ 反应(填“放热”或“吸热”)。
②500℃该反应的平衡常数为____________ ,若提高温度800℃进行,达平衡时,K值____________ (填“增大”“减小”或“不变”)。
③500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g) 和H2O(g) 的浓度均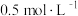 此时v(正)
此时v(正)_____________ v(逆)(填“>”“<”或“=”)
④下列措施能使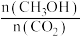 增大的是
增大的是____________ 。
A.升高温度 B.在原容器中充入
C.原容器中充入1 mol CO2和3 mol H2 D.缩小容器容积,增大压强
(1)如下图所示。已知:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH1= -41 kJ·mol−1
CO2(g)+H2(g) ΔH1= -41 kJ·mol−1CH3CH2OH(g)+3H2O(g)
 2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
反应 Ⅰ 的热化学方程式为
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1 mol CO2和3mol H2,在500℃下发生发应,
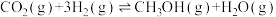 实验测得CO2和
实验测得CO2和 的物质的量(n)随时间变化如图1所示:
的物质的量(n)随时间变化如图1所示:
①500℃达平衡时,
 物质的量分数为
物质的量分数为②500℃该反应的平衡常数为
③500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g) 和H2O(g) 的浓度均
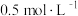 此时v(正)
此时v(正)④下列措施能使
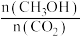 增大的是
增大的是A.升高温度 B.在原容器中充入

C.原容器中充入1 mol CO2和3 mol H2 D.缩小容器容积,增大压强
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应
A(s)+2B(g) D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
(1)T 1 ℃时,该反应的平衡常数K=________ 。
(2)30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________ (填字母编号)。
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
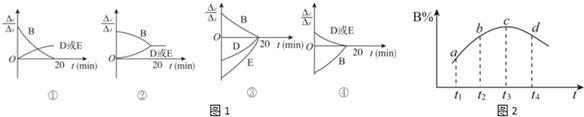
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的________ (填序号)。
(4)维持容器的体积和温度T1 ℃不变,若向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,则投入固体A的物质的量n的取值范围是________ 。
(5)维持容器的体积和温度T1 ℃不变,各物质的起始物质的量为:n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,n(E)=0 mol,达到平衡后,n(E)=0.50 mol,则a=________ 。
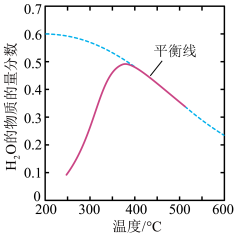
(6)若该密闭容器绝热,实验测得B的转化率B% 随温度变化的示意图如图2所示。由图可知,Q_______ 0(填“大于”或“小于”),c点v正_______ v逆(填“大于”、“小于”或“等于”)。
A(s)+2B(g)
 D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T 1 ℃时,该反应的平衡常数K=
(2)30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的

(4)维持容器的体积和温度T1 ℃不变,若向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,则投入固体A的物质的量n的取值范围是
(5)维持容器的体积和温度T1 ℃不变,各物质的起始物质的量为:n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,n(E)=0 mol,达到平衡后,n(E)=0.50 mol,则a=
(6)若该密闭容器绝热,实验测得B的转化率B% 随温度变化的示意图如图2所示。由图可知,Q
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】汽车尾气是造成天气雾霾的重要原因。已知:
①N2(g)+O2(g) 2NO(g) ΔH1 ②CO2(g)
2NO(g) ΔH1 ②CO2(g)  CO(g)+
CO(g)+ O2(g) ΔH2 ③2CO(g)+2NO(g)
O2(g) ΔH2 ③2CO(g)+2NO(g)  N2(g)+2CO2(g) ΔH3。请完成以下问题:
N2(g)+2CO2(g) ΔH3。请完成以下问题:
(1)请根据反应①②,确定反应③中ΔH3=________ 。(用含ΔH1 、ΔH2的代数式表示)
(2)根据图1,反应③的热化学方程式为:_________________________ 。
(3)图2表示反应③的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。

则W、Y、Z三点的平衡常数的大小关系为:____________________ , X、Y、Z三点,CO的转化率由大到小的顺序是_______________________ 。
(4)恒温恒容时,反应④中NO、CO按一定比例投料,反应过程中CO浓度随时间的变化关系如图3所示,请在同一图中绘出N2浓度随时间的变化曲线_________ 。

①N2(g)+O2(g)
 2NO(g) ΔH1 ②CO2(g)
2NO(g) ΔH1 ②CO2(g)  CO(g)+
CO(g)+ O2(g) ΔH2 ③2CO(g)+2NO(g)
O2(g) ΔH2 ③2CO(g)+2NO(g)  N2(g)+2CO2(g) ΔH3。请完成以下问题:
N2(g)+2CO2(g) ΔH3。请完成以下问题:(1)请根据反应①②,确定反应③中ΔH3=
(2)根据图1,反应③的热化学方程式为:
(3)图2表示反应③的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。

则W、Y、Z三点的平衡常数的大小关系为:
(4)恒温恒容时,反应④中NO、CO按一定比例投料,反应过程中CO浓度随时间的变化关系如图3所示,请在同一图中绘出N2浓度随时间的变化曲线

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】节能减排CO2建设友好型社会的必然选择。
(1)CO2可与H2生成CH4:CO2(g)+4H2(g) CH4(g)+2H2O(g)。将原料气按n(CO2):n(H2)=1mol:4mol置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度降低而
CH4(g)+2H2O(g)。将原料气按n(CO2):n(H2)=1mol:4mol置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度降低而___ (填“增大”或“减小”)。恒温条件下,反应经过5min达到平衡,此时压强为初始的0.8倍,用H2表示该阶段化学反应速率为___ 。
(2)在恒温(T>100℃)恒容装置中进行该反应,达到平衡状态的是___ 。
a.混合气体密度不再改变
b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变
d.n(CO2):n(H2)=1:2
(3)原料气CO2可与H2通过如下反应制备:
①C(s)+CO2(g) 2CO(g)+akJ②CO(g)+H2O(g)
2CO(g)+akJ②CO(g)+H2O(g) H2(g)+CO2(g)+bkJ
H2(g)+CO2(g)+bkJ
某反应的平衡常数表达式K=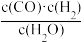 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___ 。
(4)CO2还可与H2生成CH3OH,CO2(g)+3H2(g) CH3OH(g)+H2O(g)+Q1。下列措施有利于提高合成CH3OH反应中CO2的平衡转化率的是
CH3OH(g)+H2O(g)+Q1。下列措施有利于提高合成CH3OH反应中CO2的平衡转化率的是___ 。
a.使用催化剂 b.加压 c.增大初始投料比
某温度下该反应的K=450,向该温度下2L的容器内分别投入0.2molH2、0.6molCO2、0.4molCH3OH和0.4molH2O,则反应向___ 方向进行(填“正”或“逆”)。
(4)上述反应存在副反应H2(g)+CO2(g) CO(g)+H2O(g)+Q2,控制压强一定,CO2和H2初始比一定,经过相同时间测得如下数据(反应未达平衡):
CO(g)+H2O(g)+Q2,控制压强一定,CO2和H2初始比一定,经过相同时间测得如下数据(反应未达平衡):
甲醇选择性:转化的CO2中生成甲醇的百分比。
数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,可能的原因是:___ 。
(1)CO2可与H2生成CH4:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。将原料气按n(CO2):n(H2)=1mol:4mol置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度降低而
CH4(g)+2H2O(g)。将原料气按n(CO2):n(H2)=1mol:4mol置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度降低而
(2)在恒温(T>100℃)恒容装置中进行该反应,达到平衡状态的是
a.混合气体密度不再改变
b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变
d.n(CO2):n(H2)=1:2
(3)原料气CO2可与H2通过如下反应制备:
①C(s)+CO2(g)
 2CO(g)+akJ②CO(g)+H2O(g)
2CO(g)+akJ②CO(g)+H2O(g) H2(g)+CO2(g)+bkJ
H2(g)+CO2(g)+bkJ某反应的平衡常数表达式K=
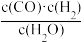 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)CO2还可与H2生成CH3OH,CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)+Q1。下列措施有利于提高合成CH3OH反应中CO2的平衡转化率的是
CH3OH(g)+H2O(g)+Q1。下列措施有利于提高合成CH3OH反应中CO2的平衡转化率的是a.使用催化剂 b.加压 c.增大初始投料比

某温度下该反应的K=450,向该温度下2L的容器内分别投入0.2molH2、0.6molCO2、0.4molCH3OH和0.4molH2O,则反应向
(4)上述反应存在副反应H2(g)+CO2(g)
 CO(g)+H2O(g)+Q2,控制压强一定,CO2和H2初始比一定,经过相同时间测得如下数据(反应未达平衡):
CO(g)+H2O(g)+Q2,控制压强一定,CO2和H2初始比一定,经过相同时间测得如下数据(反应未达平衡):| T(K) | CO2的实际转化率(%) | 甲醇的选择性(%) |
| 543 | 12.3 | 42.3 |
| 533 | 15.3 | 39.1 |
数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,可能的原因是:
您最近一年使用:0次
【推荐2】我国2060年将实现“碳中和”目标,将工业产生的 转化为有机物是重要的途径。回答下列问题:
转化为有机物是重要的途径。回答下列问题:
(1)2021年,我国科学家实现将 转化为淀粉,实现“惊天大逆转”。该转化的第一步是利用光伏等可再生电源分解水提供氢气,在化学反应器中进行二氧化碳高效还原,反应如下:
转化为淀粉,实现“惊天大逆转”。该转化的第一步是利用光伏等可再生电源分解水提供氢气,在化学反应器中进行二氧化碳高效还原,反应如下: ,相关数据如下表:
,相关数据如下表:
则该反应的
_______ 。
(2)将 和
和 充入密闭容器中,发生反应
充入密闭容器中,发生反应 。下列措施,能提高
。下列措施,能提高 的反应速率的是_______(填序号)。
的反应速率的是_______(填序号)。
(3)反应达平衡时,平衡体系中 的转化率与反应温度和压强的关系如图所示,则
的转化率与反应温度和压强的关系如图所示,则
_______  ,
,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 、
、 时,列式表示该反应的压强平衡常数为
时,列式表示该反应的压强平衡常数为_______ (压强平衡常数是以气体分压强来表示反应的平衡常数)。

(4)利用 和甲醇可以继续反应生成二甲酯(DMC),催化机理如图1所示,其中反应
和甲醇可以继续反应生成二甲酯(DMC),催化机理如图1所示,其中反应_______ (填“ⅰ”“ⅱ”或“ⅲ”)中发生 键的断裂。二甲酯(DMC)中C原子的杂化方式是
键的断裂。二甲酯(DMC)中C原子的杂化方式是_______ 。每生成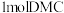 ,需要
,需要
_______ mol。干冰的晶体结构如图2所示,则晶胞中与一个 分子等距最近的
分子等距最近的 分子有
分子有_______ 个。已知晶胞边长为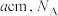 表示阿伏加德罗常数的值,则干冰的密度为
表示阿伏加德罗常数的值,则干冰的密度为_______  。
。

 转化为有机物是重要的途径。回答下列问题:
转化为有机物是重要的途径。回答下列问题:(1)2021年,我国科学家实现将
 转化为淀粉,实现“惊天大逆转”。该转化的第一步是利用光伏等可再生电源分解水提供氢气,在化学反应器中进行二氧化碳高效还原,反应如下:
转化为淀粉,实现“惊天大逆转”。该转化的第一步是利用光伏等可再生电源分解水提供氢气,在化学反应器中进行二氧化碳高效还原,反应如下: ,相关数据如下表:
,相关数据如下表:| 化学键 |  |  |  |  |  |
| 键能 | 803 | 436 | 414 | 326 | 464 |

(2)将
 和
和 充入密闭容器中,发生反应
充入密闭容器中,发生反应 。下列措施,能提高
。下列措施,能提高 的反应速率的是_______(填序号)。
的反应速率的是_______(填序号)。| A.降低反应温度 | B.提高 的浓度 的浓度 |
| C.增加反应的压强 | D.降低 的浓度 的浓度 |
 的转化率与反应温度和压强的关系如图所示,则
的转化率与反应温度和压强的关系如图所示,则
 ,
,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 、
、 时,列式表示该反应的压强平衡常数为
时,列式表示该反应的压强平衡常数为
(4)利用
 和甲醇可以继续反应生成二甲酯(DMC),催化机理如图1所示,其中反应
和甲醇可以继续反应生成二甲酯(DMC),催化机理如图1所示,其中反应 键的断裂。二甲酯(DMC)中C原子的杂化方式是
键的断裂。二甲酯(DMC)中C原子的杂化方式是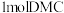 ,需要
,需要
 分子等距最近的
分子等距最近的 分子有
分子有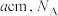 表示阿伏加德罗常数的值,则干冰的密度为
表示阿伏加德罗常数的值,则干冰的密度为 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g)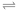 4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是
4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________ (填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)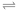 N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
①根据图表数据分析T1℃时,该反应在0~20 min的平均反应速率v(CO2)=________ ;计算该反应的平衡常数K=______ 。
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)__________________ 。
③30 min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,此时NO的转化率_______ (填“升高”或“降低”),ΔH_____ 0(填“>”或“<”)。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ· mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5 kJ· mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ· mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____________________ 。
(4)科学家利用原电池原理,在酸性介质中将NO2转化为HNO3,则该转化的负极反应式为:_________________________________ 。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g)
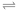 4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是
4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)
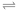 N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:| 时间/min 浓度/( mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)
③30 min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,此时NO的转化率
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ· mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5 kJ· mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ· mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(4)科学家利用原电池原理,在酸性介质中将NO2转化为HNO3,则该转化的负极反应式为:
您最近一年使用:0次



