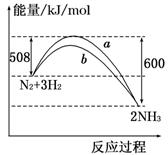
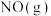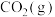已知反应① 和反应②
和反应②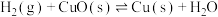 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是
 和反应②
和反应②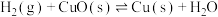 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是A.反应①的平衡常数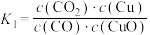 |
B.反应②中,增大氢气浓度,平衡正移, 增大 增大 |
C.对于反应③,T℃时, |
| D.反应③,恒容时,温度升高,K值减小,则该反应为放热反应 |
更新时间:2024-01-07 16:18:52
|
相似题推荐
单选题
|
适中
(0.65)
名校
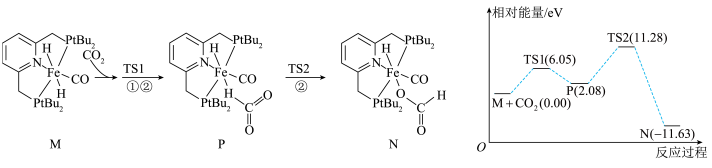
【推荐1】我国科学家研究化合物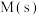 催化
催化 氢化生成甲酸的机理,其中由化合物
氢化生成甲酸的机理,其中由化合物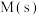 生成化合物
生成化合物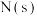 过程的机理和相对能量曲线如下图所示。
过程的机理和相对能量曲线如下图所示。 均为过渡态。下列说法正确的是
均为过渡态。下列说法正确的是
 催化
催化 氢化生成甲酸的机理,其中由化合物
氢化生成甲酸的机理,其中由化合物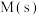 生成化合物
生成化合物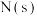 过程的机理和相对能量曲线如下图所示。
过程的机理和相对能量曲线如下图所示。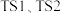 均为过渡态。下列说法正确的是
均为过渡态。下列说法正确的是
| A.过渡态TS1比化合物Р更稳定 |
| B.过程M→P为化合物M生成化合物N的决速步骤 |
C.化合物M催化 氢化生成甲酸的反应过程中一定有 氢化生成甲酸的反应过程中一定有 键的生成和断裂 键的生成和断裂 |
D.由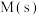 生成 生成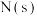 的热化学方程式: 的热化学方程式: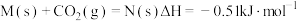 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】已知:① C(s)+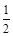 O2(g)
O2(g) CO(g) ②2H2(g)+ O2(g)
CO(g) ②2H2(g)+ O2(g) 2H2O(g) 经过下列处理过程后可得到C(s)+ H2O(g)
2H2O(g) 经过下列处理过程后可得到C(s)+ H2O(g) CO(g)+ H2(g)的是
CO(g)+ H2(g)的是
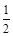 O2(g)
O2(g) CO(g) ②2H2(g)+ O2(g)
CO(g) ②2H2(g)+ O2(g) 2H2O(g) 经过下列处理过程后可得到C(s)+ H2O(g)
2H2O(g) 经过下列处理过程后可得到C(s)+ H2O(g) CO(g)+ H2(g)的是
CO(g)+ H2(g)的是| A.①−② | B.①+② | C.①−②×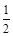 | D.①+②×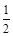 |
您最近一年使用:0次
【推荐3】通过以下反应均可获取H2,下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l) = 2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s) + H2O(g) = CO(g) + H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH3=+206.1 kJ·mol-1
①太阳光催化分解水制氢:2H2O(l) = 2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s) + H2O(g) = CO(g) + H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH3=+206.1 kJ·mol-1
| A.反应①可知,氢气的燃烧热为571.6kJ·mol-1 |
| B.反应②为吸热反应,不能自发进行 |
| C.反应③使用催化剂,∆H3减小 |
| D.反应CH4(g) = C(s) + 2H2(g) 的∆H=+74.8 kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】活泼自由基与氧气的反应一直是科学家关注的热点。HNO自由基与 反应过程的能量变化如图所示,下列说法
反应过程的能量变化如图所示,下列说法不正确 的是
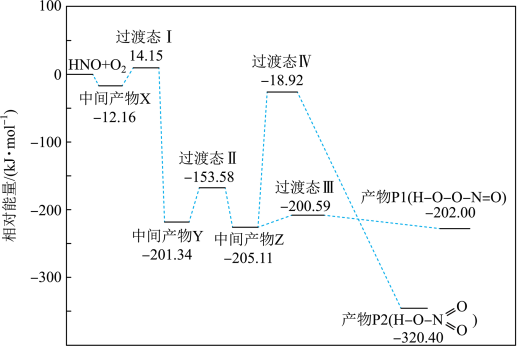
 反应过程的能量变化如图所示,下列说法
反应过程的能量变化如图所示,下列说法
| A.该反应为放热反应 |
| B.从反应过程图可知,生成产物P2的过程中,中间产物Z生成产物P2的过程为整个反应过程的决速步骤 |
C.该历程中最大正反应的活化能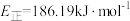 |
D.相同条件下,由中间产物Z转化为产物的速率: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列反应属于氧化还原反应且为吸热反应的是
| A.用天然气作灶具燃料 | B.用氢气还原氧化铜 |
C. 与 与 反应 反应 | D.用盐酸除去氯化钠中的 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】对于工业合成氨反应
 ,若要提高平衡产率,下列方法可行的是
,若要提高平衡产率,下列方法可行的是

 ,若要提高平衡产率,下列方法可行的是
,若要提高平衡产率,下列方法可行的是| A.提高反应温度 | B.压缩体积 |
| C.恒容通入Ar | D.使用合适的催化剂 |
您最近一年使用:0次
【推荐2】化学实验在学科中有着非常重要的作用,结合图示实验装置,下列相关分析错误的是
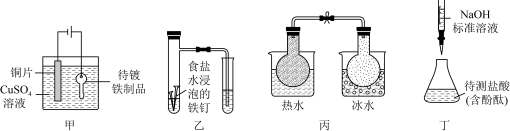

| A.用甲装置在铁制品表面镀铜 |
| B.用乙装置可验证铁的吸氧腐蚀 |
C.用丙装置可判断反应2NO2(g) N2O4(g)的△H<0 N2O4(g)的△H<0 |
| D.用丁装置可测定盐酸的浓度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能将工业废气中的NO2高效转化为HNO3.原理示意图如下。
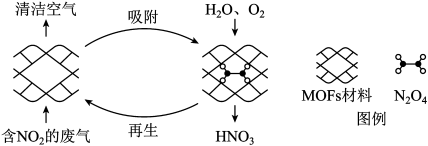
已知:2NO2(g) N2O4(g)
N2O4(g)  <0。下列说法不正确的是
<0。下列说法不正确的是

已知:2NO2(g)
 N2O4(g)
N2O4(g)  <0。下列说法不正确的是
<0。下列说法不正确的是| A.MOFs-N2O4是一种超分子 |
| B.温度升高时不利于N2O4被MOFs固定 |
C.一定温度下,多孔材料“固定”N2O4,可提高2NO2(g) N2O4(g)的平衡常数 N2O4(g)的平衡常数 |
| D.每获得0.1molHNO3时,转移电子的数目为6.02×1022 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】已知:(HF)2(g) 2HF(g)
2HF(g)  >0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
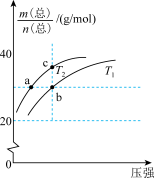
 2HF(g)
2HF(g)  >0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
| A.温度:T1<T2 |
| B.反应速率:v(b)<v(a) |
| C.平衡常数:K(a)=K(b)<K(c) |
D.当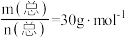 时, 时, |
您最近一年使用:0次

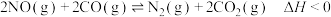 ,相关数据见下表。
,相关数据见下表。