工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ.CO2和NH3生成NH2COONH4;
ⅱ.NH2COONH4分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是
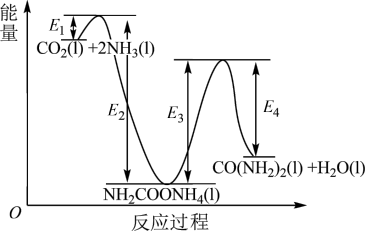
ⅰ.CO2和NH3生成NH2COONH4;
ⅱ.NH2COONH4分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是

| A.反应速率:反应ⅰ<反应ⅱ |
B.反应i正反应 ,反应ⅱ逆反应 ,反应ⅱ逆反应 |
C.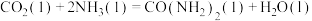  |
| D.其他条件不变的情况下,升高温度,ⅰ和ⅱ反应物转化率都增大 |
更新时间:2024-01-02 16:38:31
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
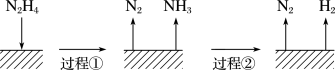
【推荐1】肼是一种常见的还原剂,不同条件下分解产物不同,60~300℃时,在 等金属表面肼分解的机理如图:
等金属表面肼分解的机理如图:
已知200℃时:Ⅰ.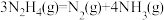
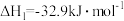 ;
;
Ⅱ.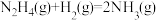
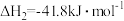
下列说法不正确 的是
 等金属表面肼分解的机理如图:
等金属表面肼分解的机理如图:
已知200℃时:Ⅰ.
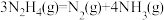
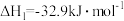 ;
;Ⅱ.
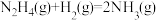
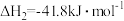
下列说法
| A.肼属于共价化合物 |
| B.图示过程①、②都是放热反应 |
C.反应Ⅰ中氧化剂与还原剂的物质的量之比为 |
D.200℃时,肼分解的热化学方程式为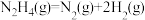 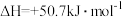 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】如图是N2与H2反应的能量变化曲线图。下列叙述正确的是
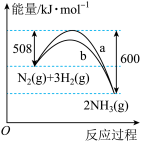

A.该反应的热化学方程式为:N2(g) + 3H2(g)  2NH3(g),△H = +92 kJ/mol 2NH3(g),△H = +92 kJ/mol |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】我国科研人员研究发现合成氨的反应历程有多种,其中有一种反应历程如图所示(吸附在催化剂表面的物质用*表示)。下列说法正确的是
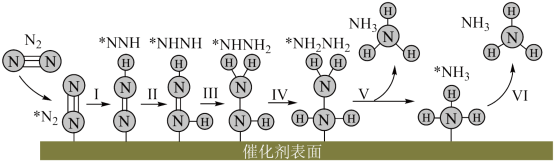

| A.使用催化剂能降低反应的焓变 |
| B.过程I和Ⅲ中能量的变化相同 |
C.对于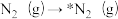 ,适当提高N2分压,可以加快反应速率,提高N2(g)转化率 ,适当提高N2分压,可以加快反应速率,提高N2(g)转化率 |
| D.若有大量氨分子吸附在催化剂表面,会降低化学反应速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】羟醛缩合反应是一种常用的增长碳链的方法。一种合成目标产物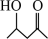 (图中⑦)的反应机理如图所示,下列说法错误的是
(图中⑦)的反应机理如图所示,下列说法错误的是

| A.③到④的过程中有极性键和非极性键的断裂和生成 |
| B.⑥中有2个手性碳原子 |
| C.①是该反应的催化剂 |
D.合成⑦的总反应为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
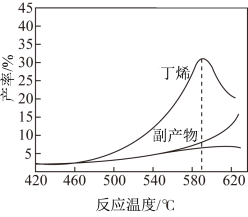
【推荐1】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备: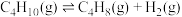
 。如图为反应的平衡产率和反应温度关系的曲线,副产物主要是高温裂解生成的短碳链烃类化合物。下列说法错误的是
。如图为反应的平衡产率和反应温度关系的曲线,副产物主要是高温裂解生成的短碳链烃类化合物。下列说法错误的是
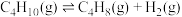
 。如图为反应的平衡产率和反应温度关系的曲线,副产物主要是高温裂解生成的短碳链烃类化合物。下列说法错误的是
。如图为反应的平衡产率和反应温度关系的曲线,副产物主要是高温裂解生成的短碳链烃类化合物。下列说法错误的是
A. |
| B.升高温度,可以加快反应速率 |
| C.600℃之前,丁烯的产率随温度升高而增大可能是催化剂的活性好,选择性高 |
| D.600℃之后,丁烯的产率随温度升高而降低是由于平衡逆向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为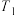 和
和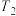 时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
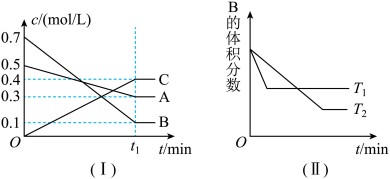
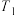 和
和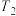 时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.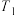 和 和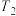 温度下分别对应的平衡常数 温度下分别对应的平衡常数 和 和 的关系是: 的关系是: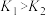 |
B.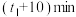 时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 |
C.T℃时,在相同容器中,若由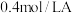 、 、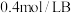 和 和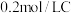 反应,达到平衡后,C的浓度仍为 反应,达到平衡后,C的浓度仍为 |
| D.其他条件不变,升高温度,正、逆反应速率均增大,A的转化率增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】光催化氧化甲烷制甲醛的机理如图所示。设NA为阿伏加德罗常数的值。下列说法不正确的是
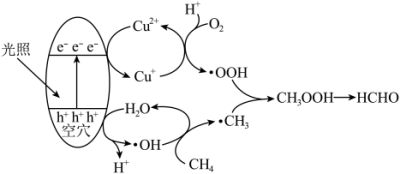
A.在光催化剂表面会发生反应 |
| B.CH3OOH为中间产物 |
| C.上述过程中有非极性键的断裂与生成 |
| D.每生成30 g HCHO,总反应转移电子数目为4NA |
您最近一年使用:0次
【推荐2】CO与N2O在铁催化剂表面进行如下两步反应:
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
其相对能量与反应历程如下图所示,下列说法不正确的是
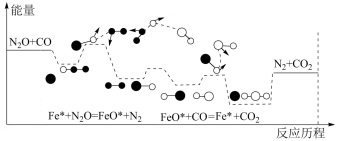
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
其相对能量与反应历程如下图所示,下列说法不正确的是

A.总反应是放热反应,化学方程式为CO+N2O CO2+N2 CO2+N2 |
| B.在反应过程中,有极性键和非极性键的断裂和生成 |
| C.总反应的反应速率由第一步反应决定 |
| D.Fe*为反应的催化剂,FeO*为中间产物 |
您最近一年使用:0次

 O2(g)=CO2(g)
O2(g)=CO2(g)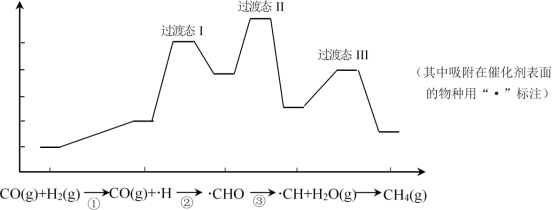
 ②只有极性键的断裂
②只有极性键的断裂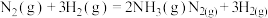

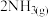 ,
,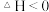 ,下列说法不正确的是(
,下列说法不正确的是( ,可促进平衡正向移动
,可促进平衡正向移动

