从富钒废渣( 、
、 、
、 )中回收
)中回收 的工艺过程可表示为
的工艺过程可表示为
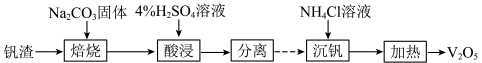
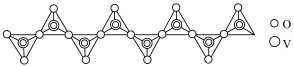
(1)“焙烧”所得钠盐的阴离子呈如图(其中钒为+5价)的无限链状结构,写出“焙烧”的化学方程式:___________ 。
(2)“沉钒”反应是向含有 的溶液中加入
的溶液中加入 溶液,析出
溶液,析出 沉淀。
沉淀。
①写出“沉钒”反应的离子方程式:___________ 。
②已知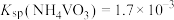 。室温下,测得“分离”后所得溶液中
。室温下,测得“分离”后所得溶液中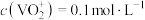 ,为使“沉钒”时钒元素的沉淀率达到99%,应使“沉钒”后的溶液中
,为使“沉钒”时钒元素的沉淀率达到99%,应使“沉钒”后的溶液中 不低于
不低于___________  。
。
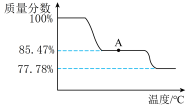
③为研究 受热发生的化学变化,某化学兴趣小组称取一定质量的
受热发生的化学变化,某化学兴趣小组称取一定质量的  在空气中加热,剩余固体质量分数(剩余固体质量/起始质量)随温度变化的曲线如图所示,则点A所得物质的化学式为
在空气中加热,剩余固体质量分数(剩余固体质量/起始质量)随温度变化的曲线如图所示,则点A所得物质的化学式为___________ 。
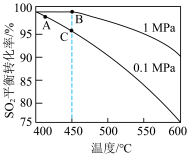
(3)一定温度下,恒压密闭容器中发生反应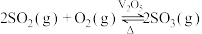 ,
, 反应温度和压强的关系如图所示。实际生产选择图中C点的反应条件,不选择A、B点的理由分别是
反应温度和压强的关系如图所示。实际生产选择图中C点的反应条件,不选择A、B点的理由分别是___________ 。
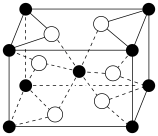
(4)还原V2O5 可以制备VO2 ,VO2的晶胞结构如图,该晶胞中矾的配位数为___________ 。
 、
、 、
、 )中回收
)中回收 的工艺过程可表示为
的工艺过程可表示为
(1)“焙烧”所得钠盐的阴离子呈如图(其中钒为+5价)的无限链状结构,写出“焙烧”的化学方程式:

(2)“沉钒”反应是向含有
 的溶液中加入
的溶液中加入 溶液,析出
溶液,析出 沉淀。
沉淀。①写出“沉钒”反应的离子方程式:
②已知
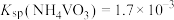 。室温下,测得“分离”后所得溶液中
。室温下,测得“分离”后所得溶液中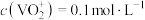 ,为使“沉钒”时钒元素的沉淀率达到99%,应使“沉钒”后的溶液中
,为使“沉钒”时钒元素的沉淀率达到99%,应使“沉钒”后的溶液中 不低于
不低于 。
。③为研究
 受热发生的化学变化,某化学兴趣小组称取一定质量的
受热发生的化学变化,某化学兴趣小组称取一定质量的  在空气中加热,剩余固体质量分数(剩余固体质量/起始质量)随温度变化的曲线如图所示,则点A所得物质的化学式为
在空气中加热,剩余固体质量分数(剩余固体质量/起始质量)随温度变化的曲线如图所示,则点A所得物质的化学式为
(3)一定温度下,恒压密闭容器中发生反应
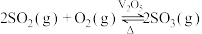 ,
, 反应温度和压强的关系如图所示。实际生产选择图中C点的反应条件,不选择A、B点的理由分别是
反应温度和压强的关系如图所示。实际生产选择图中C点的反应条件,不选择A、B点的理由分别是
(4)还原V2O5 可以制备VO2 ,VO2的晶胞结构如图,该晶胞中矾的配位数为

更新时间:2024-01-23 22:43:26
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】砷酸铜是一种蓝色粉末,难溶于水和酒精,广泛应用于木材防腐剂。某化工厂以硫化砷废渣(主要成分为As2S3,含少量的Sb、Bi)为原料制备砷酸铜的工艺流程如图所示:
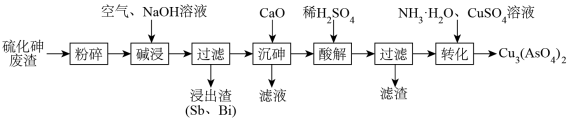
请回答下列问题:
(1)Cu3(AsO4)2中As的化合价为___________ 。
(2)“粉碎”的目的是___________ 。
(3)“碱浸”时,在加热条件下As2S3中硫元素被氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(4)“沉砷”后滤液中主要含有___________ ,该物质可循环利用到___________ 步骤中。
(5)“滤渣“的成分是___________ 。
(6)“转化”时发生的化学方程式为___________ 。
(7)该化工厂实验员称取100g硫化砷废渣(As2S3质量分数为73.8%),粉碎后通空气并加入NaOH溶液,得到1L的悬浊液,测得碱浸后的滤液中Na3AsO4的浓度为0.45mol·L-1,该实验员检测砷的浸出率为___________ 。

请回答下列问题:
(1)Cu3(AsO4)2中As的化合价为
(2)“粉碎”的目的是
(3)“碱浸”时,在加热条件下As2S3中硫元素被氧化为
 ,反应的离子方程式为
,反应的离子方程式为(4)“沉砷”后滤液中主要含有
(5)“滤渣“的成分是
(6)“转化”时发生的化学方程式为
(7)该化工厂实验员称取100g硫化砷废渣(As2S3质量分数为73.8%),粉碎后通空气并加入NaOH溶液,得到1L的悬浊液,测得碱浸后的滤液中Na3AsO4的浓度为0.45mol·L-1,该实验员检测砷的浸出率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察_______________________________________ 定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_____________________________ 。

(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________________________ ,实验中需要测量的数据是____________________________________________________ 。
(3)课本在研究浓度对反应速率影响的实验中,酸性高锰酸钾和弱酸草酸反应的离子方程式为____________________________________________________ ,反应开始一段时间后反应速率明显提升的原因是_________________________________________________________________ 。
(1)定性分析:图甲可通过观察

(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看
(3)课本在研究浓度对反应速率影响的实验中,酸性高锰酸钾和弱酸草酸反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】H2O2是一种常见试剂,在实验室、工业生产上有广泛用途

Ⅰ.实验室用H2O2快速制氧,其分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如甲乙丙丁四图所示:
(1)下列说法正确的是:________ (填字母序号)
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
(2)催化剂Mn2+在反应中,改变了____________________ (填字母序号)
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
Ⅱ.H2O2在工业上作为Fenton法主要试剂,常用于处理含难降解有机物的工业废水。在调节好pH(溶液的酸碱性)和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验,并将实验结果绘制时间-p-CP浓度图如下。
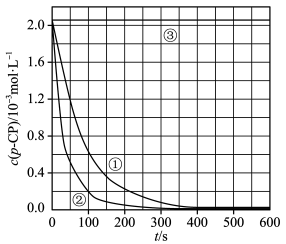
(3)电中性的羟基自由基的电子式为:______________ 。
(4)请完成以下实验设计表(表中不要留空格)。
(5)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:v(p-CP)=_____________ 。
(6)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据实验结果,给出一种迅速停止反应的方法:__________________________ 。

Ⅰ.实验室用H2O2快速制氧,其分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如甲乙丙丁四图所示:
(1)下列说法正确的是:
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
(2)催化剂Mn2+在反应中,改变了
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
Ⅱ.H2O2在工业上作为Fenton法主要试剂,常用于处理含难降解有机物的工业废水。在调节好pH(溶液的酸碱性)和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验,并将实验结果绘制时间-p-CP浓度图如下。

(3)电中性的羟基自由基的电子式为:
(4)请完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(6)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据实验结果,给出一种迅速停止反应的方法:
您最近一年使用:0次
【推荐1】TiO2和CaTiO3都是光电转化材料,某研究小组利用钛铁矿(主要成分为FeTiO3,还含有少量SiO2等杂质)来制备,并利用黄钾矾(KFe3(SO4)2(OH)6)回收铁的工艺流程如下:
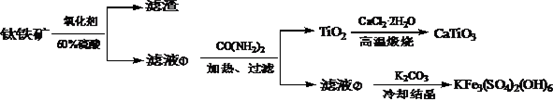
回答下列问题:
(1)“氧化酸解”的实验中,控制反应温度为150℃,不同氧化剂对钛铁矿酸解率的影响如图所示。50min时,要求酸解率大于85%,所选氧化剂应为____________ ;采用H2O2做氧化剂时,其效率低的原因可能是_______________________ 。

(2)“氧化酸解”的滤液①中加入尿素CO(NH2)2, TiO2+转化为TiO2,写出相应的离子方程式_____________________ ,使用尿素而不直接通入NH3的原因是_____________ 。
(3)写出“高温煅烧”中由TiO2制备CaTiO3的化学方程式________________ 。
(4)使Fe3+恰好沉淀完全时,溶液中c(Fe3+)=1.0×10-5mol·L-1,列式计算此时溶液的pH________ 。(Fe(OH)3的Ksp=1.0×10-39、水的Kw=1.0×10-14 mol2·L-2)
(5)黄钾钒为沉淀为晶体,含水量很少。回收Fe3+时,不采用加入氨水调节pH制得Fe(OH)3的原因是_________________ 。
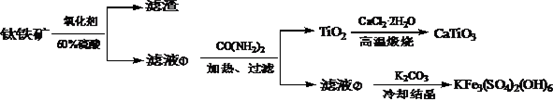
回答下列问题:
(1)“氧化酸解”的实验中,控制反应温度为150℃,不同氧化剂对钛铁矿酸解率的影响如图所示。50min时,要求酸解率大于85%,所选氧化剂应为

(2)“氧化酸解”的滤液①中加入尿素CO(NH2)2, TiO2+转化为TiO2,写出相应的离子方程式
(3)写出“高温煅烧”中由TiO2制备CaTiO3的化学方程式
(4)使Fe3+恰好沉淀完全时,溶液中c(Fe3+)=1.0×10-5mol·L-1,列式计算此时溶液的pH
(5)黄钾钒为沉淀为晶体,含水量很少。回收Fe3+时,不采用加入氨水调节pH制得Fe(OH)3的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】电解金属锰阳极渣主要成分 ,杂质为Pb、Fe、Cu元素的化合物和黄铁矿(FeS2)为原料可制备
,杂质为Pb、Fe、Cu元素的化合物和黄铁矿(FeS2)为原料可制备 ,其流程如图所示:
,其流程如图所示:

已知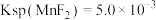 、
、 。
。
(1)“酸浸”过程中, 、
、 的质量浓度、Mn浸出率与时间的关系如图所示。
的质量浓度、Mn浸出率与时间的关系如图所示。

20~80min内,浸出Mn元素主要离子方程式为___________ 。
(2)若“净化”过程中 的浓度为
的浓度为 ,则此时
,则此时 的浓度为
的浓度为___________  。
。
(3) 制取
制取 的一种流程如图,在搅拌下向
的一种流程如图,在搅拌下向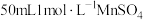 溶液中缓慢滴加
溶液中缓慢滴加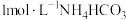 溶液,则加入
溶液,则加入 溶液的体积至少为
溶液的体积至少为___________ mL。

(4) 制取
制取 的另一种流程为:在一定条件下向
的另一种流程为:在一定条件下向 溶液中通入空气及氨水,即可生成
溶液中通入空气及氨水,即可生成 黑色沉淀。已知:反应温度和溶液pH对
黑色沉淀。已知:反应温度和溶液pH对 的纯度和产率影响分别如图1、图2所示,请补充完整由
的纯度和产率影响分别如图1、图2所示,请补充完整由 溶液制备
溶液制备 的实验方案:
的实验方案:___________ ,真空干燥4小时得产品 。实验中须使用的试剂:氨水、空气、蒸馏水、
。实验中须使用的试剂:氨水、空气、蒸馏水、 溶液。
溶液。

 ,杂质为Pb、Fe、Cu元素的化合物和黄铁矿(FeS2)为原料可制备
,杂质为Pb、Fe、Cu元素的化合物和黄铁矿(FeS2)为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知
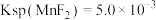 、
、 。
。(1)“酸浸”过程中,
 、
、 的质量浓度、Mn浸出率与时间的关系如图所示。
的质量浓度、Mn浸出率与时间的关系如图所示。
20~80min内,浸出Mn元素主要离子方程式为
(2)若“净化”过程中
 的浓度为
的浓度为 ,则此时
,则此时 的浓度为
的浓度为 。
。(3)
 制取
制取 的一种流程如图,在搅拌下向
的一种流程如图,在搅拌下向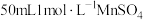 溶液中缓慢滴加
溶液中缓慢滴加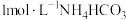 溶液,则加入
溶液,则加入 溶液的体积至少为
溶液的体积至少为
(4)
 制取
制取 的另一种流程为:在一定条件下向
的另一种流程为:在一定条件下向 溶液中通入空气及氨水,即可生成
溶液中通入空气及氨水,即可生成 黑色沉淀。已知:反应温度和溶液pH对
黑色沉淀。已知:反应温度和溶液pH对 的纯度和产率影响分别如图1、图2所示,请补充完整由
的纯度和产率影响分别如图1、图2所示,请补充完整由 溶液制备
溶液制备 的实验方案:
的实验方案: 。实验中须使用的试剂:氨水、空气、蒸馏水、
。实验中须使用的试剂:氨水、空气、蒸馏水、 溶液。
溶液。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
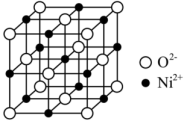
【推荐3】金属镍及其化合物具有极高的实用价值,被广泛应用于石油化工、国防、冶金等多个行业。某科研小组以废镍催化剂(含金属Ni、Cu、Fe、Mg及其氧化物,还有少量其他不溶性物质)为原料,采用如图工艺流程制备硫酸镍晶体( )。
)。

已知:室温下 ,
, 。回答下列问题:
。回答下列问题:
(1)Ni的价层电子排布式为___________ 。
(2)“除铜”中反应达到平衡后,溶液中 =
=___________ 。
(3)“焙烧”时常采用多层气固逆流操作,其目的是___________ 。该步涉及的主要反应中氧化剂和还原剂的物质的量之比为___________ 。
(4)根据下表的数据,则调节溶液pH的范围是___________ 。滤渣3主要成分的电子式为___________ 。
(5)“沉镍”步骤中发生反应的离子方程式为___________ 。
(6)某种半导体NiO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,半径 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为___________  (用含a,
(用含a, 的表达式表示)。
的表达式表示)。
 )。
)。
已知:室温下
 ,
, 。回答下列问题:
。回答下列问题:(1)Ni的价层电子排布式为
(2)“除铜”中反应达到平衡后,溶液中
 =
=(3)“焙烧”时常采用多层气固逆流操作,其目的是
(4)根据下表的数据,则调节溶液pH的范围是
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 6.3 | 1.5 | 8.9 | 6.9 |
| 沉淀完全的pH | 8.3 | 2.8 | 10.9 | 89 |
(6)某种半导体NiO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,半径
 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为 (用含a,
(用含a, 的表达式表示)。
的表达式表示)。
您最近一年使用:0次
【推荐1】芯片作为科技产业,以及信息化、数字化的基础,一直倍受关注。芯片制造会经过六个最为关键的步骤;沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。___________ 。
②GaN、GaP、GaAs熔融状态均不导电,据此判断它们是___________ 化合物。它们的晶体结构与金刚石相似,试分析GaN、GaP、GaAs熔点由大到小的顺序为___________ 。
③GaAs的晶体结构如图甲(白色球为Ga原子)所示,1molGaAs中配位键的数目为___________ 。
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其S原子的杂化方式为___________ 。

(3)“光刻”时,紫外负型光刻胶常含有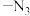 (叠氮基),在紫外光下可以形成阴离子
(叠氮基),在紫外光下可以形成阴离子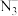 ,
,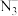 的等电子体有
的等电子体有___________ (填化学式,写出一种即可),其空间构型为___________ 。
(4)“刻蚀”过程可能用到刻蚀剂HF, 及清洗剂
及清洗剂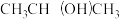 ,三种物质中属于第二周期的元素电负性由大到小的顺序为
,三种物质中属于第二周期的元素电负性由大到小的顺序为___________ 。氢氟酸是弱酸,在水溶液中存在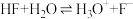 ,
,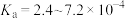 ,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:
,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:___________ 。
(5)LiF晶体结构属于氯化钠型,LiF晶体的密度约为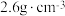 ,LiF晶胞体积V=
,LiF晶胞体积V=___________ cm-3。(列出计算式,设阿伏加德罗常数的值为 )
)
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。

②GaN、GaP、GaAs熔融状态均不导电,据此判断它们是
③GaAs的晶体结构如图甲(白色球为Ga原子)所示,1molGaAs中配位键的数目为
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其S原子的杂化方式为

(3)“光刻”时,紫外负型光刻胶常含有
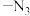 (叠氮基),在紫外光下可以形成阴离子
(叠氮基),在紫外光下可以形成阴离子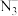 ,
,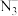 的等电子体有
的等电子体有(4)“刻蚀”过程可能用到刻蚀剂HF,
 及清洗剂
及清洗剂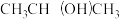 ,三种物质中属于第二周期的元素电负性由大到小的顺序为
,三种物质中属于第二周期的元素电负性由大到小的顺序为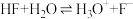 ,
,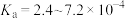 ,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:
,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:(5)LiF晶体结构属于氯化钠型,LiF晶体的密度约为
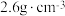 ,LiF晶胞体积V=
,LiF晶胞体积V= )
)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
(1)图1所示的几种碳单质,它们互为_______ ,其中属于原子晶体的是_______ , 间的作用力是
间的作用力是_______ 。

(2)酞菁和钴酞菁的分子结构如图2所示。
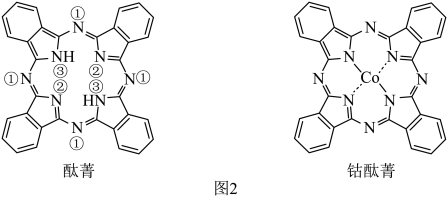
酞菁分子中所有原子共平面,其中 轨道能提供一对电子的
轨道能提供一对电子的 原子是
原子是_______ (填图2酞菁中 原子的标号)。钴酞菁分子中,钴离子的化合价为
原子的标号)。钴酞菁分子中,钴离子的化合价为_______ ,氮原子提供孤对电子与钴离子形成_______ 键。
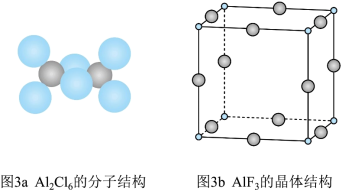
(3)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图3a所示,二聚体中
的形式存在,其空间结构如图3a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为_______ 。 的熔点为
的熔点为 ,远高于
,远高于 的
的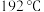 ,由此可以判断铝氟之间的化学键为
,由此可以判断铝氟之间的化学键为_______ 键。 结构属立方晶系,晶胞如图3b所示,
结构属立方晶系,晶胞如图3b所示, 的配位数为
的配位数为_______ 。若晶胞参数为 ,晶体密度
,晶体密度
_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)图1所示的几种碳单质,它们互为
 间的作用力是
间的作用力是
(2)酞菁和钴酞菁的分子结构如图2所示。

酞菁分子中所有原子共平面,其中
 轨道能提供一对电子的
轨道能提供一对电子的 原子是
原子是 原子的标号)。钴酞菁分子中,钴离子的化合价为
原子的标号)。钴酞菁分子中,钴离子的化合价为(3)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图3a所示,二聚体中
的形式存在,其空间结构如图3a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为 的熔点为
的熔点为 ,远高于
,远高于 的
的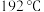 ,由此可以判断铝氟之间的化学键为
,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图3b所示,
结构属立方晶系,晶胞如图3b所示, 的配位数为
的配位数为 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图。
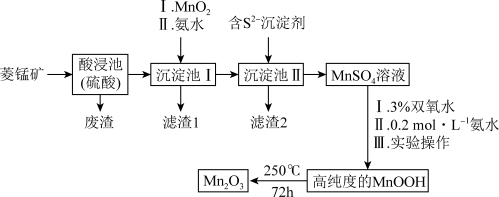
25℃时,相关物质的Ksp见表。
已知:氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
(1)MnOOH中Mn的化合价为___________ 价。
(2)向“沉淀池Ⅰ”中加入MnO2,MnO2的作用是___________ ,在“沉淀池Ⅰ”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为___________ (当溶液中某离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(3)MnSO4转化为MnOOH的离子方程式为___________ 。
(4)MnSO4转化为MnOOH中“Ⅲ实验操作”包含过滤、洗涤、干燥。检验MnOOH是否洗涤干净,具体操作为___________ 。
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。

①以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为___________ 。
②MnS晶胞结构如图所示,其中Mn的配位数为___________ 。
③已知:MnS晶体的密度为ρg•cm-3,NA为阿伏加德罗常数的值。则MnS晶胞中阴、阳离子最近距离为___________ pm(列出计算式即可)。

25℃时,相关物质的Ksp见表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)MnOOH中Mn的化合价为
(2)向“沉淀池Ⅰ”中加入MnO2,MnO2的作用是
(3)MnSO4转化为MnOOH的离子方程式为
(4)MnSO4转化为MnOOH中“Ⅲ实验操作”包含过滤、洗涤、干燥。检验MnOOH是否洗涤干净,具体操作为
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。

①以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为
②MnS晶胞结构如图所示,其中Mn的配位数为
③已知:MnS晶体的密度为ρg•cm-3,NA为阿伏加德罗常数的值。则MnS晶胞中阴、阳离子最近距离为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
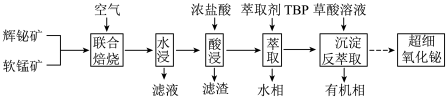
【推荐1】以辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)和软锰矿(主要成分为MnO2)为原料制备超细氧化铋的工艺流程如下:
已知: Bi3+易与Cl-形成BiCl , BiCl
, BiCl 易发生水解, 其反应的离子方程式为BiCl
易发生水解, 其反应的离子方程式为BiCl +H2O⇌BiOCl↓+5Cl-+2H+。
+H2O⇌BiOCl↓+5Cl-+2H+。
(1)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4。该反应的化学方程式为________ 。
(2)“ 酸浸”时需及时补充浓盐酸调节浸取液的pH。
①一般控制浸取液pH小于1.4,其目的是________ 。
②为提高酸浸时金属元素的浸出率,除适当增加浓盐酸用量、适当升高酸浸温度外,还可采取的措施有______ 。
(3)铋离子能被有机萃取剂(简称TBP)萃取,其萃取原理可表示为BiCl (水层)+2TBP(有机层)⇌BiCl3·2TBP(有机层)+3Cl-(水层)。
(水层)+2TBP(有机层)⇌BiCl3·2TBP(有机层)+3Cl-(水层)。
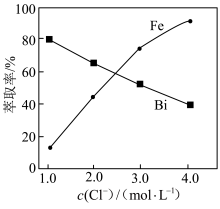
① “萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图所示。c(Cl-)最佳为1.3 mol·L-1的可能原因是________ 。
② 萃取后分液所得水相中的主要阳离子为________ (填化学式)。
(4)“ 沉淀反萃取”时生成草酸铋[Bi2(C2O4)3·7H2O]晶体。为得到含Cl-较少的草酸铋晶体,“萃取” 后有机相与草酸溶液的混合方式为________________________ 。
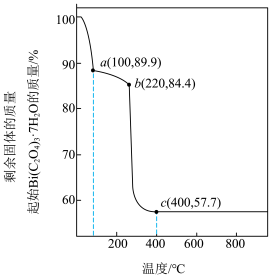
(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3·7H2O的质量的比值随温度变化的关系如图所示。400 ℃时制得超细氧化铋,其化学式为________________ 。(写出计算过程,M[Bi2(C2O4)3·7H2O]=808 g·mol-1)

已知: Bi3+易与Cl-形成BiCl
 , BiCl
, BiCl 易发生水解, 其反应的离子方程式为BiCl
易发生水解, 其反应的离子方程式为BiCl +H2O⇌BiOCl↓+5Cl-+2H+。
+H2O⇌BiOCl↓+5Cl-+2H+。(1)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4。该反应的化学方程式为
(2)“ 酸浸”时需及时补充浓盐酸调节浸取液的pH。
①一般控制浸取液pH小于1.4,其目的是
②为提高酸浸时金属元素的浸出率,除适当增加浓盐酸用量、适当升高酸浸温度外,还可采取的措施有
(3)铋离子能被有机萃取剂(简称TBP)萃取,其萃取原理可表示为BiCl
 (水层)+2TBP(有机层)⇌BiCl3·2TBP(有机层)+3Cl-(水层)。
(水层)+2TBP(有机层)⇌BiCl3·2TBP(有机层)+3Cl-(水层)。① “萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图所示。c(Cl-)最佳为1.3 mol·L-1的可能原因是
② 萃取后分液所得水相中的主要阳离子为

(4)“ 沉淀反萃取”时生成草酸铋[Bi2(C2O4)3·7H2O]晶体。为得到含Cl-较少的草酸铋晶体,“萃取” 后有机相与草酸溶液的混合方式为
(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3·7H2O的质量的比值随温度变化的关系如图所示。400 ℃时制得超细氧化铋,其化学式为

您最近一年使用:0次
【推荐2】某矿样的主要成分为Al2O3和SiO2。现以该矿样为原料制备氧化铝和高纯硅的流程如下:
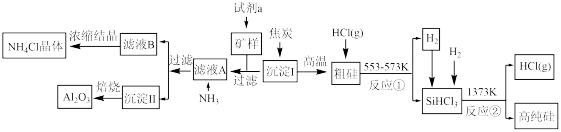
请回答下列问题:
(1)试剂a的最佳选择为________ (填代号)。
a.稀盐酸 b.氨水 c.纯碱溶液 d.醋酸
(2)由沉淀Ⅱ获得Al2O3,用到的实验仪器除了酒精灯、泥三角、玻璃棒和铁三脚外,还需要的两种仪器是____________________________ (填写仪器名称)。
(3)滤液A中通入NH3后发生反应的离子方程式为____________________________ 。
(4)NH4Cl是一种常用化肥的主要成分。现有一包肥料可能是NH4Cl或(NH4)2SO4中的一种,请设计实验进行鉴别(简述操作过程)___________________________________ 。
(5)如图所示实验装置,在实验室中制取氨气可选用装置____________ ,氨气的干燥应选用装置________ (选填代号)。


请回答下列问题:
(1)试剂a的最佳选择为
a.稀盐酸 b.氨水 c.纯碱溶液 d.醋酸
(2)由沉淀Ⅱ获得Al2O3,用到的实验仪器除了酒精灯、泥三角、玻璃棒和铁三脚外,还需要的两种仪器是
(3)滤液A中通入NH3后发生反应的离子方程式为
(4)NH4Cl是一种常用化肥的主要成分。现有一包肥料可能是NH4Cl或(NH4)2SO4中的一种,请设计实验进行鉴别(简述操作过程)
(5)如图所示实验装置,在实验室中制取氨气可选用装置

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】“钢是虎,钒是翼,钢含钒犹如虎添翼”,金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示: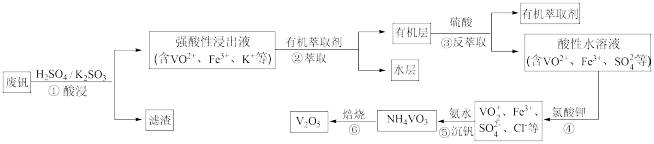
已知:步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)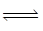 RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)。
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)。
回答下列问题:
(1)步骤①酸浸过程中发生氧化还原反应的化学方程式为______________ 。
(2)萃取时应加入适量碱的作用是___________________ 。
(3)步骤④中反应的离子方程式为___________________ 。
(4)步骤⑤25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
通过表中数据分析,在实际生产中,⑤中加入氨水,调节溶液的最佳pH范围为______ ;
若加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____ mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为_________________ 。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______ mol/L(萃取率=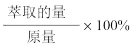 )
)

已知:步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)
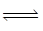 RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)。
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)。回答下列问题:
(1)步骤①酸浸过程中发生氧化还原反应的化学方程式为
(2)萃取时应加入适量碱的作用是
(3)步骤④中反应的离子方程式为
(4)步骤⑤25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=
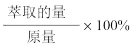 )
)
您最近一年使用:0次



