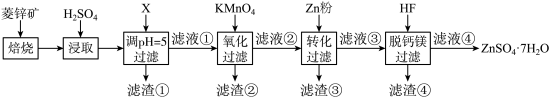
皓矾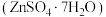 主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为
主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为 ,还含有少量
,还含有少量 以及
以及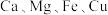 等的化合物)制备,制备流程图如图所示:
等的化合物)制备,制备流程图如图所示:

已知:常温下,金属离子开始沉淀和完全沉淀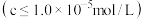 时的
时的 如下表所示:
如下表所示:
回答下列问题:
(1)写出基态铜原子的价层电子排布式_______ 。
(2)滤渣①的主要成分为_______ ;“浸取”工序中,能加快浸取效率的措施有_______ (任写一种作答)。
(3)“氧化”时该步骤离子方程式为_______ 。
(4)若“调 过滤”工序中,调节溶液
过滤”工序中,调节溶液 ,所得“滤渣②的主要成分为
,所得“滤渣②的主要成分为_______ ,氢氧化铁的溶度积常数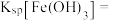
_______ 。
(5)“转化过滤”中加入锌粉的目的是_______ 。
(6)从滤液④获得皓矾晶体的具体操作为_______ 、_______ 、过滤、洗涤、干燥。
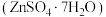 主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为
主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为 ,还含有少量
,还含有少量 以及
以及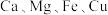 等的化合物)制备,制备流程图如图所示:
等的化合物)制备,制备流程图如图所示:
已知:常温下,金属离子开始沉淀和完全沉淀
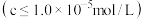 时的
时的 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |  |
开始沉淀时 | 1.9 | 6.4 | 4.7 | 7.0 | 9.1 |
沉淀完全时 | 3.4 | 8.4 | 6.7 | 9.0 | 11.1 |
(1)写出基态铜原子的价层电子排布式
(2)滤渣①的主要成分为
(3)“氧化”时该步骤离子方程式为
(4)若“调
 过滤”工序中,调节溶液
过滤”工序中,调节溶液 ,所得“滤渣②的主要成分为
,所得“滤渣②的主要成分为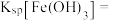
(5)“转化过滤”中加入锌粉的目的是
(6)从滤液④获得皓矾晶体的具体操作为
更新时间:2024-02-06 21:35:19
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】氨氮废水中氮元素主要以 、NH3形式存在,氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获得缓释肥料磷酸镁铵(MgNH4PO4),过程如下。
、NH3形式存在,氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获得缓释肥料磷酸镁铵(MgNH4PO4),过程如下。

已知:
(1)写出 的电子式
的电子式_______ 。
(2)经处理后,分离磷酸镁铵所用的方法是_______ 。
(3)处理氨氮废水时(氮元素以 形式存在),磷酸盐可选用Na2HPO4,主要生成MgNH4PO4沉淀,反应的离子方程式为
形式存在),磷酸盐可选用Na2HPO4,主要生成MgNH4PO4沉淀,反应的离子方程式为_______ 。
(4)向此废水中加入磷酸盐和镁盐,使铵态氮的残留达到一级排放标准(≤1.0mg/L即≤7×10-5mol/L),且c( )=1.0×10-5mol/L,则沉淀后的废水中c(Mg2+)≥
)=1.0×10-5mol/L,则沉淀后的废水中c(Mg2+)≥_______ (保留两位有效数字)。
(5)pH过大会降低废水中氨氮的去除率,可能的原因是_______ 。
(6)使用次氯酸钠等氧化剂可以将污水中的NH3氧化除去,可以产生无色无味气体,该反应的化学方程式为_______ 。某条件下,次氯酸钠投加量对污水中的氮的去除率的影响如图所示,当m(NaClO):m(NH3)>7.7时,总氮除去率随m(NaClO):m(NH3)的增大不升反降的原因_______ 。
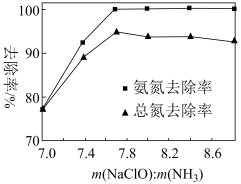
 、NH3形式存在,氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获得缓释肥料磷酸镁铵(MgNH4PO4),过程如下。
、NH3形式存在,氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获得缓释肥料磷酸镁铵(MgNH4PO4),过程如下。
已知:
| 物质 | MgNH4PO4 | Mg3(PO4)2 | Mg(OH)2 |
| 溶度积 | 2.5×10-13 | 1.04×1024 | 1.8×10-11 |
 的电子式
的电子式(2)经处理后,分离磷酸镁铵所用的方法是
(3)处理氨氮废水时(氮元素以
 形式存在),磷酸盐可选用Na2HPO4,主要生成MgNH4PO4沉淀,反应的离子方程式为
形式存在),磷酸盐可选用Na2HPO4,主要生成MgNH4PO4沉淀,反应的离子方程式为(4)向此废水中加入磷酸盐和镁盐,使铵态氮的残留达到一级排放标准(≤1.0mg/L即≤7×10-5mol/L),且c(
 )=1.0×10-5mol/L,则沉淀后的废水中c(Mg2+)≥
)=1.0×10-5mol/L,则沉淀后的废水中c(Mg2+)≥(5)pH过大会降低废水中氨氮的去除率,可能的原因是
(6)使用次氯酸钠等氧化剂可以将污水中的NH3氧化除去,可以产生无色无味气体,该反应的化学方程式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
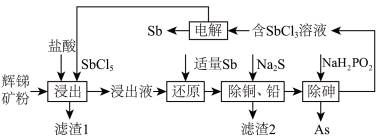
【推荐2】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度≤1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________ (填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为___________ 。
(3)“还原”时,被Sb还原的物质为___________ (填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于___________ ;所加Na2S也不宜过多,其原因为___________ 。
(5)“除砷”时有H3PO3生成,该反应的化学方程式为___________ 。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为___________ 。
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度≤1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有
(2)“浸出”时,Sb2S3发生反应的化学方程式为
(3)“还原”时,被Sb还原的物质为
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于
(5)“除砷”时有H3PO3生成,该反应的化学方程式为
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】现有原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子在基态时其最外层电子数是其内层电子数的2倍,Q原子在基态时其2p能级上有2个未成对电子,W元素的原子中3d能级上有4个未成对电子。回答下列问题:
(1)化合物 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是___________ 。
(2)元素W能形成多种配合物,如: 等。
等。
①基态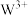 的M层电子排布式为
的M层电子排布式为___________ 。其单质在熔融时要破坏___________ 。
② 在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断 晶体属于
晶体属于___________ (填晶体类型)晶体,该晶体中W的化合价为___________ 。
(3)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为___________ 。每个阳离子周围距离最近的阳离子个数为___________ 。已知该晶体的密度为ρg/m3,阿伏加德罗常数的值为 ,则晶胞边长为
,则晶胞边长为___________ cm。(用含 的代数式表示)
的代数式表示)
(1)化合物
 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是(2)元素W能形成多种配合物,如:
 等。
等。①基态
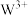 的M层电子排布式为
的M层电子排布式为②
 在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断 晶体属于
晶体属于(3)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为
 ,则晶胞边长为
,则晶胞边长为 的代数式表示)
的代数式表示)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】铁元素被称为“人类第一元素”,铁及其化合物具有广泛的用途。
(1)水体中过量的 是一种重要污染物,可利用纳米铁粉将其除去。
是一种重要污染物,可利用纳米铁粉将其除去。
①基态铁原子核外电子排布式:___________ ;铁元素在元素周期表中的位置为___________ ,属于___________ 区元素。
②相同条件下,向含有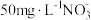 的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉,
的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉, 的去除速率差异如图1所示,产生该差异的可能原因为
的去除速率差异如图1所示,产生该差异的可能原因为___________ 。


(2)铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图2所示。储氢时, 分子位于晶胞体心和棱的中心位置。
分子位于晶胞体心和棱的中心位置。
①该晶胞中 的配位数是
的配位数是___________ 。
②该合金储满氢后所得晶体的化学式是___________ 。
(3)在生产中,常用 处理
处理 的含
的含 (
( 价)废水得到
价)废水得到 和
和 。
。 易被氧化为
易被氧化为 ,请利用核外电子排布的相关原理解释其原因:
,请利用核外电子排布的相关原理解释其原因:___________ 。
(1)水体中过量的
 是一种重要污染物,可利用纳米铁粉将其除去。
是一种重要污染物,可利用纳米铁粉将其除去。①基态铁原子核外电子排布式:
②相同条件下,向含有
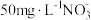 的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉,
的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉, 的去除速率差异如图1所示,产生该差异的可能原因为
的去除速率差异如图1所示,产生该差异的可能原因为

(2)铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图2所示。储氢时,
 分子位于晶胞体心和棱的中心位置。
分子位于晶胞体心和棱的中心位置。①该晶胞中
 的配位数是
的配位数是②该合金储满氢后所得晶体的化学式是
(3)在生产中,常用
 处理
处理 的含
的含 (
( 价)废水得到
价)废水得到 和
和 。
。 易被氧化为
易被氧化为 ,请利用核外电子排布的相关原理解释其原因:
,请利用核外电子排布的相关原理解释其原因:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,其元素符号为____ 。
(2)B元素是前四周期基态原子中的未成对电子数最多的,其基态原子的价电子排布图为_____ 。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该电子的轨道形状为_____ ,C的基态原子核外电子占用了_____ 个原子轨道,被其占用的最外电子层本身有_____ 个能级。
(4)D元素是自然界中含量居第二位的金属元素,其+3价离子简化的核外电子排布式为______ ,该离子比同元素的其它离子更稳定的原因是_____ 。
(5)E元素原子最外层电子数是电子层数的3倍,其核外共有_____ 种能量不同的电子,写出E的具有18个电子的氢化物的电子式:_____ 。
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,其元素符号为
(2)B元素是前四周期基态原子中的未成对电子数最多的,其基态原子的价电子排布图为
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该电子的轨道形状为
(4)D元素是自然界中含量居第二位的金属元素,其+3价离子简化的核外电子排布式为
(5)E元素原子最外层电子数是电子层数的3倍,其核外共有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取Na2CrO4晶体的工艺流程如下:
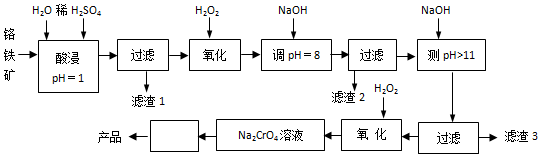
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下部分阳离子以氢氧化物形式沉淀时溶液pH如下:
(1)滤渣1主要成分是__________________ 。
(2)写出流程中第1次使用H2O2时,发生反应的离子方程式__________________ 。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?___________ 。
(4)写出第2次使用H2O2时,发生反应的离子方程式___________ 。
(5)流程图中从Na2CrO4溶液至产品中间“□”内的操作是__________ 、__________ 过滤、洗涤、干燥
(6)当溶液调pH=10时,则溶液中c(Mg2+) 为__________ 。【已知Ksp(Mg(OH)2)=5.6×10-12】
(7) 在酸性条件下转化为
在酸性条件下转化为 。工业上常用Fe2+处理酸性K2Cr2O7废水,先将
。工业上常用Fe2+处理酸性K2Cr2O7废水,先将 转化为Cr3+,该反应的离子方程式为
转化为Cr3+,该反应的离子方程式为_____________ ,再调节溶液的pH使金属离子生成沉淀而除去。

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下部分阳离子以氢氧化物形式沉淀时溶液pH如下:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | —— | —— |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(1)滤渣1主要成分是
(2)写出流程中第1次使用H2O2时,发生反应的离子方程式
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?
(4)写出第2次使用H2O2时,发生反应的离子方程式
(5)流程图中从Na2CrO4溶液至产品中间“□”内的操作是
(6)当溶液调pH=10时,则溶液中c(Mg2+) 为
(7)
 在酸性条件下转化为
在酸性条件下转化为 。工业上常用Fe2+处理酸性K2Cr2O7废水,先将
。工业上常用Fe2+处理酸性K2Cr2O7废水,先将 转化为Cr3+,该反应的离子方程式为
转化为Cr3+,该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】利用铝锂钴废料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质,Co3O4具有较强氧化性)制备CoO的工艺流程如图所示。
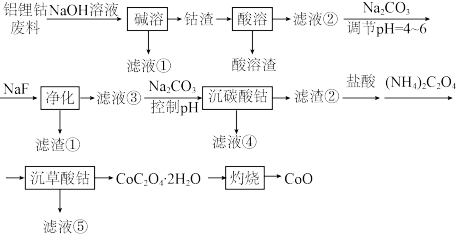
已知:I.不同浸出剂“酸溶”结果
II.Al3+在pH为5.2时沉淀完全。
III.LiF的Ksp为1.8×10-3。
回答下列问题:
(1)“碱溶”时为提高浸出率可采取的措施是_______ (写出一种即可),并写出主要的离子方程式:_______ 。
(2)“酸溶”时最佳的浸出剂应该选择_______ ,并说明理由:_______ 。
(3)“净化”时,加NaF目的是将Li+转化为沉淀,当滤液③中c(F-)=4.0×10-3mol·L-1时计算“净化”后残余c(Li+)=_______ mol·L-1。
(4)写出滤渣②“酸溶”后与草酸铵反应的离子方程式_______ 。

已知:I.不同浸出剂“酸溶”结果
浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% | |
Co | Al | ||
HCl | 80.84 | 5.68 | 98.4 |
H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
III.LiF的Ksp为1.8×10-3。
回答下列问题:
(1)“碱溶”时为提高浸出率可采取的措施是
(2)“酸溶”时最佳的浸出剂应该选择
(3)“净化”时,加NaF目的是将Li+转化为沉淀,当滤液③中c(F-)=4.0×10-3mol·L-1时计算“净化”后残余c(Li+)=
(4)写出滤渣②“酸溶”后与草酸铵反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】云南是有色金属王国。利用云南钛铁精矿(主要成分为TiO2、Fe2TiO3, 还有少量SiO2、MgO等)制备还原铁粉和富钛料(制钛白粉的优质原料)的试验研究工艺流程如下:
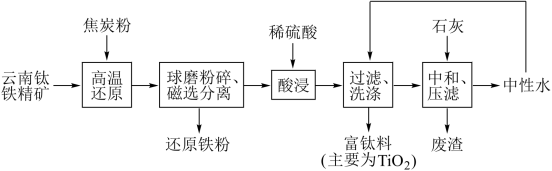
回答下列问题:.
(1) Fe2TiO3可用氧化物的形式表示为_______ (其中铁元素的化合价为+3); Fe2TiO3 被焦炭粉还原的化学方程式为 ________ ; 还原时间对还原铁粉中铁含量的影响如图所示,可确定还原时间为 _________ h较合理。

(2)磁选可分离出还原铁粉,是利用金属铁具有_________ 的物理性质。
(3)若磁选分离不完全,所得尾渣酸浸时会有气泡产生,该反应的离子方程式为__________ ;富钛料.中除TiO2外,还含有 _______ (填化学式)。
(4)已知CaSO4的Ksp=9.1×10-6。中性水中c(Ca2+)=_______ (忽略残留的其它金属离子)。

回答下列问题:.
(1) Fe2TiO3可用氧化物的形式表示为

(2)磁选可分离出还原铁粉,是利用金属铁具有
(3)若磁选分离不完全,所得尾渣酸浸时会有气泡产生,该反应的离子方程式为
(4)已知CaSO4的Ksp=9.1×10-6。中性水中c(Ca2+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】我国化学家侯德榜改革国外的纯碱生产工艺,探索出了一种生产纯碱的方法,其生产流程可简要表示如下:
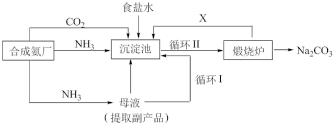
(1)上述生产纯碱的方法称为________ ,副产品的一种用途为_______ 。
(2)沉淀池中发生反应的化学方程式是__________________ 。
(3)写出上述流程中X物质的分子式为________ 。
(4)从沉淀池中取出沉淀的操作叫________________ 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________ 。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有________ 。
a.增大 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度

(1)上述生产纯碱的方法称为
(2)沉淀池中发生反应的化学方程式是
(3)写出上述流程中X物质的分子式为
(4)从沉淀池中取出沉淀的操作叫
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
a.增大
 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如图:

实验室中可用FeSO4(由铁粉和稀硫酸反应制得)和NH4HCO3用如图装置模拟上述流程中的“转化”环节。
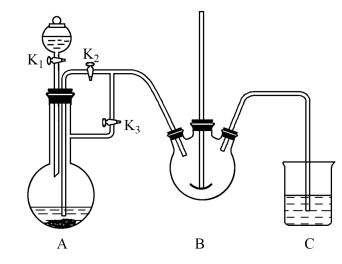
回答下列问题:
(1)配制溶液所用的蒸馏水须先除去其中溶解的氧气,具体方法是___________ 。
(2)装置A用于制备FeSO4,实验过程中,欲将生成的FeSO4溶液与装置B中的NH4HCO3溶液混合,操作方法是关闭___________ ,打开___________ (填“K1”、“K2”或“K3”);装置B中生成FeCO3的离子方程式为___________ 。
(3)转化过程中温度不超过35℃,主要原因是___________ ;“过滤”环节,不需要使用下列仪器中的___________ (填仪器名称)。

(4)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为___________ ;检验产品中是否含Fe3+需要的试剂有稀H2SO4和___________ (填化学式)。
(5)取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为___________ %(计算结果取整数)。

实验室中可用FeSO4(由铁粉和稀硫酸反应制得)和NH4HCO3用如图装置模拟上述流程中的“转化”环节。

回答下列问题:
(1)配制溶液所用的蒸馏水须先除去其中溶解的氧气,具体方法是
(2)装置A用于制备FeSO4,实验过程中,欲将生成的FeSO4溶液与装置B中的NH4HCO3溶液混合,操作方法是关闭
(3)转化过程中温度不超过35℃,主要原因是

(4)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为
(5)取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如图:
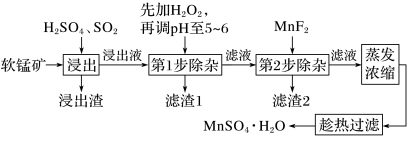
已知:①部分金属阳离子完全沉淀时的pH如表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为___________ ;
(2)第1步除杂中加入H2O2的目的是___________ ;
(3)第1步除杂中形成滤渣1的主要成分为___________ (填化学式),调pH至5~6所加的试剂,可选择___________ (填字母)。
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式:___________ ,该反应的平衡常数数值为___________ ;(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11)
(5)采用“趁热过滤”操作的原因是___________ ;
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是_______ (用离子方程式表示)。

已知:①部分金属阳离子完全沉淀时的pH如表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH | 3.2 | 5.2 | 10.4 | 12.4 |
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为
(2)第1步除杂中加入H2O2的目的是
(3)第1步除杂中形成滤渣1的主要成分为
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式:
(5)采用“趁热过滤”操作的原因是
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是
您最近一年使用:0次





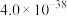
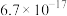
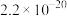

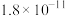
 ,最适宜使用的X是
,最适宜使用的X是 B.
B. C.
C.


