Ⅰ.实验室用如图所示简易量热计进行中和热的测定实验,请回答。
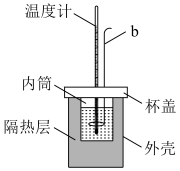
(1)图中仪器b的名称是_______ ;
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式_______ ;
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为_______ ,决定总反应速率的是第_______ 步基元反应。
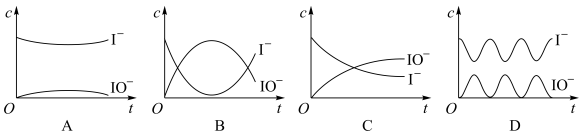
(4)反应过程中I-和IO-的浓度变化趋势为_______ 。
Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g) S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
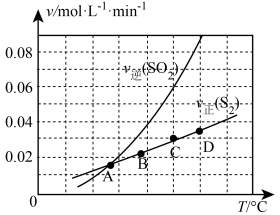
(5)A、B、C、D四点对应的状态中,达到平衡状态的有_______ (填字母)。
(6)该反应的△H_______ 0(填>、<或=)。
(7)下列措施能够增大SO2平衡转化率的是_______。

(1)图中仪器b的名称是
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为
(4)反应过程中I-和IO-的浓度变化趋势为

Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g)
 S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
(5)A、B、C、D四点对应的状态中,达到平衡状态的有
(6)该反应的△H
(7)下列措施能够增大SO2平衡转化率的是_______。
| A.降温 | B.增加C(s)的量 |
| C.减小容器体积 | D.恒压通入一定量SO2 |
更新时间:2024-02-08 23:05:24
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,实验尚缺少的玻璃用品是、___________ 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?_______ (填“能”或“否”),其原因是_______ 。
(3)他们记录的实验数据如下:
(已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ·℃-1·kg-1,各物质的密度均为1g·cm-3)
根据实验结果计算出NaOH溶液与HCl溶液反应的中和热△H=_______ 。
(4)若用KOH代替NaOH,对测定结果_______ (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果_______ (填“有”或“无”)影响。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,实验尚缺少的玻璃用品是、
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(3)他们记录的实验数据如下:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | ΔH | |||
| ① | 50mL0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.5℃ | |
根据实验结果计算出NaOH溶液与HCl溶液反应的中和热△H=
(4)若用KOH代替NaOH,对测定结果
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
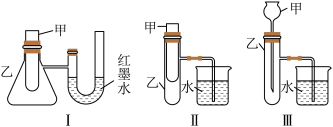
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计)_____ 。
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是_____ ,说明该反应属于____ (填“吸热反应”或“放热反应”)。
(3)为定量测定(2)中反应的反应热,使50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在简易量热计中进行中和反应。回答下列问题:
①该实验中NaOH的浓度大于盐酸的浓度的作用是_____ 。
②实验中若改用60mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所求中和热_____ (填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_____ 。
(5)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为____ (用含△H1、△H2、△H3的式子表示)。

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计)
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是
(3)为定量测定(2)中反应的反应热,使50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在简易量热计中进行中和反应。回答下列问题:
①该实验中NaOH的浓度大于盐酸的浓度的作用是
②实验中若改用60mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所求中和热
(4)已知一些化学键的键能数据如表所示:
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/kJ•mol-1 | 414 | 489 | 565 | 155 |
(5)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】I.用 盐酸与
盐酸与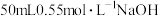 溶液,在如图所示的装置中测定强酸与强碱反应的反应热,实验数据见下表:
溶液,在如图所示的装置中测定强酸与强碱反应的反应热,实验数据见下表:
(1)在该实验中,环形玻璃搅拌棒的运动方向是___________(填字母)。
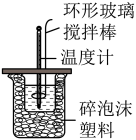
(2)加入 溶液的正确操作是
溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指___________ 温度。
(4)中和后生成的溶液的比热容c=4.18J/(g·℃),为了计算方便,近似地认为该实验所用的酸、碱溶液的密度和比热容与水相同,并忽略实验装置的比热容,已知反应过程中放出的热量Q可用公式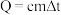 计算,试计算该实验所测反应热为
计算,试计算该实验所测反应热为___________  (结果保留一位小数)。
(结果保留一位小数)。
II.已知C、H2、CO发燃生烧反应时的燃烧热数据如下表所示:
(5)写出能表示H2燃烧热的热化学方程式:___________ 。
(6)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为应该选择___________ (填写符号),理由是___________ 。
A.H2 B.CO C.均可以
 盐酸与
盐酸与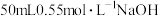 溶液,在如图所示的装置中测定强酸与强碱反应的反应热,实验数据见下表:
溶液,在如图所示的装置中测定强酸与强碱反应的反应热,实验数据见下表:起始温度 / / | 终止温度/ / / | 温度差(t2−t1)/  | ||
 |  | 平均值 | ||
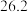 |  | 26.1 | 29.5 | |
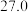 | 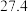 | 27.2 | 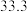 | |
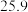 | 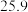 | 25.9 | 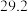 | |
 | 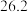 | 26.3 | 29.8 | |
(1)在该实验中,环形玻璃搅拌棒的运动方向是___________(填字母)。

| A.上下运动 | B.左右运动 | C.顺时针运动 | D.逆时针运动 |
(2)加入
 溶液的正确操作是
溶液的正确操作是A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指
(4)中和后生成的溶液的比热容c=4.18J/(g·℃),为了计算方便,近似地认为该实验所用的酸、碱溶液的密度和比热容与水相同,并忽略实验装置的比热容,已知反应过程中放出的热量Q可用公式
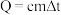 计算,试计算该实验所测反应热为
计算,试计算该实验所测反应热为 (结果保留一位小数)。
(结果保留一位小数)。II.已知C、H2、CO发燃生烧反应时的燃烧热数据如下表所示:
| 物质 | C | H2 | CO |
| ΔH/(kJ·mol−1) | −393.5 | −285.8 | −283.0 |
(5)写出能表示H2燃烧热的热化学方程式:
(6)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为应该选择
A.H2 B.CO C.均可以
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】教材采用图1实验装置测定锌与稀硫酸反应的速率。
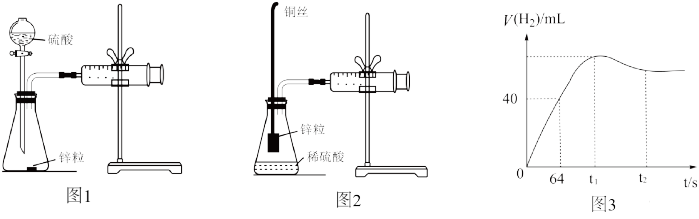
(1)检查图1装置气密性的操作方法是___________ 。
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者___________ 。(填“长”或“短”)
(3)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
a.在多孔塑料袋中装入锌粒;
b.在锥形瓶中加入40mL1mol/L硫酸;
c.塞好橡胶塞,___________ 时立即用秒表计时;
d.注射器内每增加5mL气体时读取一次秒表。
(4)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是___________ ,反应进行一定时间后速率逐渐减慢,原因是___________ 。
(5)测得产生H2的体积与反应时间的关系曲线如图3所示,在64s内用H+浓度表示的平均反应速率v(H+)=___________ (此时,溶液体积仍为40mL,气体摩尔体积为25L/mol)。

(1)检查图1装置气密性的操作方法是
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者
(3)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
a.在多孔塑料袋中装入锌粒;
b.在锥形瓶中加入40mL1mol/L硫酸;
c.塞好橡胶塞,
d.注射器内每增加5mL气体时读取一次秒表。
(4)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是
(5)测得产生H2的体积与反应时间的关系曲线如图3所示,在64s内用H+浓度表示的平均反应速率v(H+)=
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某化学兴趣小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1 mol•L-1 KClO3溶液和10mL0.3 mol•L-1 NaHSO3溶液,所得数据如图所示。已知ClO +3HSO
+3HSO =3H++Cl−+3SO
=3H++Cl−+3SO 。
。

(1)根据实验数据可知,该反应在0~4min内的平均反应速率v(Cl-)=______ mol·L-1·min-1。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表所示。
①补全方案Ⅰ中的假设:________ 。
②方案Ⅱ中加入的固体为______ (填化学式)。
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是______________ 。
④某同学从控制变量的角度思考.认为方案Ⅲ中实验操作设计不严谨,请进行改进:___________ 。
⑤反应后期化学反应速率变慢的原因是_____________ 。
 +3HSO
+3HSO =3H++Cl−+3SO
=3H++Cl−+3SO 。
。
(1)根据实验数据可知,该反应在0~4min内的平均反应速率v(Cl-)=
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表所示。
方案 | 假设 | 实验操作 |
Ⅰ | __________________ 反应速率加快 | 向烧杯中加入10mL0.1 mol•L-1KClO3溶液和10mL0.3 mol•L-1NaHSO3溶液,插入温度计 |
Ⅱ | 生成的Cl-加快了化学反应速率 | 取10mL0.1 mol•L-1KClO3溶液加入烧杯中,向其中加入少量______固体,再加入10mL0.3 mol•L-1NaHSO3溶液 |
Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向a、b两只烧杯中加入10mL0.1 mol•L-1KClO3溶液;向烧杯a中加入1mL水,向烧杯b中加入1mL10.2 mol•L-1的盐酸;再分别向两只烧杯中加入10mL0.3 mol•L-1NaHSO3溶液 |
②方案Ⅱ中加入的固体为
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是
④某同学从控制变量的角度思考.认为方案Ⅲ中实验操作设计不严谨,请进行改进:
⑤反应后期化学反应速率变慢的原因是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
(1)通过实验A、B,可探究出___ 的改变对反应速率的影响,其中V1=___ ,T1=___ ,t2 ___ 8(填“>”、“<”或“=”)。
(2)通过实验____ 可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是____ ;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为______ 。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式________ 。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是____ 。
| 实验 序号 | 实验 温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
| V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
| A | 293K | 2 | 0.05 | 8 | 0.25 | 0 | t1 |
| B | T1 | 2 | 0.05 | 6 | 0.25 | V1 | 8 |
| C | 313K | 2 | 0.05 | 6 | 0.25 | 2 | t2 |
(2)通过实验
(3)若t1<8,则由实验A、B可以得出的结论是
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】氢氧化铈[Ce(OH)4]是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备Ce(OH)4的一种工艺流程如下:

已知:在酸性溶液中Ce4+有强氧化性。回答下列问题:
(1) “氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_________________________ ,化合物CeFCO3 中Ce 的化合价为________________________ 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为__________________________________ ,酸浸时不宜温度过高的原因是____________________ 。
(3)已知有机物HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2 Ce3+ (水层) +6HT (有机层) 2CeT3 (有机层) +6H+ (水层)
2CeT3 (有机层) +6H+ (水层)
从平衡移动角度解释: 向CeT3(有机层) 加入H2SO4获得较纯的含Ce3+的水溶液的原因是____________________ 。
(4)Ce(OH)3暴露于空气中时变成紫色,最终变成黄色的Ce(OH)4,该反应的化学方程式为________________________________ 。
(5)已知298 K 时,Ksp[Ce(OH)3]=1×10-20,为了使溶液中Ce3+沉淀完全,需调节pH为______ 以上。

已知:在酸性溶液中Ce4+有强氧化性。回答下列问题:
(1) “氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为
(3)已知有机物HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2 Ce3+ (水层) +6HT (有机层)
 2CeT3 (有机层) +6H+ (水层)
2CeT3 (有机层) +6H+ (水层)从平衡移动角度解释: 向CeT3(有机层) 加入H2SO4获得较纯的含Ce3+的水溶液的原因是
(4)Ce(OH)3暴露于空气中时变成紫色,最终变成黄色的Ce(OH)4,该反应的化学方程式为
(5)已知298 K 时,Ksp[Ce(OH)3]=1×10-20,为了使溶液中Ce3+沉淀完全,需调节pH为
您最近半年使用:0次
【推荐2】合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:
①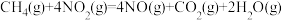 ;
;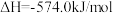 ;
;
② ,
,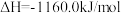 ;
;
③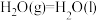 ,
, ;
;
1 mol CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的反应热为________ 。
(2)已知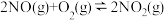 的反应历程分两步:
的反应历程分两步:
① (快);
(快);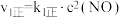 ,
, ;
;
②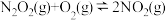 (慢);
(慢); ,
,
一定温度下,反应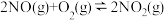 达到平衡状态,该反应的平衡常数的表达式K=
达到平衡状态,该反应的平衡常数的表达式K=____ (用 表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1
表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1____ E2(填“>”“<”或“=”)。
(3)用活性炭还原法处理氮氧化物的有关反应为: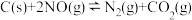 。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
①T℃时,该反应的平衡常数的计算式为______ 。
②在31 min时,若只改变某一条件使平衡发生移动,40 min、50 min时各物质的浓度如上表所示,则改变的条件是____
③在51 min时,保持温度和容器体积不变再充人NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____ v逆(填“>”、“<”或“=”)。
(4)反应N2O4(g) 2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:
2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系: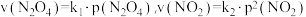 ,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
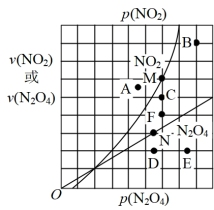
在T℃时,图中M、N点能表示该反应达到平衡状态,理由是___________ 。改变温度,v(NO2)会由M点变为A、B或C,v(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ (填字母)。
(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:
①
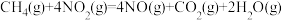 ;
;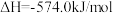 ;
;②
 ,
,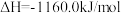 ;
;③
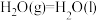 ,
, ;
;1 mol CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的反应热为
(2)已知
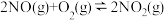 的反应历程分两步:
的反应历程分两步:①
 (快);
(快);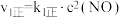 ,
, ;
;②
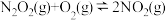 (慢);
(慢); ,
,
一定温度下,反应
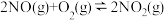 达到平衡状态,该反应的平衡常数的表达式K=
达到平衡状态,该反应的平衡常数的表达式K= 表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1
表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1(3)用活性炭还原法处理氮氧化物的有关反应为:
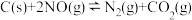 。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①T℃时,该反应的平衡常数的计算式为
②在31 min时,若只改变某一条件使平衡发生移动,40 min、50 min时各物质的浓度如上表所示,则改变的条件是
③在51 min时,保持温度和容器体积不变再充人NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正
(4)反应N2O4(g)
 2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:
2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系: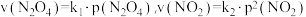 ,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
在T℃时,图中M、N点能表示该反应达到平衡状态,理由是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氯化亚铜(CuCl)是一种重要的化工产品。它难溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在水溶液中存在平衡:CuCl(白色)+2Cl﹣⇌[CuCl3]2﹣(无色溶液)。在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4﹣nCln],n随着环境酸度的改变而改变。某研究小组设计如下两种方案制备氯化亚铜。
方案一:铜粉还原CuSO4溶液
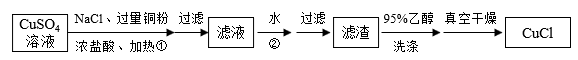
请回答:
(1)步骤①中发生反应的离子方程式为_______ 。
(2)步骤②中,加入大量水的作用是_______ 。
(3)如图流程中用95%乙醇洗涤和真空干燥是为了防止_______ 。
(4)随着pH减小,Cu2(OH)4﹣nCln中铜的质量分数_______ 。
A增大B不变C减小D不能确定
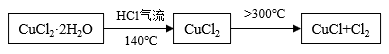
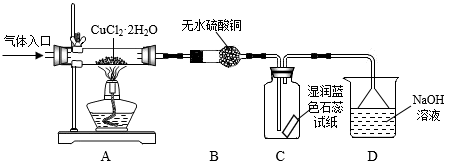
方案二:在氯化氢气流中加热CuCl2•2H2O晶体制备,其流程和实验装置(夹持仪器略)如图:
请回答:
(5)实验操作的先后顺序是a→_______ →_______ →_______ →e(填操作的编号)
a检查装置的气密性后加入药品b点燃酒精灯,加热
c在“气体入口”处通入干燥HCl d熄灭酒精灯,冷却
e停止通入HCl,然后通入N2
(6)在实验过程中,观察到B中无水硫酸铜由白色变为蓝色,C中试纸的颜色变化是_______ 。
(7)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2杂质,请分析产生CuCl2杂质的原因_______ 。
方案一:铜粉还原CuSO4溶液

请回答:
(1)步骤①中发生反应的离子方程式为
(2)步骤②中,加入大量水的作用是
(3)如图流程中用95%乙醇洗涤和真空干燥是为了防止
(4)随着pH减小,Cu2(OH)4﹣nCln中铜的质量分数
A增大B不变C减小D不能确定
方案二:在氯化氢气流中加热CuCl2•2H2O晶体制备,其流程和实验装置(夹持仪器略)如图:


请回答:
(5)实验操作的先后顺序是a→
a检查装置的气密性后加入药品b点燃酒精灯,加热
c在“气体入口”处通入干燥HCl d熄灭酒精灯,冷却
e停止通入HCl,然后通入N2
(6)在实验过程中,观察到B中无水硫酸铜由白色变为蓝色,C中试纸的颜色变化是
(7)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2杂质,请分析产生CuCl2杂质的原因
您最近半年使用:0次



