Ⅰ.氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为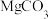 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
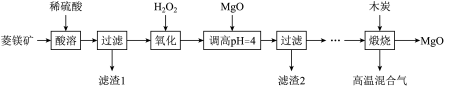
已知:① 不溶于稀硫酸和稀盐酸,
不溶于稀硫酸和稀盐酸,
②滤渣2中除了过量的MgO外,还含有 。
。
(1)酸溶时,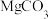 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为___________ 。
(2)滤渣1的化学式为___________ 。
(3)“氧化”流程的目的把 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为___________ 。
Ⅱ.HNO2是一种弱酸,且不稳定,易分解生成NO和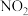 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:
。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:
(4)人体正常的血红蛋白含有 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。
(5)某同学把新制的氯水(主要成分 )加到
)加到 溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式,并用单线桥标出电子转移的方向和数目:
溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式,并用单线桥标出电子转移的方向和数目:___________ 。
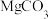 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
已知:①
 不溶于稀硫酸和稀盐酸,
不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有
 。
。(1)酸溶时,
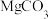 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(2)滤渣1的化学式为
(3)“氧化”流程的目的把
 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为Ⅱ.HNO2是一种弱酸,且不稳定,易分解生成NO和
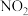 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:
。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:(4)人体正常的血红蛋白含有
 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。| A.亚硝酸盐被还原 | B.维生素C是还原剂 |
C.维生素C将 还原为 还原为 | D.亚硝酸盐是还原剂 |
(5)某同学把新制的氯水(主要成分
 )加到
)加到 溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式,并用单线桥标出电子转移的方向和数目:
溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式,并用单线桥标出电子转移的方向和数目:
更新时间:2024-02-12 11:16:53
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】镁将成为21世纪重要的轻型环保材料。
(1)海洋是天然的镁元素宝库,从海水中提取镁的流程如下:
海水中MgCl2 →Mg(OH)2→ MgCl2•6H2O →MgCl2→ Mg
①在实验室进行过滤操作时需要用到玻璃棒,其作用是___________ 。
②电解熔融氯化镁的过程中,___________ 能转化为___________ 能。
(2)①金属镁是一种较活泼金属,在二氧化碳气体中也能燃烧。燃烧的化学方程式为2Mg+CO2=C+2MgO,此反应类型属于___________
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
②金属镁在高温下与氮气反应生成氮化镁,在氮化镁中氮元素的化合价为﹣3.据此写出氮化镁的化学式___________ 。
(3)镁铝合金广泛用于火箭、导弹和飞机制造业等。某兴趣小组为探究镁铝合金的组成,取16g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
从以上数据可知,该合金中,镁元素与铝元素的质量比为___________ 。所用氢氧化钠溶液的溶质质量分数为___________ 。
(4)老师每次做有关镁的实验时都会强调:镁是一种银白色有金属光泽的金属。但拿出的镁条总是有一层灰黑色的“外衣”,这层灰黑色的外衣是什么物质呢?
猜想:小明认为可能是MgO;小赵认为可能是 Mg2(OH)2CO3;小花认为可能是Mg(OH)2 。
小花认为小明的猜想是错误的,其理由是___________ 。
实验探究:小赵按如图所示装置进行实验,发现试管口有液滴出现,澄清石灰水变浑浊,同时试管内生成白色固体。

实验分析:实验后,小赵认为小花的猜想也是错误的,其理由是___________ 。
查阅资料得出结论: Mg(OH)2和 Mg2(OH)2CO3都可以加热分解,产物均为氧化物,据此请你写出 Mg2(OH)2CO3加热分解的化学方程式___________ 。
(1)海洋是天然的镁元素宝库,从海水中提取镁的流程如下:
海水中MgCl2 →Mg(OH)2→ MgCl2•6H2O →MgCl2→ Mg
①在实验室进行过滤操作时需要用到玻璃棒,其作用是
②电解熔融氯化镁的过程中,
(2)①金属镁是一种较活泼金属,在二氧化碳气体中也能燃烧。燃烧的化学方程式为2Mg+CO2=C+2MgO,此反应类型属于
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
②金属镁在高温下与氮气反应生成氮化镁,在氮化镁中氮元素的化合价为﹣3.据此写出氮化镁的化学式
(3)镁铝合金广泛用于火箭、导弹和飞机制造业等。某兴趣小组为探究镁铝合金的组成,取16g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
(4)老师每次做有关镁的实验时都会强调:镁是一种银白色有金属光泽的金属。但拿出的镁条总是有一层灰黑色的“外衣”,这层灰黑色的外衣是什么物质呢?
猜想:小明认为可能是MgO;小赵认为可能是 Mg2(OH)2CO3;小花认为可能是Mg(OH)2 。
小花认为小明的猜想是错误的,其理由是
实验探究:小赵按如图所示装置进行实验,发现试管口有液滴出现,澄清石灰水变浑浊,同时试管内生成白色固体。

实验分析:实验后,小赵认为小花的猜想也是错误的,其理由是
查阅资料得出结论: Mg(OH)2和 Mg2(OH)2CO3都可以加热分解,产物均为氧化物,据此请你写出 Mg2(OH)2CO3加热分解的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】铝镁合金是飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_______________ 。
[实验步骤]
(1)称取10.8g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol∙L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥________ mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_______ (填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用如图1实验装置完成实验:
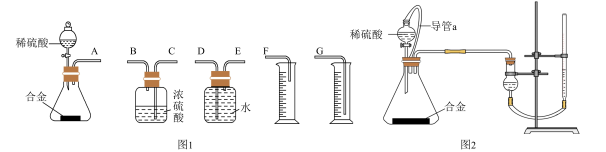
你认为最简易的装置其连接顺序是A接___ ,___ 接___ (填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图2所示的实验装置。
①实验前后右侧滴定管中液面读数分别为V1mL、V2mL,则产生氢气的体积为___ mL。(已知滴定管的零刻度在上方)
②若需确定产生氢气的量,还需测定的数据是___________ 。
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是
[实验步骤]
(1)称取10.8g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol∙L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用如图1实验装置完成实验:

你认为最简易的装置其连接顺序是A接
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图2所示的实验装置。
①实验前后右侧滴定管中液面读数分别为V1mL、V2mL,则产生氢气的体积为
②若需确定产生氢气的量,还需测定的数据是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
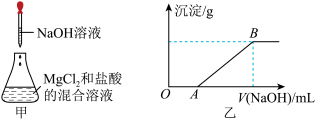
请回答下列问题。
(1)溶解MgCl2固体所用的玻璃仪器有__________ (填字母)。
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为________________________ 。
(3)AB段反应的离子方程式为________________________ 。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是有白色沉淀生成,反应的离子方程式为______________ 。

请回答下列问题。
(1)溶解MgCl2固体所用的玻璃仪器有
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为
(3)AB段反应的离子方程式为
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是有白色沉淀生成,反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐1】某校研究性学习小组用一些大部分已经锈蚀(成分为Fe2O3)的废铁屑制备绿矾(FeSO4·7H2O),实验操作过程如图:
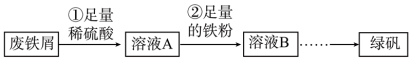
已知:杂质不溶于稀硫酸。
请回答下列问题:
(1)铁的原子结构示意图为_______ 。
(2)步骤①中,稀硫酸与 Fe2O3反应的离子方程式为_______ ,废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是_______ 。
(3)步骤②中溶液A与铁粉反应的离子方程式为_______ 。
(4)检验溶液 B 中是否还存在杂质金属阳离子的方法是_______ 。

已知:杂质不溶于稀硫酸。
请回答下列问题:
(1)铁的原子结构示意图为
(2)步骤①中,稀硫酸与 Fe2O3反应的离子方程式为
(3)步骤②中溶液A与铁粉反应的离子方程式为
(4)检验溶液 B 中是否还存在杂质金属阳离子的方法是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐2】硫铁矿(主要成分为FeS2)是工业制硫酸的主要原料。硫铁矿烧渣中含有Fe2O3、Fe3O4、Al2O3等成分,可用于制备硫酸和绿矾(FeSO4·7H2O),流程示意图如下。
(1)硫元素位于周期表中第___________ 周期,第___________ 族。
(2)硫铁矿煅烧时反应的化学方程式为___________ 。
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
为提高SO2的转化率,该反应应选择的温度是___________ ℃,压强采用“常压”的主要原因为___________ 。
(4)“还原”和“除铝”能否交换顺序?___________ (填“能”或“否”),原因是___________
(5)“结晶”过程的步骤如下:___________ (填操作和现象)。
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++ +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为___________ 。
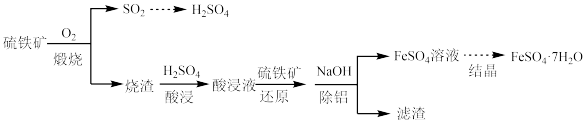
| Fe3+ | A13+ | Fe2+ | |
| 开始沉淀时的pH | |1.5 | 3.3 | 6.5 |
| 沉淀完全时的pH | 3.7 | 5.2 | 9.7 |
(1)硫元素位于周期表中第
(2)硫铁矿煅烧时反应的化学方程式为
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
| 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(4)“还原”和“除铝”能否交换顺序?
(5)“结晶”过程的步骤如下:
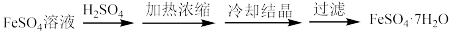
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++
 +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐3】石墨在材料领域有重要应用,某初级石墨中含 (7.8%)、
(7.8%)、 (5.1%)和
(5.1%)和 (3.1%)等杂质,提纯与综合利用工艺流程如下:
(3.1%)等杂质,提纯与综合利用工艺流程如下:
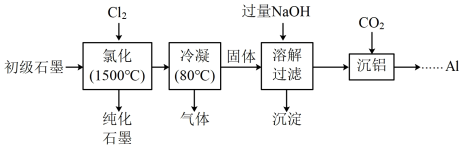
已知:
①氯化后,石墨中氧化物杂质均转变为相应的氯化物;
② 的沸点为57.6℃,金属氯化物的沸点均高于150℃。
的沸点为57.6℃,金属氯化物的沸点均高于150℃。
(1)“氯化”时,先向反应器中通入 一段时间,再加热,主要目的是
一段时间,再加热,主要目的是___________ 。
(2)“冷凝”后,所得“气体”的成分有 和
和___________ (填化学式)。
(3)“溶解过滤”时,加过量NaOH溶液的目的是___________ 。取少量滤液于试管中,___________ (实验操作及现象),证明沉淀已完全。
(4)写出Al的一种用途___________ 。
 (7.8%)、
(7.8%)、 (5.1%)和
(5.1%)和 (3.1%)等杂质,提纯与综合利用工艺流程如下:
(3.1%)等杂质,提纯与综合利用工艺流程如下:
已知:
①氯化后,石墨中氧化物杂质均转变为相应的氯化物;
②
 的沸点为57.6℃,金属氯化物的沸点均高于150℃。
的沸点为57.6℃,金属氯化物的沸点均高于150℃。(1)“氯化”时,先向反应器中通入
 一段时间,再加热,主要目的是
一段时间,再加热,主要目的是(2)“冷凝”后,所得“气体”的成分有
 和
和(3)“溶解过滤”时,加过量NaOH溶液的目的是
(4)写出Al的一种用途
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐1】用如图方法制备CuI(可用于检验实验室中的汞蒸气):
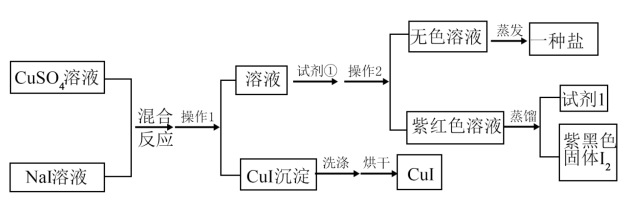
(1)CuI制备过程中,操作1的名称是___ 。操作2的名称是___ ,__ 。
(2)写出CuSO4和NaI反应的离子方程式__ 。

(1)CuI制备过程中,操作1的名称是
(2)写出CuSO4和NaI反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】为除去粗盐中的Ca2+、Mg2+、SO42—以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
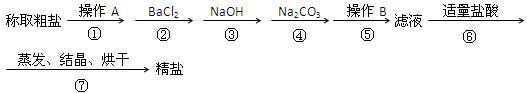
(1)第①步中,操作A是_________ ,第⑤步中,操作B_________ ;
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
_______________________ ,___________________________ ;
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_____________________________________________________________________________________ 。

(1)第①步中,操作A是
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
您最近一年使用:0次
【推荐3】刚玉在工业上有广泛的用途.其主要成分为 氧化铝。利用铝灰(主要成分为
氧化铝。利用铝灰(主要成分为 ,含少量
,含少量 、
、 、
、 杂质),制备刚玉的工艺流程如图所示:
杂质),制备刚玉的工艺流程如图所示:
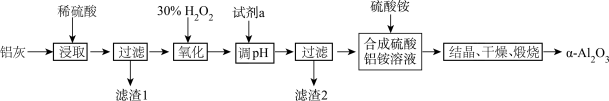
回答下列问题:
(1)“浸取”步骤中 发生反应的离子方程式为
发生反应的离子方程式为______________________________ 。
(2)滤渣1的主要成分为___________________ 。
(3)“氧化”步骤中发生反应的离子方程式为__________________________ ,此步骤需控制温度低于40℃的原因是____________________________________________ 。
(4)试剂a为_________________ 。
(5)已知:生成氢氧化物沉淀的pH如下表所示,则“调pH”的范围是________________ 。
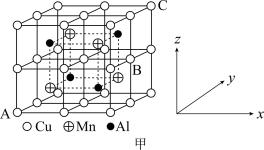
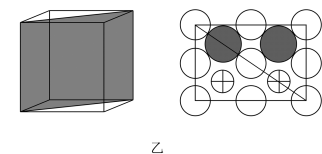
(6)Cu-Mn-Al合金的晶胞如图甲所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图乙是沿立方格子对角面取得的截图。基态锰原子的价电子排布图为__________________ ,该晶体的化学式为_________ 。
 氧化铝。利用铝灰(主要成分为
氧化铝。利用铝灰(主要成分为 ,含少量
,含少量 、
、 、
、 杂质),制备刚玉的工艺流程如图所示:
杂质),制备刚玉的工艺流程如图所示:
回答下列问题:
(1)“浸取”步骤中
 发生反应的离子方程式为
发生反应的离子方程式为(2)滤渣1的主要成分为
(3)“氧化”步骤中发生反应的离子方程式为
(4)试剂a为
(5)已知:生成氢氧化物沉淀的pH如下表所示,则“调pH”的范围是
氢氧化物 |
|
|
|
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |


您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】在生活中亚硝酸钠(NaNO2)应用十分广泛,少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组利用下列装置设计制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
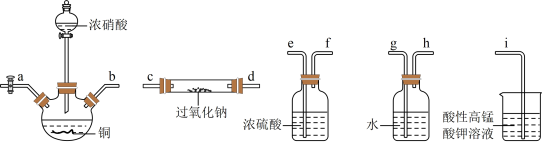
已知:①2NO+Na2O2=2NaNO2
②NO能被酸性高锰酸钾氧化为NO ,但不能被浓硫酸氧化。
,但不能被浓硫酸氧化。
回答下列问题:
(1)盛装浓硝酸的仪器名称是___________ ;铜元素位于元素周期表的________ 区。
(2)上述仪器连接顺序为______________ (气流方向从左向右,用小写字母表示)。
(3)若没有盛装浓硫酸的洗气瓶,硬质玻璃管中可能发生的副反应的化学方程式为___________ 。
(4)反应结束后需要打开止水夹a,继续通入一段时间氮气,目的是____________ 。
(5)酸性高锰酸钾溶液中发生反应的离子方程式为__________________ 。
(6)NaNO2溶液呈碱性,原因是_____________ (用离子方程式表示)。
(7)为测定产品的纯度,需配制体积为200mL的一定物质的量浓度的样品溶液,配制过程中,必须使用的玻璃仪器有烧杯、玻璃棒、_____________________ 。

已知:①2NO+Na2O2=2NaNO2
②NO能被酸性高锰酸钾氧化为NO
 ,但不能被浓硫酸氧化。
,但不能被浓硫酸氧化。回答下列问题:
(1)盛装浓硝酸的仪器名称是
(2)上述仪器连接顺序为
(3)若没有盛装浓硫酸的洗气瓶,硬质玻璃管中可能发生的副反应的化学方程式为
(4)反应结束后需要打开止水夹a,继续通入一段时间氮气,目的是
(5)酸性高锰酸钾溶液中发生反应的离子方程式为
(6)NaNO2溶液呈碱性,原因是
(7)为测定产品的纯度,需配制体积为200mL的一定物质的量浓度的样品溶液,配制过程中,必须使用的玻璃仪器有烧杯、玻璃棒、
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】绿色植物标本用醋酸铜晶体[(CH3COO)2Cu•H2O]处理后颜色更鲜艳、稳定。制备醋酸铜晶体并测定产品中铜的含量,实验如图。
醋酸铜晶体的制备
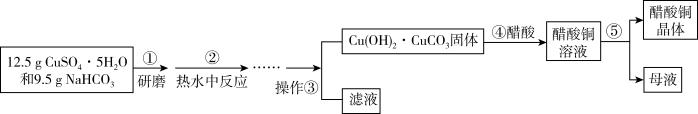
(1)步骤②将研磨后混合物注入热水中反应,写出反应的离子方程式____ ;碱式碳酸铜的制备需在热水中进行反应,且温度需控制在60℃左右,原因是____ 。
(2)操作③的名称为____ 。
(3)写出图中④发生反应的化学方程式____ 。
(4)图中⑤采用的操作为:____ 、____ 、过滤、洗涤、干燥。
醋酸铜晶体的制备

(1)步骤②将研磨后混合物注入热水中反应,写出反应的离子方程式
(2)操作③的名称为
(3)写出图中④发生反应的化学方程式
(4)图中⑤采用的操作为:
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐3】金属钼(Mo)在工业和国防建设中有重要的作用。钼的常见化合价为+4、+5、+6。由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(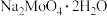 ),部分流程如下图所示:
),部分流程如下图所示:
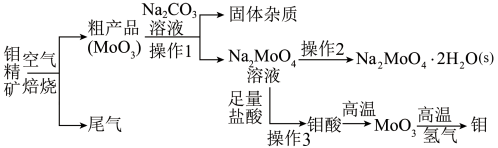
已知:钼酸微溶于水,可溶于碱溶液。
回答下列问题:
(1)钼精矿在空气中焙烧时,发生的主要方程式为_______________________ 。
(2)钼精矿焙烧时排放的尾气对环境会产生危害,请你提出一种实验室除去该尾气的方法________________________ 。
(3)操作2的名称为_____________________ 、过滤、洗涤、干燥。
(4)实验室由钼酸经高温制MoO3,所用到的硅酸盐材料仪器的名称是_________ 。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(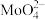 )=0.80 mol⸱L−1、c(
)=0.80 mol⸱L−1、c( )=0.05 mol⸱L−1,在结晶前需加入Ba(OH)2固体以除去溶液中的
)=0.05 mol⸱L−1,在结晶前需加入Ba(OH)2固体以除去溶液中的 。当BaMoO4开始沉淀时,SO42−的去除率是
。当BaMoO4开始沉淀时,SO42−的去除率是_________ 。[Ksp(BaSO4)=1.1 10−10、Ksp(BaMoO4)=4.0
10−10、Ksp(BaMoO4)=4.0 10−8,溶液体积变化可忽略不计。]
10−8,溶液体积变化可忽略不计。]
(6)焙烧钼精矿所用装置是多层焙烧炉,下图为各炉层固体物料的物质的量的百分数(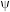 )。
)。
①x=___________ 。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2,还原剂为_________ 。若反应中转移3mole-,则消耗的还原剂的物质的量为______________ 。
 ),部分流程如下图所示:
),部分流程如下图所示:
已知:钼酸微溶于水,可溶于碱溶液。
回答下列问题:
(1)钼精矿在空气中焙烧时,发生的主要方程式为
(2)钼精矿焙烧时排放的尾气对环境会产生危害,请你提出一种实验室除去该尾气的方法
(3)操作2的名称为
(4)实验室由钼酸经高温制MoO3,所用到的硅酸盐材料仪器的名称是
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(
 )=0.80 mol⸱L−1、c(
)=0.80 mol⸱L−1、c( )=0.05 mol⸱L−1,在结晶前需加入Ba(OH)2固体以除去溶液中的
)=0.05 mol⸱L−1,在结晶前需加入Ba(OH)2固体以除去溶液中的 。当BaMoO4开始沉淀时,SO42−的去除率是
。当BaMoO4开始沉淀时,SO42−的去除率是 10−10、Ksp(BaMoO4)=4.0
10−10、Ksp(BaMoO4)=4.0 10−8,溶液体积变化可忽略不计。]
10−8,溶液体积变化可忽略不计。](6)焙烧钼精矿所用装置是多层焙烧炉,下图为各炉层固体物料的物质的量的百分数(
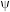 )。
)。
①x=
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2,还原剂为
您最近一年使用:0次