常温下,向Co(NO3)2、Pb(NO3)2和HR的混合液中滴加NaOH溶液,pM与pH的关系如图所示,已知pM=−lgc(M),c(M)代表c(Co2+)、c(Pb2+)或 ;Ksp[Co(OH)2]>Ksp[Pb(OH)2];当被沉淀的离子的物质的量浓度小于1×10−5mol/L时,认为该离子已沉淀完全,下列叙述
;Ksp[Co(OH)2]>Ksp[Pb(OH)2];当被沉淀的离子的物质的量浓度小于1×10−5mol/L时,认为该离子已沉淀完全,下列叙述错误的 是

 ;Ksp[Co(OH)2]>Ksp[Pb(OH)2];当被沉淀的离子的物质的量浓度小于1×10−5mol/L时,认为该离子已沉淀完全,下列叙述
;Ksp[Co(OH)2]>Ksp[Pb(OH)2];当被沉淀的离子的物质的量浓度小于1×10−5mol/L时,认为该离子已沉淀完全,下列叙述
A.X、Z分别代表−lgc(Pb2+)、−lg 与pH的关系 与pH的关系 |
| B.常温下,Co(OH)2的Ksp=1×10−15 |
| C.图中a点对应溶液的pH为6.5,此时溶液中c(R−)<c(HR) |
D.Co(OH)2(s)+Pb2+(aq) Pb(OH)2(s)+Co2+(aq)的平衡常数K=1×105 Pb(OH)2(s)+Co2+(aq)的平衡常数K=1×105 |
2024·陕西西安·一模 查看更多[3]
2024届陕西省西安市长安区高三第一次联考化学试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
更新时间:2024-02-02 20:24:41
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知氢硫酸(H2S) 的电离平衡常数为: Ka1(H2S)=9.1×10—8, Ka2(H2S)=1.1×10 -12。H2S溶液中c(总)=c(H2S)+c(HS— )+c(S2— )。室温下向25.00 mL 0.1000 mol·L—1 'H2S 溶液中逐滴滴入NaOH溶液。下列说法正确的是
| A.随着NaOH溶液滴入,溶液中水的电离程度不断增大 |
| B.c(Na+ )=c(总)的溶液: c(Na +)>c(S2—)> c(H2S)> c(H+) |
| C.pH=7的溶液: c(Na+)>c(S2—)>c(HS— )>c(OH— )=c(H+) |
| D.c(H+)=9.1×10-8 mol·L-1时: c(H2S)+2c(S2— )+c(OH— )=c(Na + )+c(H— ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,向10mL bmol·L-1的CH3COOH溶液中逐渐滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法正确的是( )
| A.b<0.01 |
| B.混合后溶液酸碱性无法判断 |
C.CH3COOH的电离常数Ka=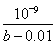 |
| D.向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】向10mL0.05mol·L-1的某稀酸HA溶液中滴入0.05mol·L-1KOH溶液,溶液中由水电离出的氢离子浓度c(H+)、溶液温度T随滴入KOH溶液体积的变化如图所示,忽略混合时溶液体积的变化。下列说法正确的是


| A.25℃时,HA的电离平衡常数K=2.04×10-5 |
| B.f点后溶液温度下降的原因是中和反应放出的热量小于电解质电离吸收的热量 |
| C.c点溶液中c(K+)=c(A-)+c(HA),e点溶液呈中性 |
| D.a点溶液中离子浓度的大小关系:c(H+)+c(HA)>c(A-)+c(OH-);d点溶液中:2c(K+)=3[c(A-)+c(HA)]=0.06mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

结合实验,下列说法正确的是
 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
结合实验,下列说法正确的是
| A.①中溶液变黄,③中溶液橙色加深 |
| B.②中Cr2O72-被C2H5OH氧化 |
| C.K2Cr2O7在碱性条件下的氧化性比酸性条件更强 |
| D.若向④中加入70%H2SO4溶液至过量,溶液变为绿色 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】①已知t℃时AgCl的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
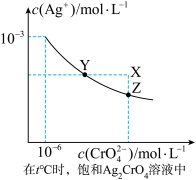

| A.在t℃时,Ag2CrO4的Ksp为1×10-9 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCl和0.01  mol/L的K2CrO4的混和溶液,CrO42-先沉淀 mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
D.在t℃ 时,反应Ag2CrO4(s)+2Cl-(aq) 时,反应Ag2CrO4(s)+2Cl-(aq)  2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 |
您最近一年使用:0次

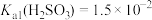 ,
,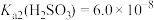 。下列说法正确的是
。下列说法正确的是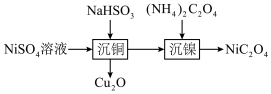
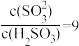
 溶液中:
溶液中: