汽车尾气中的SO2可用石灰水吸收,生成亚硫酸钙浊液。常温下,测得CaSO3与水形成的浊液pH为9,忽略SO 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=___________ (保留3位有效数字)。[已知:Ka1(H2SO3)=1.54×10-2,Ka2(H2SO3)=1.02×10-7]
 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=
2024高三下·全国·专题练习 查看更多[1]
(已下线)题型二 工艺流程中Ksp的相关计算-备战2024年高考化学答题技巧与模板构建
更新时间:2024-02-29 19:17:21
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】 是温室气体,可用
是温室气体,可用 溶液吸收得到
溶液吸收得到 或
或 ,回答下面问题:
,回答下面问题:
(1) 俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是
俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是_______ 。在纯碱溶液中下列关系成立的是_______ 。
A.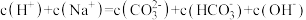
B.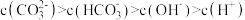
C.
D.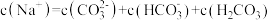
(2)已知: 的电离常数
的电离常数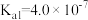 ,
,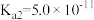 。
。
①25℃时,当 溶液中
溶液中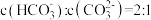 时,试求该溶液的
时,试求该溶液的
_______ ,由水电离出的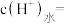
_______  。
。
② 溶液与
溶液与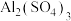 溶液反应产生气体和沉淀,是泡沫灭火器的反应原理,写出反应的离子方程式
溶液反应产生气体和沉淀,是泡沫灭火器的反应原理,写出反应的离子方程式_______ 。
③25℃时, 的
的 溶液,其水解常数
溶液,其水解常数
_______ ,大于碳酸的_______ (填“ ”或“
”或“ ”),使
”),使 溶液呈碱性。
溶液呈碱性。
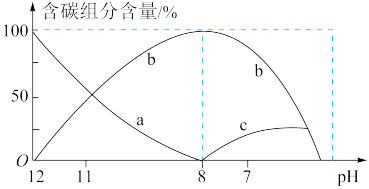
(3)常温下,向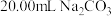 溶液中逐滴滴加
溶液中逐滴滴加 盐酸,溶液中含碳元素的三种微粒
盐酸,溶液中含碳元素的三种微粒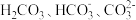 (
( 因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
①量取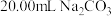 溶液应选用的仪器是
溶液应选用的仪器是_______ (填“酸式滴定管”“碱式滴定管”或“量筒”),将量取的 溶液倒入锥形瓶中,滴入几滴酚酞试剂,用
溶液倒入锥形瓶中,滴入几滴酚酞试剂,用 的标准盐酸进行滴定,发生反应的离子方程式是
的标准盐酸进行滴定,发生反应的离子方程式是_______ 。若消耗盐酸的体积为 ,则
,则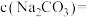
_______  。
。
②当 时,溶液中阴离子浓度由大到小的顺序是
时,溶液中阴离子浓度由大到小的顺序是_______ 。
 是温室气体,可用
是温室气体,可用 溶液吸收得到
溶液吸收得到 或
或 ,回答下面问题:
,回答下面问题:(1)
 俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是
俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是A.
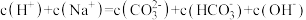
B.
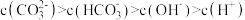
C.

D.
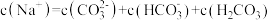
(2)已知:
 的电离常数
的电离常数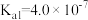 ,
,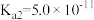 。
。①25℃时,当
 溶液中
溶液中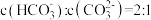 时,试求该溶液的
时,试求该溶液的
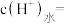
 。
。②
 溶液与
溶液与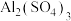 溶液反应产生气体和沉淀,是泡沫灭火器的反应原理,写出反应的离子方程式
溶液反应产生气体和沉淀,是泡沫灭火器的反应原理,写出反应的离子方程式③25℃时,
 的
的 溶液,其水解常数
溶液,其水解常数
 ”或“
”或“ ”),使
”),使 溶液呈碱性。
溶液呈碱性。(3)常温下,向
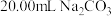 溶液中逐滴滴加
溶液中逐滴滴加 盐酸,溶液中含碳元素的三种微粒
盐酸,溶液中含碳元素的三种微粒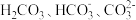 (
( 因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
①量取
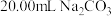 溶液应选用的仪器是
溶液应选用的仪器是 溶液倒入锥形瓶中,滴入几滴酚酞试剂,用
溶液倒入锥形瓶中,滴入几滴酚酞试剂,用 的标准盐酸进行滴定,发生反应的离子方程式是
的标准盐酸进行滴定,发生反应的离子方程式是 ,则
,则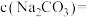
 。
。②当
 时,溶液中阴离子浓度由大到小的顺序是
时,溶液中阴离子浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】常温下,有浓度均为0.1mol·L 的下列4种溶液:①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液。
的下列4种溶液:①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液。
(1)这4种溶液的pH由大到小的顺序是____________ (填序号)。
(2)NaCN溶液呈碱性的原因是_____________ (用离子方程式说明)。
(3)若向等体积的③和④中分别滴加盐酸至溶液呈中性,则消耗盐酸的体积③_____ (填“>”、“<”或“=”)④。
(4)25℃时,将 mol·L
mol·L 的醋酸和0.1mol·L
的醋酸和0.1mol·L NaOH溶液等体积混合后,溶液的pH=7,则
NaOH溶液等体积混合后,溶液的pH=7,则
___ (填“>”、“<”或“=”)0.1。
(5)向NaCN溶液中通入CO2,则发生反应的离子方程式为_________ 。
 的下列4种溶液:①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液。
的下列4种溶液:①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液。| HCN | H2CO3 | CH3COOH |
Ka=4.9×10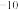 | Ka1=4.5×10 Ka2=4.7×10  | Ka=1.7×10 |
(2)NaCN溶液呈碱性的原因是
(3)若向等体积的③和④中分别滴加盐酸至溶液呈中性,则消耗盐酸的体积③
(4)25℃时,将
 mol·L
mol·L 的醋酸和0.1mol·L
的醋酸和0.1mol·L NaOH溶液等体积混合后,溶液的pH=7,则
NaOH溶液等体积混合后,溶液的pH=7,则
(5)向NaCN溶液中通入CO2,则发生反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列小题
(1) 溶液呈
溶液呈___________ (填“酸性”“碱性”或“中性”)(已知: 的
的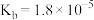 ,
, 的
的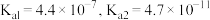 )。
)。
(2)已知:常温下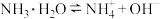
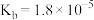


则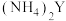 溶液的
溶液的
___________ 7(填“>”“<”或“=”)。
(3) 尾气常用
尾气常用 溶液吸收,生成
溶液吸收,生成 和
和 。已知
。已知 的水解常数
的水解常数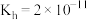 ,常温下,某
,常温下,某 和
和 混合溶液的
混合溶液的 为5,则混合溶液
为5,则混合溶液 和
和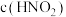 的比值为
的比值为___________ 。
(1)
 溶液呈
溶液呈 的
的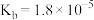 ,
, 的
的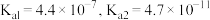 )。
)。(2)已知:常温下
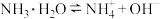
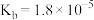


则
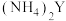 溶液的
溶液的
(3)
 尾气常用
尾气常用 溶液吸收,生成
溶液吸收,生成 和
和 。已知
。已知 的水解常数
的水解常数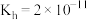 ,常温下,某
,常温下,某 和
和 混合溶液的
混合溶液的 为5,则混合溶液
为5,则混合溶液 和
和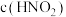 的比值为
的比值为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】完成下列空白处
(1)25℃时,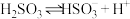 的电离常数
的电离常数 ,则该温度下
,则该温度下 水解反应的平衡常数
水解反应的平衡常数
___________ ,若向 溶液中加入少量的
溶液中加入少量的 ,发生的离子反应方程式为
,发生的离子反应方程式为___________ 。反应后溶液中 将
将___________ (填“增大”、“减小”或“不变”)。
(2)25℃时,几种物质的电离平衡常数如下:
回答下列问题:
①一般情况下,当温度升高时,Ka___________ (填“增大”、“减小”或“不变”)。
②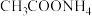 溶液中:
溶液中: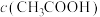
___________ 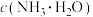 (填“=、>或<”)。醋酸的电离常数
(填“=、>或<”)。醋酸的电离常数
③请用一个离子方程式表示 和
和 结合质子的能力大小
结合质子的能力大小___________ 。
④设 溶液中
溶液中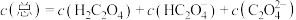 ,室温下用
,室温下用 溶液滴定25.00mL
溶液滴定25.00mL
 溶液至终点,滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
溶液至终点,滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是___________ 。
A.
 溶液:
溶液: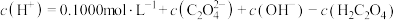
B.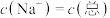 的溶液:
的溶液: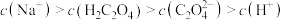
C. 的溶液:
的溶液:
D. 的溶液:
的溶液: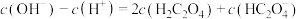
(1)25℃时,
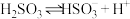 的电离常数
的电离常数 ,则该温度下
,则该温度下 水解反应的平衡常数
水解反应的平衡常数
 溶液中加入少量的
溶液中加入少量的 ,发生的离子反应方程式为
,发生的离子反应方程式为 将
将(2)25℃时,几种物质的电离平衡常数如下:
 |  |  |  |  | |
| 电离平衡常数 |  | 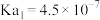 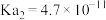 | 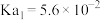 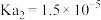 |  | 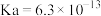 |
①一般情况下,当温度升高时,Ka
②
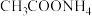 溶液中:
溶液中: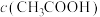
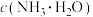 (填“=、>或<”)。醋酸的电离常数
(填“=、>或<”)。醋酸的电离常数③请用一个离子方程式表示
 和
和 结合质子的能力大小
结合质子的能力大小④设
 溶液中
溶液中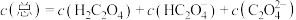 ,室温下用
,室温下用 溶液滴定25.00mL
溶液滴定25.00mL
 溶液至终点,滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
溶液至终点,滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是A.

 溶液:
溶液: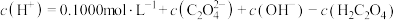
B.
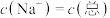 的溶液:
的溶液: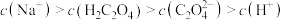
C.
 的溶液:
的溶液:
D.
 的溶液:
的溶液: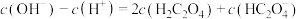
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)列出CH3COONa的水解平衡常数Kh的计算式:_________ 。
(2)物质的量浓度相同的三种溶液:a.CH3COONa b.NaHCO3 c.NaClO
三种溶液的pH由小到大排列的顺序是___ <___ < ____ (用编号填写)。
(3)写出向NaClO溶液中通入少量CO2的化学方程式________ 。
Ⅱ.(4)碳酸钠溶液呈碱性的原因是:_____________ 。(写出离子方程式)。0.01mol/L Na2CO3溶液的pH___ 0.1mol/LNa2CO3溶液的pH。(填“>”或“<”或“=”)
(5)浓度均为0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列顺序为_______ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11` | 3.0×10-8 |
(1)列出CH3COONa的水解平衡常数Kh的计算式:
(2)物质的量浓度相同的三种溶液:a.CH3COONa b.NaHCO3 c.NaClO
三种溶液的pH由小到大排列的顺序是
(3)写出向NaClO溶液中通入少量CO2的化学方程式
Ⅱ.(4)碳酸钠溶液呈碱性的原因是:
(5)浓度均为0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:

若“沉锂”中c(Li+)=1.0mol·L-1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为___________ 。(已知Li2CO3的Ksp为9.0×10-4)

若“沉锂”中c(Li+)=1.0mol·L-1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题。
(1)某温度下,纯水中的c(H+)=4.0×10-7mol·L-1,若温度不变,滴入稀NaOH溶液,使溶液中c(OH-)=5.0×10-6mol·L-1,则溶液中c(H+)=______ mol·L-1。
(2)pH相等的CH3COONa溶液与NaOH溶液,分别加热到相同的温度后CH3COONa溶液的pH______ NaOH溶液的pH(填“>”、“=”或“<”)。
(3)生活中常用氯化铵溶液除铁锈(主要成分为Fe2O3),其原理主要是______ (用离子方程式表示)。
(4)某浓缩液中所含阴离子主要是I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 =
=______ 。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。)
(1)某温度下,纯水中的c(H+)=4.0×10-7mol·L-1,若温度不变,滴入稀NaOH溶液,使溶液中c(OH-)=5.0×10-6mol·L-1,则溶液中c(H+)=
(2)pH相等的CH3COONa溶液与NaOH溶液,分别加热到相同的温度后CH3COONa溶液的pH
(3)生活中常用氯化铵溶液除铁锈(主要成分为Fe2O3),其原理主要是
(4)某浓缩液中所含阴离子主要是I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数 和弱碱的电离平衡常数
和弱碱的电离平衡常数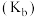 ,表2是常温下几种难(微)溶物的溶度积常数
,表2是常温下几种难(微)溶物的溶度积常数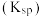
表1
表2
请回答下面问题:
(1)上述四种酸中,酸性最弱的是________ (用化学式表示)。下列能使醋酸溶液中 的电离程度增大,而电离常数不变的操作是
的电离程度增大,而电离常数不变的操作是________ (填序号)。
A升高温度
B加水稀释
C加少量的 固体
固体
D加少量冰醋酸
(2) 的水溶液呈
的水溶液呈________ (填“酸性”、“中性”或“碱性”),理由是__________ ,溶液中各离子浓度的大小关系是_________ 。
(3)物质的量之比为1∶1的 和
和 的混合溶液,其
的混合溶液,其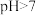 ,该溶液中离子的浓度从大到小的排列顺序为
,该溶液中离子的浓度从大到小的排列顺序为___________ 。
(4)工业中常将 转化为
转化为 后,再将其制成各种可溶性的钡盐(如:
后,再将其制成各种可溶性的钡盐(如: )。具体做法是用饱和的纯碱溶液浸泡
)。具体做法是用饱和的纯碱溶液浸泡 粉末,并不断补充纯碱,最后
粉末,并不断补充纯碱,最后 转化为
转化为 。现有足量的
。现有足量的 悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使
悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使 物质的量浓度达到
物质的量浓度达到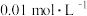 以上,则溶液中
以上,则溶液中 物质的量浓度应≥
物质的量浓度应≥________ 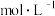 。
。
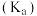 和弱碱的电离平衡常数
和弱碱的电离平衡常数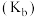 ,表2是常温下几种难(微)溶物的溶度积常数
,表2是常温下几种难(微)溶物的溶度积常数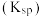
表1
| 酸或碱 | 电离常数( 或 或 ) ) |
 | 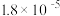 |
 | 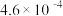 |
 | 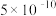 |
 | 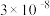 |
 | 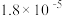 |
表2
| 难(微)溶物 | 溶度积常数( ) ) |
 | 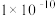 |
 | 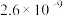 |
 | 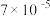 |
 | 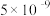 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是
 的电离程度增大,而电离常数不变的操作是
的电离程度增大,而电离常数不变的操作是A升高温度
B加水稀释
C加少量的
 固体
固体D加少量冰醋酸
(2)
 的水溶液呈
的水溶液呈(3)物质的量之比为1∶1的
 和
和 的混合溶液,其
的混合溶液,其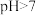 ,该溶液中离子的浓度从大到小的排列顺序为
,该溶液中离子的浓度从大到小的排列顺序为(4)工业中常将
 转化为
转化为 后,再将其制成各种可溶性的钡盐(如:
后,再将其制成各种可溶性的钡盐(如: )。具体做法是用饱和的纯碱溶液浸泡
)。具体做法是用饱和的纯碱溶液浸泡 粉末,并不断补充纯碱,最后
粉末,并不断补充纯碱,最后 转化为
转化为 。现有足量的
。现有足量的 悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使
悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使 物质的量浓度达到
物质的量浓度达到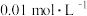 以上,则溶液中
以上,则溶液中 物质的量浓度应≥
物质的量浓度应≥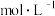 。
。
您最近一年使用:0次

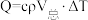 计算获得。
计算获得。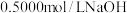 溶液)和盐酸各
溶液)和盐酸各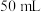 进行反应,测得反应前后体系的温度值(
进行反应,测得反应前后体系的温度值( )分别为
)分别为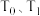 ,则该过程放出的热量为
,则该过程放出的热量为 (c和
(c和 分别取
分别取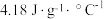 和
和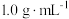 ,忽略水以外各物质吸收的热量,下同)。
,忽略水以外各物质吸收的热量,下同)。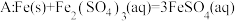 的焓变。
的焓变。 溶液时需加入酸。加酸的目的是
溶液时需加入酸。加酸的目的是

