常温下,将0.1mol·L-1NaOH溶液滴加到一定浓度的二元酸(H2R)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
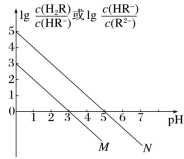

A.线N表示pH与lg 的变化关系 的变化关系 |
| B.当溶液中c(HR-)=c(R2-)时,pH=3 |
| C.NaHR溶液中c(H+)>c(OH-) |
| D.当混合溶液呈中性时,c(Na+)<c(H2R)+c(HR-)+c(R2-) |
更新时间:2024-03-10 17:46:06
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】室温下,向10 mL  的NaHCO3溶液中滴加
的NaHCO3溶液中滴加 的盐酸(或
的盐酸(或 NaOH溶液),溶液的pH随加入酸(或碱)体积的变化如图所示。下列说法正确的是
NaOH溶液),溶液的pH随加入酸(或碱)体积的变化如图所示。下列说法正确的是
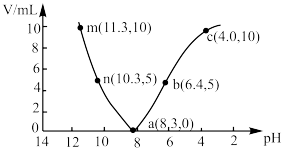
 的NaHCO3溶液中滴加
的NaHCO3溶液中滴加 的盐酸(或
的盐酸(或 NaOH溶液),溶液的pH随加入酸(或碱)体积的变化如图所示。下列说法正确的是
NaOH溶液),溶液的pH随加入酸(或碱)体积的变化如图所示。下列说法正确的是
A.根据题中信息不能判断NaHCO3溶液中 的水解程度与电离程度的大小 的水解程度与电离程度的大小 |
B.a→n→m过程中: 逐渐减小 逐渐减小 |
C.a→b→c过程中: |
D.m点的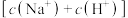 小于c点的 小于c点的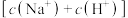 |
您最近一年使用:0次
单选题
|
较难
(0.4)
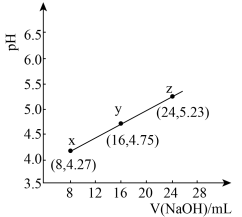
【推荐2】缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH值相对稳定。缓冲溶液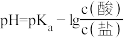 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸(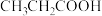 ,简写成HR)的酸性比亚硝酸(
,简写成HR)的酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定16.00ml
)弱。298K时,用pH为13的NaOH溶液滴定16.00ml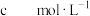 HR溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
HR溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,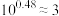 。下列叙述错误的是
。下列叙述错误的是
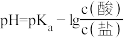 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸(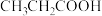 ,简写成HR)的酸性比亚硝酸(
,简写成HR)的酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定16.00ml
)弱。298K时,用pH为13的NaOH溶液滴定16.00ml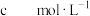 HR溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
HR溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,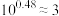 。下列叙述错误的是
。下列叙述错误的是
| A.当溶液pH为4.75时,缓冲能力最强 |
B.上述丙酸溶液浓度为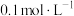 |
C.y点溶液中: |
D.其他相同, 替代HR,曲线位于图中曲线下方 替代HR,曲线位于图中曲线下方 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】已知:常温下,H2CO3 Ka1=4.2×10-7,Ka2=5.6×10-11;某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(a)随溶液pH 变化关系如下图所示,下列叙述错误的是
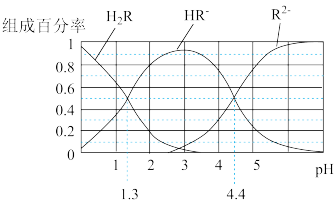

| A.在pH=4.4 的溶液中:3c(HR-)=c(Na+)+c(H+)-c(OH-) |
| B.向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R==2HCO3-+R2- |
| C.等体积等浓度的NaOH 溶液与H2R溶液混合,所得溶液中水的电离程度比纯水大 |
| D.在pH=3 的溶液中,三种微粒的浓度满足关系式: c(R2-)c(H2R)/c(HR-)2=10-3.1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等四种含氯微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是


| A.亚氯酸钠在碱性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| C.25℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
| D.若浓度均为0.1mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
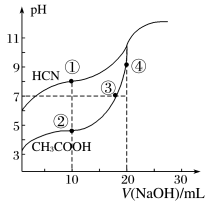
【推荐3】25℃时,弱酸的电离平衡常数如表,下列说法正确的是
| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A.等物质的量浓度溶液pH关系: pH(NaCN)> pH(Na2CO3)> pH(CH3COONa) |
| B.amol/L HCN与bmol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小 |
| D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO-3)+c(CO32-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】 时,下图表示起始浓度为
时,下图表示起始浓度为 的
的 溶液中各含碳粒子物质的量分数与
溶液中各含碳粒子物质的量分数与 的变化关系。已知:
的变化关系。已知: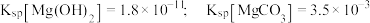 。下列说法错误的是
。下列说法错误的是
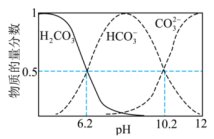
 时,下图表示起始浓度为
时,下图表示起始浓度为 的
的 溶液中各含碳粒子物质的量分数与
溶液中各含碳粒子物质的量分数与 的变化关系。已知:
的变化关系。已知: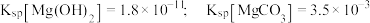 。下列说法错误的是
。下列说法错误的是
A.起始时,溶液中一定有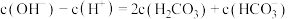 |
B.当 时,溶液中 时,溶液中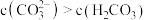 |
C.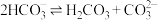 的平衡常数 的平衡常数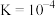 |
D.当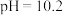 时,向溶液中加入足量 时,向溶液中加入足量 溶液,溶液中会产生两种沉淀 溶液,溶液中会产生两种沉淀 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】某温度下,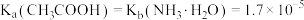 。向
。向 浓度均为
浓度均为 盐酸和醋酸的混合溶液中逐滴加入
盐酸和醋酸的混合溶液中逐滴加入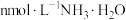 溶液,溶液电导率、
溶液,溶液电导率、 随氨水体积的变化如图。下列说法错误的是
随氨水体积的变化如图。下列说法错误的是
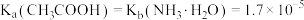 。向
。向 浓度均为
浓度均为 盐酸和醋酸的混合溶液中逐滴加入
盐酸和醋酸的混合溶液中逐滴加入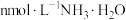 溶液,溶液电导率、
溶液,溶液电导率、 随氨水体积的变化如图。下列说法错误的是
随氨水体积的变化如图。下列说法错误的是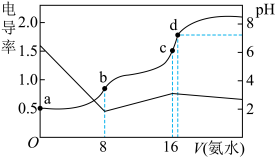
A.a点,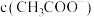 约为 约为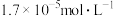 |
B.b点,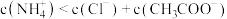 |
C.c点,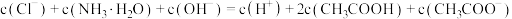 |
D.d点,氨水刚好中和盐酸和醋酸,所以水的电离程度: |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,向10 mL0.1 mol·L-1Na2XO3溶液中滴加0.1 mol·L-1盐酸,溶液的pH与盐酸体积(V)的关系如图所示。下列叙述正确的是
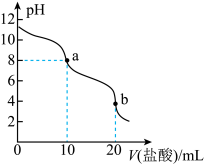

A.0.1 mol·L-1Na2XO3溶液中:c(Na+)>c(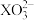 )>c( )>c(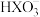 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
B.当溶液pH=7时,溶液中存在:c(Na+)=c(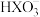 )+c( )+c(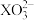 )+c(Cl-) )+c(Cl-) |
| C.常温下,H2XO3的Ka2小于1.0×10-7 |
D.b点溶液中:c(Cl-)=c(H2XO3)+c(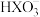 )+c( )+c(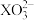 ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
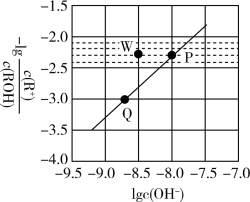
【推荐2】常温时,将 的
的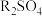 溶液(
溶液(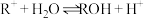 )加水稀释,溶液中
)加水稀释,溶液中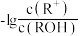 与
与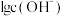 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 的
的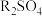 溶液(
溶液(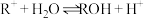 )加水稀释,溶液中
)加水稀释,溶液中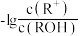 与
与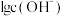 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.常温时, 的电离平衡常数为 的电离平衡常数为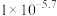 |
B.P、Q点对应的水的电离程度: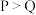 |
C.Q点对应的溶液中, |
D.常温时,加入适量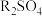 固体可使P点向W点移动 固体可使P点向W点移动 |
您最近一年使用:0次

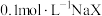 溶液加入
溶液加入 盐酸和向
盐酸和向 溶液加入
溶液加入 溶液,各混合溶液的pH与离子浓度变化关系如下图所示。下列说法正确的是
溶液,各混合溶液的pH与离子浓度变化关系如下图所示。下列说法正确的是
 表示
表示 与pH的变化关系
与pH的变化关系
 的水解常数
的水解常数
 与
与 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是



