我国科学家研究发现,常温常压下,铁基离子液体 在工业尾气中
在工业尾气中 、
、 等的脱除方面具有良好的性能。
等的脱除方面具有良好的性能。 结构如图所示。
结构如图所示。 中C原子的杂化轨道类型有
中C原子的杂化轨道类型有___________ 。在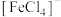 中,配体为
中,配体为___________ ,配位数为___________ 。
(2)在一定条件下 还可以转化为较稳定的
还可以转化为较稳定的
 中σ键与π键的个数比为
中σ键与π键的个数比为___________ , 的电子式为
的电子式为___________ 。
(3) 与
与 反应生成具有特征蓝色的物质X,这是实验室中检验
反应生成具有特征蓝色的物质X,这是实验室中检验 的常用方法。
的常用方法。
①科学家通过最常用的___________ 实验测定了物质X的晶体结构,其晶胞如图b所示(未表示 ),图a表示晶胞的
),图a表示晶胞的 结构(未表示K+)。
结构(未表示K+)。___________ 。
③若A处粒子的坐标参数为(0,0,0),B处粒子为(1,1,1),则C处粒子的坐标为___________ 。
④已知物质X的摩尔质量为 ,晶胞中
,晶胞中 与
与 的最小距离为dnm,阿伏加德罗常数为
的最小距离为dnm,阿伏加德罗常数为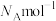 。则该晶胞中两个
。则该晶胞中两个 之间的最短距离为
之间的最短距离为___________ nm,晶体的密度为___________  。
。
 在工业尾气中
在工业尾气中 、
、 等的脱除方面具有良好的性能。
等的脱除方面具有良好的性能。 结构如图所示。
结构如图所示。
 中C原子的杂化轨道类型有
中C原子的杂化轨道类型有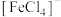 中,配体为
中,配体为(2)在一定条件下
 还可以转化为较稳定的
还可以转化为较稳定的
 中σ键与π键的个数比为
中σ键与π键的个数比为 的电子式为
的电子式为(3)
 与
与 反应生成具有特征蓝色的物质X,这是实验室中检验
反应生成具有特征蓝色的物质X,这是实验室中检验 的常用方法。
的常用方法。①科学家通过最常用的
 ),图a表示晶胞的
),图a表示晶胞的 结构(未表示K+)。
结构(未表示K+)。
③若A处粒子的坐标参数为(0,0,0),B处粒子为(1,1,1),则C处粒子的坐标为
④已知物质X的摩尔质量为
 ,晶胞中
,晶胞中 与
与 的最小距离为dnm,阿伏加德罗常数为
的最小距离为dnm,阿伏加德罗常数为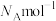 。则该晶胞中两个
。则该晶胞中两个 之间的最短距离为
之间的最短距离为 。
。
更新时间:2024-02-25 12:25:46
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物) 做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____ 。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____ ,基态原子核外未成对电子数较多的是_______ 。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________ 。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N 原子的杂化形式为____ 。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____ 。原因是____ 。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______ 。
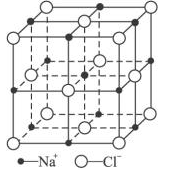
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____ g/cm3(列出计算式即可,用NA表示阿伏伽德罗常数的值)。
 。
。
(1)Fe基态原子核外电子排布式为
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N 原子的杂化形式为
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】砷(As)可作为半导体材料锗(Ge)和硅的掺杂元素,这些材料广泛应用于发光二极管、红外线发射器等。回答下列问题:
(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的______________ 性,区分这两种形态的SiO2最可靠的方法足对固体进行___________ 实验。
(2)基态砷原子的价层电子排布图为_____________ ,最高能层符号为_____________ ,Ge、As、Se第一电离能从大到小的顺序为_____________________ 。
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因_____________________ 。
(4) GeCl4分子中的键角为_____________ ,GeH4分子中Ge的_____________ 轨道和H的_________ 轨道重叠形成σ键。
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为___________ pm(只列出算式即可),Ga-As键中共用电子对偏向____________ (填“Ga”或“As”)。

(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的
(2)基态砷原子的价层电子排布图为
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因
| 化学键 | C-C | C-H | Ge-Ge | Ge-H |
| 键能(kJ·mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4分子中的键角为
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ、Cu2O 广泛应用于太阳能电池领域。以 CuSO4、NaOH 和抗坏血酸为原料,可制备 Cu2O。
(1)Cu2+基态核外电子排布式为________ 。
(2)SO42﹣的空间构型为_________ (用文字描述),Cu2+与 OH-反应能生成[Cu(OH)4 ]2-, [Cu(OH)4]2-中的配位原子为_______ (填元素符号)。
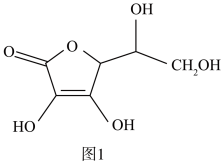
(3)抗坏血酸的分子结构如图 1 所示,分子中碳原子的轨道杂化类型为________ ;推测抗坏血酸在水中的溶解性:_______ (填“难溶于水”或“易溶于水”)。
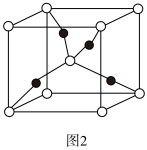
(4)一个 Cu2O 晶胞(如图 2)中,Cu 原子的数目为_________ 。
Ⅱ、磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 FeCl3、NH4H2PO4、LiCl 和苯胺等作为原料制备。回答下列问题:
(5)在周期表中,与 Li 的化学性质最相似的邻族元素是___ ,该元素基态原子核外 M层电子的自旋状态_______ (填“相同”或“相反”)。
(6)苯胺(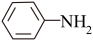 )的晶体类型是
)的晶体类型是_________ 。苯胺与甲苯(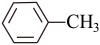 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________ 。
(1)Cu2+基态核外电子排布式为
(2)SO42﹣的空间构型为
(3)抗坏血酸的分子结构如图 1 所示,分子中碳原子的轨道杂化类型为


(4)一个 Cu2O 晶胞(如图 2)中,Cu 原子的数目为
Ⅱ、磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 FeCl3、NH4H2PO4、LiCl 和苯胺等作为原料制备。回答下列问题:
(5)在周期表中,与 Li 的化学性质最相似的邻族元素是
(6)苯胺(
 )的晶体类型是
)的晶体类型是 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,其相关信息如下表:
(1)①下列物质的分子与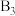 分子的空间结构最相似的是
分子的空间结构最相似的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
②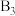 分子是否为极性分子?
分子是否为极性分子?___________ (填“是”或“否”)。
(2)根据等电子体原理,则1mol AB中含有共用电子对的数目为___________ ;
(3)工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式___________ ;若往含有 的溶液中加过量氢氧化钠溶液,可生成
的溶液中加过量氢氧化钠溶液,可生成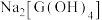 溶液,
溶液,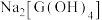 具有的化学键类型有
具有的化学键类型有___________ 。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键
(4)表中F元素与Mn、Fe在工业上统称“黑色金属”,Mn、Fe均为第4周期过渡金属元素,两元素的部分电离能数据列于下表:
F元素的单质中存在化学键为___________ ;请写出基态 的价电子轨道排布图
的价电子轨道排布图___________ ,比较两元素的 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,请解释原因
再失去1个电子难,请解释原因___________ 。
| 元素 | 相关信息 |
| A | A的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| B | B的某一种单质是大气污染物监测物之一 |
| C | C在组成化合物时没有正价 |
| D | D常温常压下,D单质是淡黄色固体,常在火山口附近沉积 |
| E | E和D同周期,E的电负性大于D |
| F | F的基态原子核外有6个原子轨道处于半充满状态 |
| G | G能形成红色的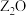 和黑色的ZO两种氧化物。 和黑色的ZO两种氧化物。 |
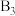 分子的空间结构最相似的是
分子的空间结构最相似的是A.
 B.
B. C.
C. D.
D.
②
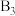 分子是否为极性分子?
分子是否为极性分子?(2)根据等电子体原理,则1mol AB中含有共用电子对的数目为
(3)工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式
 的溶液中加过量氢氧化钠溶液,可生成
的溶液中加过量氢氧化钠溶液,可生成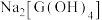 溶液,
溶液,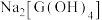 具有的化学键类型有
具有的化学键类型有A.离子键 B.极性共价键 C.非极性共价键 D.配位键
(4)表中F元素与Mn、Fe在工业上统称“黑色金属”,Mn、Fe均为第4周期过渡金属元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
电离能/ |  | 717 | 759 |
 | 1509 | 1561 | |
 | 4048 | 2957 | |
 的价电子轨道排布图
的价电子轨道排布图 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,请解释原因
再失去1个电子难,请解释原因
您最近一年使用:0次
【推荐2】ZnO是重要的化工原料。实验室以粗氧化锌(主要成分为ZnO,还含有少量Fe2O3、CuO等杂质)为原料制备碱式碳酸锌,进而热分解制备活性氧化锌。实验流程如下:
①浸出后溶液中主要含有的离子为[Zn(NH3)4]2+、[Cu(NH3)4]2+和CO ,写出生成[Zn(NH3)4]CO3的化学方程式:
,写出生成[Zn(NH3)4]CO3的化学方程式:___________ 。
②其他条件一定,当水浴温度高于42℃时,测得锌的浸出率随温度升高而降低,其可能原因是___________ 。
(2)“置换铜”:向“浸出”所得滤液中加入稍过量的锌粉,过滤,___________ ,过滤、洗涤并烘干滤渣,得到较纯净的铜。
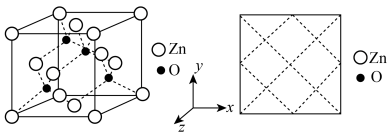
(3)氧化锌晶体的一种晶胞是如题、下左图所示的立方晶胞,其中Zn的配位数为___________ ,请在右图中画出该晶胞沿z轴方向的平面投影图___________ 。

①浸出后溶液中主要含有的离子为[Zn(NH3)4]2+、[Cu(NH3)4]2+和CO
 ,写出生成[Zn(NH3)4]CO3的化学方程式:
,写出生成[Zn(NH3)4]CO3的化学方程式:②其他条件一定,当水浴温度高于42℃时,测得锌的浸出率随温度升高而降低,其可能原因是
(2)“置换铜”:向“浸出”所得滤液中加入稍过量的锌粉,过滤,
(3)氧化锌晶体的一种晶胞是如题、下左图所示的立方晶胞,其中Zn的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】工业中可利用生产钛白的副产物 ,和硫铁矿(
,和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。
(1) 结构示意图如图:
结构示意图如图:

① 的价层电子排布式为
的价层电子排布式为___________ 。
② 中O和
中O和 中S杂化类型
中S杂化类型___________ (填“相同”或“不相同”),比较 中H-O-H键角和
中H-O-H键角和 中O-S-O键角的大小并解释原因
中O-S-O键角的大小并解释原因___________ 。
③ 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是___________ 。
(2) 晶体的晶胞形状为立方体,边长为anm,结构如图:
晶体的晶胞形状为立方体,边长为anm,结构如图:

① 的配位数
的配位数___________ 个。
② 的摩尔质量为120
的摩尔质量为120 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,晶体的密度为
,晶体的密度为___________ 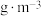 。
。
 ,和硫铁矿(
,和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。(1)
 结构示意图如图:
结构示意图如图:
①
 的价层电子排布式为
的价层电子排布式为②
 中O和
中O和 中S杂化类型
中S杂化类型 中H-O-H键角和
中H-O-H键角和 中O-S-O键角的大小并解释原因
中O-S-O键角的大小并解释原因③
 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是(2)
 晶体的晶胞形状为立方体,边长为anm,结构如图:
晶体的晶胞形状为立方体,边长为anm,结构如图:
①
 的配位数
的配位数②
 的摩尔质量为120
的摩尔质量为120 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,晶体的密度为
,晶体的密度为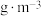 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】砷和镍是重要的材料和化工领域用途广泛。请回答下列问题:
(1)基态As原子中,价电子的电子云轮廓图形状为___ 。与砷同周期的主族元素的基态原子中,电负性最大的为____ (填元素符号)。
(2)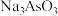 可用于碘的微量分析。
可用于碘的微量分析。
①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为_______ 。
②其中阴离子的VSEPR模型为_____ ,与其互为等电子体的分子为_____ (只写一种分子式即可)。
(3)M(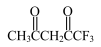 )可用于合成Ni2+的配体,M中C原子的杂化形式为
)可用于合成Ni2+的配体,M中C原子的杂化形式为______ ,σ键和π键的数目之比为_____ 。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为______ 。区分晶体Ni和非晶体Ni的最可靠的科学方法为_______ 。
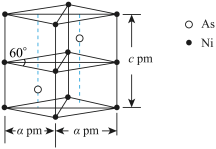
(5)某砷镍合金的晶胞如图所示,设阿伏加 德罗常数的值为 ,该晶体的密度ρ=
,该晶体的密度ρ=____ g·cm-3。
(1)基态As原子中,价电子的电子云轮廓图形状为
(2)
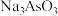 可用于碘的微量分析。
可用于碘的微量分析。①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为
②其中阴离子的VSEPR模型为
(3)M(
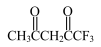 )可用于合成Ni2+的配体,M中C原子的杂化形式为
)可用于合成Ni2+的配体,M中C原子的杂化形式为(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为
(5)某砷镍合金的晶胞如图所示,设阿伏加 德罗常数的值为
 ,该晶体的密度ρ=
,该晶体的密度ρ=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】圆明园十二生肖兽首都是用铜质材料铸造而成的,我国铜的应用与冶炼由来已久,西汉刘安的《淮南万毕术》中有“曾青得铁则化为铜”,这是湿法治金的雏形。
(1)基态铁原子的电子排布式为___________ ;基态的 有
有___________ 个未成对电子。
(2)向硫酸铜溶液中滴加过量的氨水可形成 深蓝色溶液。
深蓝色溶液。
① 和
和 之间形成的化学键称为
之间形成的化学键称为___________ ,提供孤电子对的原子是___________ (填名称)。
② 中阴离子的立体构型是
中阴离子的立体构型是___________ 。
③氨的沸点___________ (填“高于”“低于”或“等于”)膦( )的,原因是
)的,原因是___________ ; 是
是___________ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___________ 。
(3)铁和铜都是___________ 晶体(填“离子”“分子”“原子”或“金属”); 的第三电离能(
的第三电离能( )、第四电离能(
)、第四电离能( )分别为
)分别为 、
、 ,
, 的原因是
的原因是___________ 。
(4)铜晶胞如图所示。已知: 代表阿伏加德罗常数的值,铜晶胞的密度为
代表阿伏加德罗常数的值,铜晶胞的密度为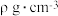 。
。

①铜原子半径为 ,则
,则
___________ 。
②铜晶胞的空间利用率为___________ 。(注明:晶胞的空间利用率 )
)
(1)基态铁原子的电子排布式为
 有
有(2)向硫酸铜溶液中滴加过量的氨水可形成
 深蓝色溶液。
深蓝色溶液。①
 和
和 之间形成的化学键称为
之间形成的化学键称为②
 中阴离子的立体构型是
中阴离子的立体构型是③氨的沸点
 )的,原因是
)的,原因是 是
是(3)铁和铜都是
 的第三电离能(
的第三电离能( )、第四电离能(
)、第四电离能( )分别为
)分别为 、
、 ,
, 的原因是
的原因是(4)铜晶胞如图所示。已知:
 代表阿伏加德罗常数的值,铜晶胞的密度为
代表阿伏加德罗常数的值,铜晶胞的密度为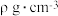 。
。
①铜原子半径为
 ,则
,则
②铜晶胞的空间利用率为
 )
)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】有X、Y、Z、W、R、Q为前四周期元素,原子序数依次增大。X、Y最外层电子排布可表示为asa,bsbbpb(a≠b),Y、Z、W是位于P区的同一周期的元素,Y与W原子核外的未成对电子数相等,RW2与ZW2-为等电子体,Q为过渡金属元素,其原子核外没有未成对电子。请回答下列问题:
(1)Q的最外层电子排布式为_________ ,RW2的分子立体构型是_________________
(2)Y、Z、W的最简单氢化物中,键角最小的是_______ (用分子式表示), YW与Z2互为等电子体,ZW的结构式为____________ (若有配位键,请用“→”表示)。
(3)ZX3可以与X+结合成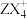 ,这个过程中发生改变的是
,这个过程中发生改变的是____ (填序号)。
a.微粒的空间构型 b.Z原子的杂化类型
c.X-Z-X的键角 d.微粒的电子数
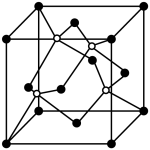
(4)QR在荧光体,光导体材料、涂料、颜料等行业中应用广泛。立方QR晶体结构如图所示,一个晶胞中含有的Q原子数为____________ 。与R原子最近且距离相等的R原子有_____ 个。该晶胞棱长与最近的两个R原子的距离之比为_______
(1)Q的最外层电子排布式为
(2)Y、Z、W的最简单氢化物中,键角最小的是
(3)ZX3可以与X+结合成
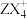 ,这个过程中发生改变的是
,这个过程中发生改变的是a.微粒的空间构型 b.Z原子的杂化类型
c.X-Z-X的键角 d.微粒的电子数
(4)QR在荧光体,光导体材料、涂料、颜料等行业中应用广泛。立方QR晶体结构如图所示,一个晶胞中含有的Q原子数为

您最近一年使用:0次



