黄铜矿的主要成份为 ,现有如下转化关系制备有关物质。
,现有如下转化关系制备有关物质。
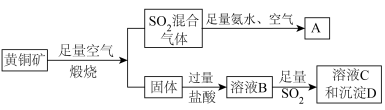
已知:沉淀D的摩尔质量为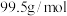 ,只含2种元素。忽略黄铜矿中其它杂质成分。请回答:
,只含2种元素。忽略黄铜矿中其它杂质成分。请回答:
(1) 被足量氨水充分吸收后,再通入足量空气可得到一种氮肥
被足量氨水充分吸收后,再通入足量空气可得到一种氮肥 ,请写出
,请写出 的化学式:
的化学式:______ 。
(2)判断溶液B中溶质为______ 。
(3)试写出生成沉淀D的离子反应方程式:______ 。
(4)请设计实验检验溶液C中的阳离子______ 。
 ,现有如下转化关系制备有关物质。
,现有如下转化关系制备有关物质。
已知:沉淀D的摩尔质量为
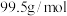 ,只含2种元素。忽略黄铜矿中其它杂质成分。请回答:
,只含2种元素。忽略黄铜矿中其它杂质成分。请回答:(1)
 被足量氨水充分吸收后,再通入足量空气可得到一种氮肥
被足量氨水充分吸收后,再通入足量空气可得到一种氮肥 ,请写出
,请写出 的化学式:
的化学式:(2)判断溶液B中溶质为
(3)试写出生成沉淀D的离子反应方程式:
(4)请设计实验检验溶液C中的阳离子
更新时间:2024-03-11 16:56:31
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
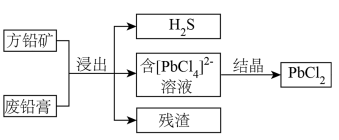
【推荐1】以方铅矿(主要含PbS、FeS)和废铅膏(主要含PbO2、PbO)为原料实现如下转化。 的形式浸出。
的形式浸出。
②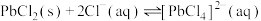

请回答:
(1)浸出过程中,发生了多个反应。请写出PbO2、PbS在盐酸和MgCl2溶液的作用下转化为 的离子方程式
的离子方程式___________ ;在浸出时,MgCl2的作用为___________ 。
(2)H2S气体主要是由___________ (填化学式)反应产生的,___________ (填“可以”、“不可以”)用CuSO4溶液吸收。
(3)下列说法正确的是___________。
(4)设计实验,验证结晶后过滤得到的滤液中含有Fe元素___________ 。
 的形式浸出。
的形式浸出。②
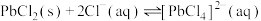

请回答:
(1)浸出过程中,发生了多个反应。请写出PbO2、PbS在盐酸和MgCl2溶液的作用下转化为
 的离子方程式
的离子方程式(2)H2S气体主要是由
(3)下列说法正确的是___________。
A.浸出产生的 最终氧化为 最终氧化为 存在于溶液中 存在于溶液中 |
B. 的空间构型是正四面体 的空间构型是正四面体 |
C.可以向含 的溶液中加入适量的冷水结晶获得PbCl2 的溶液中加入适量的冷水结晶获得PbCl2 |
| D.工业上主要通过电解熔融PbCl2制金属Pb |
(4)设计实验,验证结晶后过滤得到的滤液中含有Fe元素
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】白色固体碘化亚铜( )可用作树脂改性剂,不溶于水,能被
)可用作树脂改性剂,不溶于水,能被 氧化,见光易分解。实验室制备
氧化,见光易分解。实验室制备 的方法是向
的方法是向 和
和 混合溶液中通入足量
混合溶液中通入足量 ,实验装置如图所示(部分装置已省略)。请回答下列问题:
,实验装置如图所示(部分装置已省略)。请回答下列问题:
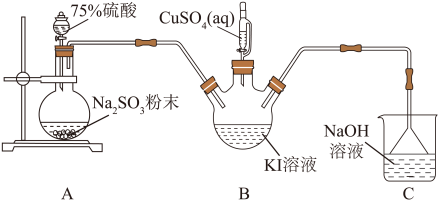
(1)装置A中发生反应的化学方程式为_______ 。
(2)装置B中发生反应的离子方程式是_______ 。
(3)盛放 溶液的仪器是
溶液的仪器是_______ ,C装置的作用是_______ 。
(4)实验结束后,装置B中物质经_______ 、洗涤、干燥,得到 固体,洗涤时用
固体,洗涤时用 溶液洗涤
溶液洗涤 的目的是
的目的是_______ ,再用无水乙醇洗涤。
(5)碘化亚铜能用于检测空气中的汞蒸气,其反应为 (玫瑰红)
(玫瑰红) 。产物
。产物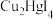 中,
中, 元素显
元素显_______ 价。当有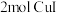 参与反应时,转移电子
参与反应时,转移电子_______ mol。
 )可用作树脂改性剂,不溶于水,能被
)可用作树脂改性剂,不溶于水,能被 氧化,见光易分解。实验室制备
氧化,见光易分解。实验室制备 的方法是向
的方法是向 和
和 混合溶液中通入足量
混合溶液中通入足量 ,实验装置如图所示(部分装置已省略)。请回答下列问题:
,实验装置如图所示(部分装置已省略)。请回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)装置B中发生反应的离子方程式是
(3)盛放
 溶液的仪器是
溶液的仪器是(4)实验结束后,装置B中物质经
 固体,洗涤时用
固体,洗涤时用 溶液洗涤
溶液洗涤 的目的是
的目的是(5)碘化亚铜能用于检测空气中的汞蒸气,其反应为
 (玫瑰红)
(玫瑰红) 。产物
。产物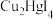 中,
中, 元素显
元素显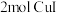 参与反应时,转移电子
参与反应时,转移电子
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如图:
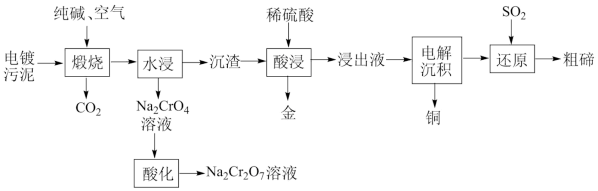
已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2=2CuO+TeO2
(1)Te元素在元素周期表中的位置为___ 。
(2)煅烧时,Cr2O3发生反应的化学方程式为___ 。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有___ (填化学式)。电解沉积过程中析出单质铜的电极为__ 极。
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
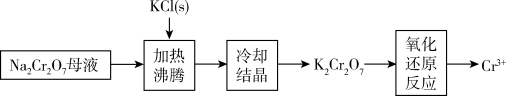
通过冷却结晶能析出大量K2Cr2O7的原因是___ 。
(5)测定产品中K2Cr2O7含量的方法如下:称取试样2.5g配成250mL溶液,取25.00mL置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol/L(NH4)2Fe(SO4)2标准液进行滴定。滴定过程中发生反应的离子方程式为___ 。若三次实验消耗(NH4)2Fe(SO4)2标准液的体积平均为25.00mL,则所得产品中K2Cr2O7的纯度为___ (保留三位有效数字)。

已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2=2CuO+TeO2
(1)Te元素在元素周期表中的位置为
(2)煅烧时,Cr2O3发生反应的化学方程式为
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:

通过冷却结晶能析出大量K2Cr2O7的原因是
(5)测定产品中K2Cr2O7含量的方法如下:称取试样2.5g配成250mL溶液,取25.00mL置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol/L(NH4)2Fe(SO4)2标准液进行滴定。滴定过程中发生反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】固体化合物 在太阳能电池领域有重要用途。为探究
在太阳能电池领域有重要用途。为探究 的组成(仅含两种元素,摩尔质量小于
的组成(仅含两种元素,摩尔质量小于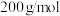 ),某研究性小组设计并完成如下实验:
),某研究性小组设计并完成如下实验:
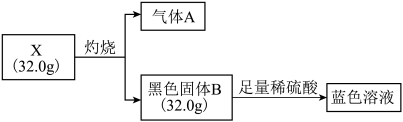
已知:气体 ,固体
,固体 均为常见氧化物,且气体
均为常见氧化物,且气体 能使品红溶液褪色。请回答:
能使品红溶液褪色。请回答:
(1) 的组成元素为
的组成元素为_____________ (用元素符号表示)。
(2)写出固体 与足量稀硫酸反应的离子方程式
与足量稀硫酸反应的离子方程式____________________________________ 。
(3)写出 在空气中灼烧的化学方程式
在空气中灼烧的化学方程式____________________________________________ 。
 在太阳能电池领域有重要用途。为探究
在太阳能电池领域有重要用途。为探究 的组成(仅含两种元素,摩尔质量小于
的组成(仅含两种元素,摩尔质量小于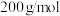 ),某研究性小组设计并完成如下实验:
),某研究性小组设计并完成如下实验:
已知:气体
 ,固体
,固体 均为常见氧化物,且气体
均为常见氧化物,且气体 能使品红溶液褪色。请回答:
能使品红溶液褪色。请回答:(1)
 的组成元素为
的组成元素为(2)写出固体
 与足量稀硫酸反应的离子方程式
与足量稀硫酸反应的离子方程式(3)写出
 在空气中灼烧的化学方程式
在空气中灼烧的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的最低负化合价为-2。回答下列问题:
(1)Y-的结构示意图为____________ 。
(2)写出含有10个中子的X原子的原子符号_____________ 。
(3)Z的最高价氧化物与Z同主族的单质A能发生置换反应,这个反应在工业上是获得Z的一步重要反应。写出该步反应的化学方程式,并用单线桥法标出电子转移的方向与数目________________ 。
(4)向WX2溶液中加入足量的NaOH溶液,反应的离子方程式为___________ 。
(5)Y的气态氢化物与氨气在空气中相遇有白烟生成,该反应的化学方程式为_____________ 。
(6)ZX2与NaOH溶液反应的化学方程式为_____________________ 。
(1)Y-的结构示意图为
(2)写出含有10个中子的X原子的原子符号
(3)Z的最高价氧化物与Z同主族的单质A能发生置换反应,这个反应在工业上是获得Z的一步重要反应。写出该步反应的化学方程式,并用单线桥法标出电子转移的方向与数目
(4)向WX2溶液中加入足量的NaOH溶液,反应的离子方程式为
(5)Y的气态氢化物与氨气在空气中相遇有白烟生成,该反应的化学方程式为
(6)ZX2与NaOH溶液反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】I.为观察铜和浓硫酸的反应现象并探究SO2与Fe3+之间的氧化还原反应,某化学兴趣小组按下图装置进行实验(夹持、加热仪器已略去)。同学们查阅资料后了解,浓硫酸(常规质量分数为98.3%,密度为1.84 g/cm3)的沸点为338℃,加热过程中可能产生酸雾。请回答下列问题:
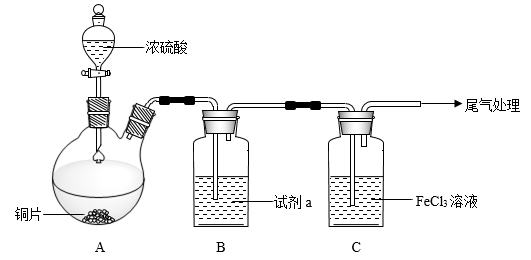
(1)搭建好实验装置后,紧接着要进行的一步操作是_____ ;试剂a是______ ;
(2)写出装置A中反应的化学方程式______ ;
(3)对于上述实验描述正确的是_____(填序号);
(4)SO2气体通入C装置充分反应,请设计实验证明氧化产物中阴离子的存在_____ 。
II.我国国家标准规定葡萄酒中的最大使用量为0.25 g/L。该小组测定某干白葡萄酒中的的含量(以游离计),将200 mL葡萄酒和足量盐酸共热,使全部逸出并与H2O2完全反应,除去过量的H2O2后,与0.0600 mol/LNaOH标准溶液反应,恰好消耗NaOH溶液20.00 mL,请回答:
(5)该葡萄酒中SO2的含量为_____ 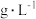 ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是______ 。

(1)搭建好实验装置后,紧接着要进行的一步操作是
(2)写出装置A中反应的化学方程式
(3)对于上述实验描述正确的是_____(填序号);

| A.在加热条件下充分反应,A装置烧瓶中溶液呈蓝色 |
| B.C中溶液酸性增强,说明SO2与Fe3+之间发生了氧化还原反应 |
| C.向C中加入几滴KMnO4溶液,紫红色褪去,说明C溶液中生成了Fe2+ |
| D.尾气处理可以选择如上图装置 |
II.我国国家标准规定葡萄酒中的最大使用量为0.25 g/L。该小组测定某干白葡萄酒中的的含量(以游离计),将200 mL葡萄酒和足量盐酸共热,使全部逸出并与H2O2完全反应,除去过量的H2O2后,与0.0600 mol/LNaOH标准溶液反应,恰好消耗NaOH溶液20.00 mL,请回答:
(5)该葡萄酒中SO2的含量为
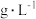 ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】(1)某无色透明溶液可能存在Na+、Fe3+、Ba2+、NO3-、CO32-、HCO3-、SO42-中的几种离子,现有如下操作:
Ⅰ.取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体。
Ⅱ.另取该溶液滴加一定量的NaOH溶液有白色沉淀生成。
试回答下列问题:
①该溶液中一定存在的离子有__________,一定不存在的离子__________。
②用一个离子方程式表示操作②的实验现象:________________________。
(2)下列各项中的两种物质在溶液中的反应,可用同一离子方程式表示的是( ),请写出该离子反应方程式: ____________________________。
A.盐酸和烧碱溶液、硫酸和氢氧化钡溶液
B.纯碱溶液和盐酸、石灰石和硫酸
C.氯化钡溶液和硫酸钠溶液、硝酸钡溶液和硫酸
D.碳酸铵溶液和氢氧化钠溶液、碳酸铵溶液和氢氧化钙溶液
Ⅰ.取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体。
Ⅱ.另取该溶液滴加一定量的NaOH溶液有白色沉淀生成。
试回答下列问题:
①该溶液中一定存在的离子有__________,一定不存在的离子__________。
②用一个离子方程式表示操作②的实验现象:________________________。
(2)下列各项中的两种物质在溶液中的反应,可用同一离子方程式表示的是( ),请写出该离子反应方程式: ____________________________。
A.盐酸和烧碱溶液、硫酸和氢氧化钡溶液
B.纯碱溶液和盐酸、石灰石和硫酸
C.氯化钡溶液和硫酸钠溶液、硝酸钡溶液和硫酸
D.碳酸铵溶液和氢氧化钠溶液、碳酸铵溶液和氢氧化钙溶液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】化学小组通过下列步骤测定某工厂废液中铜离子的浓度(已知废水中Fe3+对测定有干扰作用)。
i. 经检验废液中含有Fe3+离子,取V1 mL上述废液,加入NH4HF2,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+离子;
ii. 在上述溶液中,加入过量KI溶液,放置3 min,有沉淀CuI生成,立即用0.1000 mol/LNa2S2O3标准溶液滴定至浅黄色,加3 mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10 mL,继续滴定至终点,共消耗Na2S2O3溶液V2 mL。
已知:①CuI、CuSCN均为白色难溶物,CuI能吸附少量I2,CuSCN不吸附I2。
②I2在水溶液中溶解度较小,I-+I2 I3-、I-、I2、I3-的平衡体系溶液呈黄色
I3-、I-、I2、I3-的平衡体系溶液呈黄色
③I2+2S2O32-=2I-+S4O62-,S2O32-和S4O62-无色;
(1)①步骤i中检验含Fe3+离子操作和现象_______ 。
②已知 Fe3++6F- [FeF6]3-,如果省略步骤i,则导致实验结果
[FeF6]3-,如果省略步骤i,则导致实验结果________ (填“偏大”或 “偏小” ) 。
(2)①步骤ii中生成沉淀的离子方程式_____________ 。
②步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是__________ 。
(3)①步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是___________ 。
②步骤iii中判定滴定终点的现象是_____________ 。
(4)经小组测定,废液中c(Cu2+)=______________ 。
i. 经检验废液中含有Fe3+离子,取V1 mL上述废液,加入NH4HF2,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+离子;
ii. 在上述溶液中,加入过量KI溶液,放置3 min,有沉淀CuI生成,立即用0.1000 mol/LNa2S2O3标准溶液滴定至浅黄色,加3 mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10 mL,继续滴定至终点,共消耗Na2S2O3溶液V2 mL。
已知:①CuI、CuSCN均为白色难溶物,CuI能吸附少量I2,CuSCN不吸附I2。
②I2在水溶液中溶解度较小,I-+I2
 I3-、I-、I2、I3-的平衡体系溶液呈黄色
I3-、I-、I2、I3-的平衡体系溶液呈黄色③I2+2S2O32-=2I-+S4O62-,S2O32-和S4O62-无色;
(1)①步骤i中检验含Fe3+离子操作和现象
②已知 Fe3++6F-
 [FeF6]3-,如果省略步骤i,则导致实验结果
[FeF6]3-,如果省略步骤i,则导致实验结果(2)①步骤ii中生成沉淀的离子方程式
②步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是
(3)①步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是
②步骤iii中判定滴定终点的现象是
(4)经小组测定,废液中c(Cu2+)=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】某溶液A中可能含有NO3-、CO32-、SO32-、SO42-、NH4+、Fe2+、Al3+、Fe3+中的几种离子,且溶液中各离子的物质的量浓度均为0.1 mol/L。现取100 mL该溶液A进行如下实验:
实验1:向该溶液中逐滴滴入过量的(NH4)2CO3溶液,产生白色沉淀B,并有无色气泡产生。
实验2:静置后,再向溶液中加入过量Ba(OH)2溶液,加热,仍然存在白色沉淀C,并有无色气泡产生。
实验3:静置后,继续向溶液中加入Cu片和过量的盐酸,仍然存在白色沉淀D,溶液变蓝色,并有气泡E产生。
(1)白色沉淀C的成分为________ (填化学式);气体E的成分为______ (写名称)。
(2)实验1中发生反应的离子方程式为______________ 。
(3)实验3中发生所有反应的离子方程式为__________ 。
(4)溶液A中__________ (填“一定”“可能”或“一定不”)存在NH4+,理由是_________ 。
实验1:向该溶液中逐滴滴入过量的(NH4)2CO3溶液,产生白色沉淀B,并有无色气泡产生。
实验2:静置后,再向溶液中加入过量Ba(OH)2溶液,加热,仍然存在白色沉淀C,并有无色气泡产生。
实验3:静置后,继续向溶液中加入Cu片和过量的盐酸,仍然存在白色沉淀D,溶液变蓝色,并有气泡E产生。
(1)白色沉淀C的成分为
(2)实验1中发生反应的离子方程式为
(3)实验3中发生所有反应的离子方程式为
(4)溶液A中
您最近一年使用:0次



