K2Cr2O7溶液中存在平衡: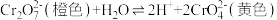 。
。
(1)向2mL0.1mol/LK2Cr2O7溶液中滴加5滴6mol/LNaOH溶液。可观察到的现象是_______ ;得出的结论是:_______ 。
(2)向上述溶液中再滴加10滴6mol/LH2SO4溶液。可观察到的现象是_______ ;得出的结论是_______ 。
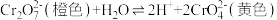 。
。(1)向2mL0.1mol/LK2Cr2O7溶液中滴加5滴6mol/LNaOH溶液。可观察到的现象是
(2)向上述溶液中再滴加10滴6mol/LH2SO4溶液。可观察到的现象是
更新时间:2024-03-15 08:03:20
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________ 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl_______ P2;A、B、C三点处对应平衡常数(KA、KB、KC)的由大到小的顺序为__________ 。(填“<”、“>”“=”)
②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=________________ 100℃时该反应的平衡常数K =_________ 。反应达到平衡的标志是:_____________ 。
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________ (填编号)。
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)
 CO(g)+ 3H2(g)
CO(g)+ 3H2(g)①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl

②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H= +7 kJ·mol−1
H2S(g)+CO(g) △H= +7 kJ·mol−1
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H=−42kJ·mol−1
CO2(g)+H2(g) △H=−42kJ·mol−1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
(1)计算表中x=_______ 。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______ (保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1mol H2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______ (填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______ (填“增大”、“减小”或“不变”),其理由是_______ 。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
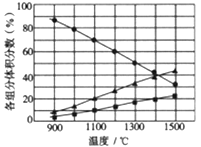
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S 分解反应的主要化学方程式为_______ ;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______ 。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L−1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______ 。 (已知:25 ℃时,Ksp(SnS)= 1.0×10−25,Ksp(Ag2S)=1.6×10−49)。
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)
 H2S(g)+CO(g) △H= +7 kJ·mol−1
H2S(g)+CO(g) △H= +7 kJ·mol−1ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) △H=−42kJ·mol−1
CO2(g)+H2(g) △H=−42kJ·mol−1已知断裂1mol气态分子中的化学键所需能量如下表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
| 能量(kJ·mol−1) | 1310 | 442 | x | 669 |
(1)计算表中x=
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=
②上述反应达平衡后,若向其中再充入1mol COS(g)、1mol H2(g)和1mol H2O(g),则再次达平衡后H2的体积分数
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S 分解反应的主要化学方程式为

Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L−1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】已知:I.CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
II.CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
III.CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
如图为一定比例的CO2、H2;CO、H2;CO、CO2、H2三个反应体系下甲醇生成速率与温度的关系。

490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,结合反应I、III分析原因:_______ 。
 CO2(g)+H2(g)
CO2(g)+H2(g)II.CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)III.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)如图为一定比例的CO2、H2;CO、H2;CO、CO2、H2三个反应体系下甲醇生成速率与温度的关系。

490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,结合反应I、III分析原因:
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】硫及其化合物在生产生活中有广泛的应用。请回答:
(1)室温下, 溶液呈碱性的原因是
溶液呈碱性的原因是___________ (用离子方程式表示)。
(2)下列关于硫及其化合物的说法,正确的是___________(填字母)。
(3)光谱研究表明, 的水溶液中存在下列平衡:
的水溶液中存在下列平衡:
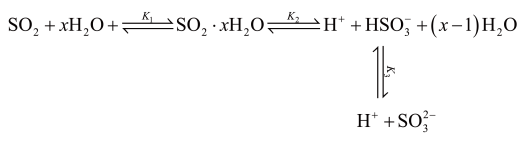
其中 为各步的平衡常数,且
为各步的平衡常数,且 (
( 表示
表示 的平衡压强)。
的平衡压强)。
①当 的平衡压强为
的平衡压强为 时,测得
时,测得 ,则溶液的
,则溶液的
___________  。(用含
。(用含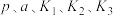 的式子表示)
的式子表示)
②滴加 至
至 时,溶液中
时,溶液中 。如果溶液中
。如果溶液中 ,需加
,需加 将溶液
将溶液 调整为约等于
调整为约等于___________ 。
(4)“钙基固硫”是利用石灰石将燃煤烟气中的 转化为
转化为 。但高温时
。但高温时 会与
会与 反应而影响脱硫效率。相关反应如下:
反应而影响脱硫效率。相关反应如下:
Ⅰ.
Ⅱ.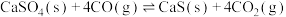
当 时,反应
时,反应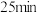 ,体系中
,体系中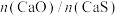 的比值随温度变化如下表所示:
的比值随温度变化如下表所示:
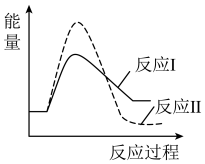
请结合题给反应过程能量图说明, 时,比值随温度升高逐渐减小的原因是
时,比值随温度升高逐渐减小的原因是______ 。
(5)氨水也可吸收 :
: ,
,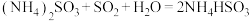 。能提高
。能提高 去除率的措施有___________(填字母)。
去除率的措施有___________(填字母)。
(1)室温下,
 溶液呈碱性的原因是
溶液呈碱性的原因是(2)下列关于硫及其化合物的说法,正确的是___________(填字母)。
| A.硫元素在自然界中只能以化合态形式存在 |
B. 通入紫色石蕊试液,溶液先变红后褪色 通入紫色石蕊试液,溶液先变红后褪色 |
C.酸雨是 的降水,主要是由污染物 的降水,主要是由污染物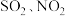 造成 造成 |
| D.浓硫酸中加入少量胆矾晶体,搅拌,固体逐渐变成白色 |
 的水溶液中存在下列平衡:
的水溶液中存在下列平衡: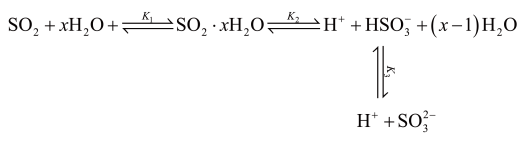
其中
 为各步的平衡常数,且
为各步的平衡常数,且 (
( 表示
表示 的平衡压强)。
的平衡压强)。①当
 的平衡压强为
的平衡压强为 时,测得
时,测得 ,则溶液的
,则溶液的
 。(用含
。(用含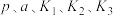 的式子表示)
的式子表示)②滴加
 至
至 时,溶液中
时,溶液中 。如果溶液中
。如果溶液中 ,需加
,需加 将溶液
将溶液 调整为约等于
调整为约等于(4)“钙基固硫”是利用石灰石将燃煤烟气中的
 转化为
转化为 。但高温时
。但高温时 会与
会与 反应而影响脱硫效率。相关反应如下:
反应而影响脱硫效率。相关反应如下:Ⅰ.

Ⅱ.
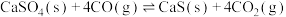

当
 时,反应
时,反应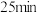 ,体系中
,体系中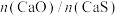 的比值随温度变化如下表所示:
的比值随温度变化如下表所示:| 温度 | 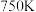 |  |  |
| 比值 | 3.57 | 1.08 | 3.42 |
 时,比值随温度升高逐渐减小的原因是
时,比值随温度升高逐渐减小的原因是(5)氨水也可吸收
 :
: ,
,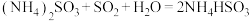 。能提高
。能提高 去除率的措施有___________(填字母)。
去除率的措施有___________(填字母)。| A.增大氨水浓度 | B.加热煮沸 |
| C.降低烟气的流速 | D.补充 ,将 ,将 氧化为 氧化为 |
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】I.现有下列物质①熔化的NaCl②盐酸③氯气④冰醋酸⑤铜⑥酒精⑦硫酸氢钠⑧液氨⑨SO2⑩Al2O3,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
II.工业合成氨N2(g)+3H2(g) 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
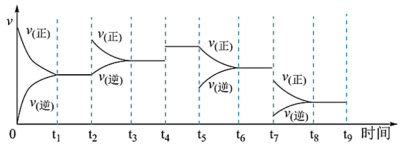
(4)其中 t4时刻所对应的实验条件改变是_____ ,t5时刻所对应的实验条件改变是_____ ,平衡常数最大的时间段是_____ 。
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
(6)实际生产中一般采用的反应条件为400~500℃,原因是_______ 。
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于非电解质,但溶于水后的水溶液能导电的是
II.工业合成氨N2(g)+3H2(g)
 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
(4)其中 t4时刻所对应的实验条件改变是
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】某班级同学查阅资料,对Na2S有了一定的认识,并提出了以下几个问题,请回答:
(1)1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应达到平衡:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
向容器中分别加入以下物质,判断对平衡有无影响,有影响的填写出平衡移动的方向。
①加入Na2SO4_____ 。②加入焦炭___________ 。
(2)向Na2S的浓溶液中逐滴加入稀盐酸,直到不再生成H2S气体为止,则在此过程中,溶液的c(HS-)变化趋势可能是___ 。
a.逐渐减小 b.逐渐增大
c.先逐渐增大,而后减小 d.先逐渐减小,而后增大
(3)Na2S溶液与下列溶液混合,不能发生反应的是____ 。
①H2S ②SO2 ③Na2SO3 ④酸性KMnO4溶液 ⑤CuSO4 ⑥氯水
(4)写出Na2S和AlCl3溶液反应的离子方程式____________ 。
(1)1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应达到平衡:
Na2SO4(s)+4H2(g)
 Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:向容器中分别加入以下物质,判断对平衡有无影响,有影响的填写出平衡移动的方向。
①加入Na2SO4
(2)向Na2S的浓溶液中逐滴加入稀盐酸,直到不再生成H2S气体为止,则在此过程中,溶液的c(HS-)变化趋势可能是
a.逐渐减小 b.逐渐增大
c.先逐渐增大,而后减小 d.先逐渐减小,而后增大
(3)Na2S溶液与下列溶液混合,不能发生反应的是
①H2S ②SO2 ③Na2SO3 ④酸性KMnO4溶液 ⑤CuSO4 ⑥氯水
(4)写出Na2S和AlCl3溶液反应的离子方程式
您最近半年使用:0次



