利用水煤气合成甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH1=−90.8kJ·mol−1
CH3OH(g) ΔH1=−90.8kJ·mol−1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=−23.5kJ·mol−1
CH3OCH3(g)+H2O(g) ΔH2=−23.5kJ·mol−1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=−41.2kJ·mol−1
CO2(g)+H2(g) ΔH3=−41.2kJ·mol−1
(1)总反应:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g) ΔH=
CH3OCH3(g)+CO2(g) ΔH=(2)一定条件下,起始浓度分别为c(CO)=0.6mol·L−1、c(H2)=1.4mol·L−1,8min后反应①达到化学平衡,CO的平衡转化率为50%,则8min内H2的平均反应速率为
(3)一定温度下,在恒容密闭容器中发生反应②,当容器内气体的总压强不再变化时。下列说法正确的是_____。
| A.该反应可能处于化学平衡状态 |
| B.正、逆反应速率一定相等 |
| C.CH3OH全部转化为CH3OCH3和H2O |
| D.CH3OH、CH3OCH3、H2O的浓度一定相等 |
物质 | CH3OH | CH3OCH3 |
c/mol·L−1 | 0.44 | 0.60 |
比较此时正、逆反应速率的大小
A。υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
判断依据为
更新时间:2024-03-28 20:15:20
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。

请回答下列问题:
(1)上述脱硫过程实现了________ (填字母)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
D.获得金属单质
(2)已知:25 ℃、101 kPa时, Mn(s)+O2(g)===MnO2(s)ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是_____________________ 。
(3)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如图所示。

①a应与直流电源的________ (填“正”或“负”)极相连。
②电解过程中氢离子的作用是____________________________ ;
③阳极的电极反应反应方程式为:______________ 若转移的电子数为6.02×1023,左室溶液中n(H+)的变化量为________ 。

请回答下列问题:
(1)上述脱硫过程实现了
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
D.获得金属单质
(2)已知:25 ℃、101 kPa时, Mn(s)+O2(g)===MnO2(s)ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是
(3)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如图所示。

①a应与直流电源的
②电解过程中氢离子的作用是
③阳极的电极反应反应方程式为:
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】将 转化为
转化为 等燃料是有效的减排手段.已知
等燃料是有效的减排手段.已知 与
与 在倠化剂作用下合成甲醇的主要反应如下:
在倠化剂作用下合成甲醇的主要反应如下:
①
②
(1)反应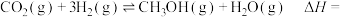
__________  .
.
(2)若反应②正反应的活化能为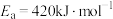 .则其逆反应的活化能
.则其逆反应的活化能
__________  .
.
(3) 与
与 在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
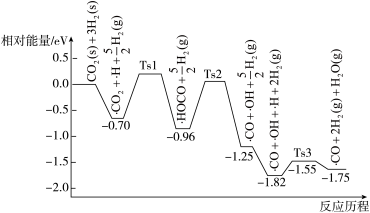
该反应历程中决速步骤的化学方程式为________________ .
(4)在一体积为3 L的恒容密闭容器内充入 和
和 发生反应
发生反应 .测得反应过程中
.测得反应过程中 的平衡转化率
的平衡转化率 与温度和压强的关系如图所示。
与温度和压强的关系如图所示。

①X表示____________ (填“温度”或“压强”)。
②
______________ (填“>”、“<”或“=”,下同) ,反应速率
,反应速率
____________ 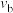 。
。
③a、b、c三点的平衡常数由大到小的顺序是____________ 。
④b点所处状态下的平衡常数
____________ 。
 转化为
转化为 等燃料是有效的减排手段.已知
等燃料是有效的减排手段.已知 与
与 在倠化剂作用下合成甲醇的主要反应如下:
在倠化剂作用下合成甲醇的主要反应如下:①

②

(1)反应
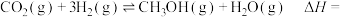
 .
.(2)若反应②正反应的活化能为
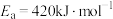 .则其逆反应的活化能
.则其逆反应的活化能
 .
.(3)
 与
与 在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
该反应历程中决速步骤的化学方程式为
(4)在一体积为3 L的恒容密闭容器内充入
 和
和 发生反应
发生反应 .测得反应过程中
.测得反应过程中 的平衡转化率
的平衡转化率 与温度和压强的关系如图所示。
与温度和压强的关系如图所示。
①X表示
②

 ,反应速率
,反应速率
 。
。③a、b、c三点的平衡常数由大到小的顺序是
④b点所处状态下的平衡常数

您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】由某精矿石(MCO3·ZCO3)可以制备单质M,制备过程中排放出的二氧化碳可以作为原料制备甲醇。取该矿石样品1.84 g,高温灼烧至恒重,得到0.96 g仅含两种金属氧化物的固体,其中m(M)∶m(Z)=3∶5。请回答:
(1)该矿石的化学式为_______ 。
(2)①以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2∶1)。写出该反应的化学方程式_______ 。
②单质M还可以通过电解熔融MCl2得到。不能用电解MCl2溶液的方法制备M的理由是_______ 。
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g) ⇌CO(g)+H2O(g) ΔH1
反应2:CO(g)+2H2(g) ⇌CH3OH(g) ΔH2
反应3:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图l所示。则ΔH2_______ ΔH3(填“大于”、“小于”或“等于”),理由是_______ 。
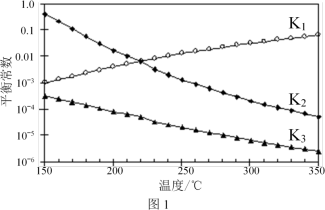
(4)在温度T1时,使体积比为3∶1的H2和CO2在体积恒定的密闭容器内进行反应。T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。试在图中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线______ 。
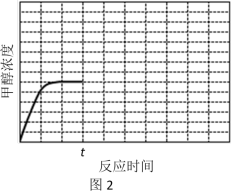
(1)该矿石的化学式为
(2)①以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2∶1)。写出该反应的化学方程式
②单质M还可以通过电解熔融MCl2得到。不能用电解MCl2溶液的方法制备M的理由是
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g) ⇌CO(g)+H2O(g) ΔH1
反应2:CO(g)+2H2(g) ⇌CH3OH(g) ΔH2
反应3:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图l所示。则ΔH2

(4)在温度T1时,使体积比为3∶1的H2和CO2在体积恒定的密闭容器内进行反应。T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。试在图中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线

您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】综合利用 、
、 对构建低碳社会有重要意义。
对构建低碳社会有重要意义。
(1)利用 与
与 制备合成气CO、
制备合成气CO、 ,可能的反应历程如图所示:
,可能的反应历程如图所示:
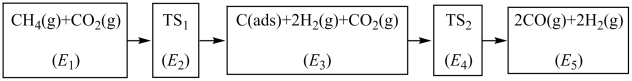
说明: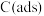 为吸附性活性炭,E表示方框中物质的总能量(单位:
为吸附性活性炭,E表示方框中物质的总能量(单位: ),
), 表示过渡态。
表示过渡态。
①制备合成气 、
、 总反应的热化学方程式为
总反应的热化学方程式为_______ 。
②若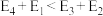 ,则决定制备“合成气”反应速率的化学方程式
,则决定制备“合成气”反应速率的化学方程式_______ 。
(2)工业上常采用 和
和 为原料合成乙醇,反应方程式为:
为原料合成乙醇,反应方程式为: .一定温度下,向容积均为
.一定温度下,向容积均为 的恒容密闭容器中分别通入
的恒容密闭容器中分别通入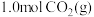 和
和 ,在不同催化剂X、Y的催化下发生反应.测得
,在不同催化剂X、Y的催化下发生反应.测得 时,
时, 转化率与温度的变化关系如图所示。
转化率与温度的变化关系如图所示。
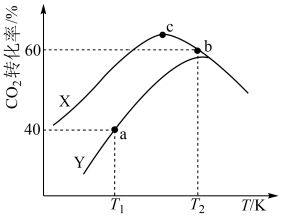
①该反应适宜选用的催化剂为_______ (填“X”或“Y”)。
② 时,a点对应容器在
时,a点对应容器在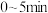 内的平均反应速率
内的平均反应速率
_______ ;b、c点对应状态下反应物的有效碰撞几率b_______ c(填“>”“<”或“=”),原因为_______ 。
③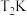 时,保持温度不变向容器中再充入
时,保持温度不变向容器中再充入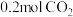 、
、 ,平衡将
,平衡将_______ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(3)随着科学技术的发展, 的捕集利用技术成为研究重点,
的捕集利用技术成为研究重点, 可以被
可以被 溶液捕获,所得溶液
溶液捕获,所得溶液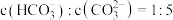 ,该溶液的
,该溶液的
_______ 。[已知室温下, ,
,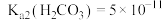 ]
]
 、
、 对构建低碳社会有重要意义。
对构建低碳社会有重要意义。(1)利用
 与
与 制备合成气CO、
制备合成气CO、 ,可能的反应历程如图所示:
,可能的反应历程如图所示: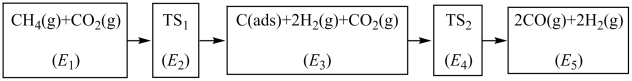
说明:
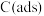 为吸附性活性炭,E表示方框中物质的总能量(单位:
为吸附性活性炭,E表示方框中物质的总能量(单位: ),
), 表示过渡态。
表示过渡态。①制备合成气
 、
、 总反应的热化学方程式为
总反应的热化学方程式为②若
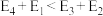 ,则决定制备“合成气”反应速率的化学方程式
,则决定制备“合成气”反应速率的化学方程式(2)工业上常采用
 和
和 为原料合成乙醇,反应方程式为:
为原料合成乙醇,反应方程式为: .一定温度下,向容积均为
.一定温度下,向容积均为 的恒容密闭容器中分别通入
的恒容密闭容器中分别通入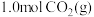 和
和 ,在不同催化剂X、Y的催化下发生反应.测得
,在不同催化剂X、Y的催化下发生反应.测得 时,
时, 转化率与温度的变化关系如图所示。
转化率与温度的变化关系如图所示。
①该反应适宜选用的催化剂为
②
 时,a点对应容器在
时,a点对应容器在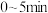 内的平均反应速率
内的平均反应速率
③
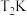 时,保持温度不变向容器中再充入
时,保持温度不变向容器中再充入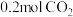 、
、 ,平衡将
,平衡将(3)随着科学技术的发展,
 的捕集利用技术成为研究重点,
的捕集利用技术成为研究重点, 可以被
可以被 溶液捕获,所得溶液
溶液捕获,所得溶液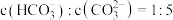 ,该溶液的
,该溶液的
 ,
,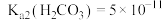 ]
]
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】(1)在一定条件下,体积为2L的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
① 3min内用N2表示的化学反应速率为____________ 。②H2的转化率是____________ 。
(2)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
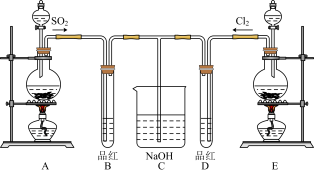
a.实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为
MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为____________ ;
b.①反应开始一段时间后,观察到D试管中的品红溶液出现的现象是:
D:_____________________________________________________________ 。
②停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:____________________________________ ,D:________________________________ 。
c.另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_______________________________ 。
 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:① 3min内用N2表示的化学反应速率为
(2)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

a.实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为
MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为b.①反应开始一段时间后,观察到D试管中的品红溶液出现的现象是:
D:
②停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:
c.另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题。
Ⅰ.已知
 。一定温度下,向容积为2L的容器中充入
。一定温度下,向容积为2L的容器中充入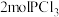 和
和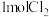 ,一段时间后反应达到平衡状态,不同时刻容器中
,一段时间后反应达到平衡状态,不同时刻容器中 的物质的量如表所示:
的物质的量如表所示:
(1)0~50s内 的平均反应速率为
的平均反应速率为___________ (用科学计数法表示)。
(2)该温度下,反应的平衡常数为___________ (用分数表示)。
(3)在起始温度相同时,在甲、乙(容积均为2L)两个容器中发生反应: 甲容器为绝热容器,乙容器为恒温容器且各反应物起始物质的量相同,反应一段时间后,相对于乙容器而言,甲容器中
甲容器为绝热容器,乙容器为恒温容器且各反应物起始物质的量相同,反应一段时间后,相对于乙容器而言,甲容器中 的浓度迅速减小的原因是
的浓度迅速减小的原因是___________ 。
Ⅱ.PAFC{聚合碱式氯化铝铁,通式: }是一种新型的无机高分子絮凝剂。以高铁铝土矿、硫酸厂渣尘(主要成分:
}是一种新型的无机高分子絮凝剂。以高铁铝土矿、硫酸厂渣尘(主要成分: 、
、 ,杂质FeO、
,杂质FeO、 等)为原料制取PAFC的实验流程如下:
等)为原料制取PAFC的实验流程如下:___________ (举一例)。
(5)滤渣1的主要成分为___________ (填化学式)。
(6)“氧化”时, 氧化
氧化 ,本身被还原为
,本身被还原为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
Ⅰ.已知

 。一定温度下,向容积为2L的容器中充入
。一定温度下,向容积为2L的容器中充入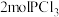 和
和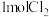 ,一段时间后反应达到平衡状态,不同时刻容器中
,一段时间后反应达到平衡状态,不同时刻容器中 的物质的量如表所示:
的物质的量如表所示: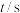 | 0 | 50 | 150 | 250 | 350 |
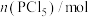 | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50s内
 的平均反应速率为
的平均反应速率为(2)该温度下,反应的平衡常数为
(3)在起始温度相同时,在甲、乙(容积均为2L)两个容器中发生反应:
 甲容器为绝热容器,乙容器为恒温容器且各反应物起始物质的量相同,反应一段时间后,相对于乙容器而言,甲容器中
甲容器为绝热容器,乙容器为恒温容器且各反应物起始物质的量相同,反应一段时间后,相对于乙容器而言,甲容器中 的浓度迅速减小的原因是
的浓度迅速减小的原因是Ⅱ.PAFC{聚合碱式氯化铝铁,通式:
 }是一种新型的无机高分子絮凝剂。以高铁铝土矿、硫酸厂渣尘(主要成分:
}是一种新型的无机高分子絮凝剂。以高铁铝土矿、硫酸厂渣尘(主要成分: 、
、 ,杂质FeO、
,杂质FeO、 等)为原料制取PAFC的实验流程如下:
等)为原料制取PAFC的实验流程如下:
(5)滤渣1的主要成分为
(6)“氧化”时,
 氧化
氧化 ,本身被还原为
,本身被还原为 ,该反应的离子方程式为
,该反应的离子方程式为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(固)+dD,当反应进行了一定时间后,测得A减少n mol,B减少了
cC(固)+dD,当反应进行了一定时间后,测得A减少n mol,B减少了 mol,C增加了
mol,C增加了 mol,D增加了n mol,此时达到化学平衡:
mol,D增加了n mol,此时达到化学平衡:
(1)该化学方程式中各物质的系数为:a=___________ ,b=___________ ,c=___________ ,d=___________ ;
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A___________ 、B___________ 、D___________ ;
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应的正反应为___________ 反应(填“放热”或“吸热”)。接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g) 2SO3(g)+190kJ
2SO3(g)+190kJ
(4)该反应所用的催化剂是___________ (填写化合物名称),该反应450℃时的平衡常数___________ 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(5)下列能表示反应已达到化学平衡状态的是
(6)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(O2)=___________ mol/(L·min);若继续通入0.20mol SO2和0.10mol O2,则平衡___________ 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,___________ mol<n(SO3)<___________ mol。
 cC(固)+dD,当反应进行了一定时间后,测得A减少n mol,B减少了
cC(固)+dD,当反应进行了一定时间后,测得A减少n mol,B减少了 mol,C增加了
mol,C增加了 mol,D增加了n mol,此时达到化学平衡:
mol,D增加了n mol,此时达到化学平衡:(1)该化学方程式中各物质的系数为:a=
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应的正反应为
 2SO3(g)+190kJ
2SO3(g)+190kJ(4)该反应所用的催化剂是
(5)下列能表示反应已达到化学平衡状态的是
| A.v(O2)正=2v(SO3)逆 |
| B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
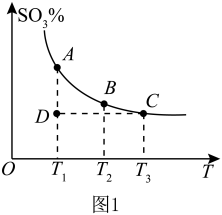
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___ (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正___ (填“>”“<”或“=”)v逆。
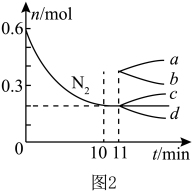
(2)已知N2(g)+3H2(g) 2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=
2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__ 。从第11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___ (填编号)。
(3)298K时,将20mL3xmol·L-1 Na3AsO3、20mL3xmol·L-1I2和20 mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq) AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
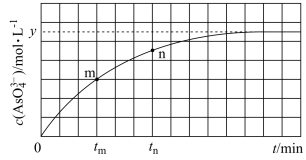
①下列可判断反应达到平衡的是___ (填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.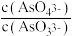 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正___ v逆(填“大于”“小于”或“等于”)。
③tm时v逆___ tn时v逆(填“大于”“小于”或“等于”),理由是___ 。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
②若反应进行到状态D时,v正
(2)已知N2(g)+3H2(g)
 2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=
2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=
(3)298K时,将20mL3xmol·L-1 Na3AsO3、20mL3xmol·L-1I2和20 mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)
 AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.
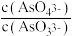 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1②tm时,v正
③tm时v逆
您最近半年使用:0次
【推荐3】I.研究合成氨反应:N2(g)+3H2(g) 2NH3(g) △H=﹣92.2kJ/mol。
2NH3(g) △H=﹣92.2kJ/mol。
(1)该反应的化学平衡常数表达式是K=_______ 。
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
其中,K1_______ K2(填“>”、“=”或“<”)。
(3)合成氨在农业和国防中有很重要的意义,在实际工作生成中,常采用下列措施,其中可以用勒夏特列原理解释的是_____
①采用较高温度(400℃~500℃) ②采用较高压强(20MPa~50MPa)
③用铁触媒加快化学反应速率 ④将生成的氨液化并及时从体系中分离出来
II.工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l) △H<0,
(1)将2molNH3和1molCO2投到一温度恒定、体积恒定的容器中进行反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是_____ (填字母)。
a.2v正(NH3)=v逆(CO2) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO2、NH3的体积分数均不再变化
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
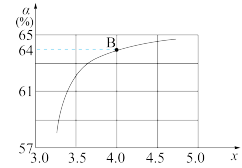
=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_____ 。图中的B点处,NH3的平衡转化率为_______ 。
 2NH3(g) △H=﹣92.2kJ/mol。
2NH3(g) △H=﹣92.2kJ/mol。(1)该反应的化学平衡常数表达式是K=
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
T/K | 473 | 573 | 673 | … |
K | 4.4×10﹣2 | K1 | K2 | … |
(3)合成氨在农业和国防中有很重要的意义,在实际工作生成中,常采用下列措施,其中可以用勒夏特列原理解释的是
①采用较高温度(400℃~500℃) ②采用较高压强(20MPa~50MPa)
③用铁触媒加快化学反应速率 ④将生成的氨液化并及时从体系中分离出来
II.工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l) △H<0,
(1)将2molNH3和1molCO2投到一温度恒定、体积恒定的容器中进行反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
a.2v正(NH3)=v逆(CO2) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO2、NH3的体积分数均不再变化
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
 =x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】CO2减排策略主要有三种:减少排放,捕集封存,转化利用。其中CO2转化利用,生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。由CO2转化制甲醇具有重要的经济效益。
(1)高效催化剂对CO2加氢制甲醇的反应速率影响很大。通过计算机分析,CO2加氢制甲醇在不同催化条件下存在两种反应路径的势能图如下图所示。

①CO2加氢制甲醇的热化学方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=_______ eV/mol(阿伏加德罗常数用NA表示);
②_______ (填“甲酸盐”或“羧酸”)路径更有利于CO2加氢制甲醇反应,对该路径的反应速率影响最大的一步反应是_______ ;
③根据势能图,下列说法合理的是_______ (填标号)。
A.CO2分压越大,催化剂表面积越大,CO2在催化剂表面的吸附速率越大
B.不考虑H3COH*,两种路径中产生的含碳中间体种类均有5种
C.中间体HCOO*比COOH*更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率
(2)CO2催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arrhenius经验公式为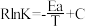 (其中Ea为活化能,k为速率常数,R和C为常数)。
(其中Ea为活化能,k为速率常数,R和C为常数)。

①该反应的活化能Ea=________ kJ/mol;
②当使用更高效的催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图_______ 。
(3)在CO2催化加氢制甲醇过程中也存在竞争反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0,在恒温密闭容器中,维持压强和投料比不变,将CO2和H2按一定流速通过反应器,CO2转化率和甲醇选择性[x(CH3OH)%=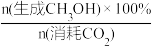 ]随温度变化关系如下图所示:
]随温度变化关系如下图所示:
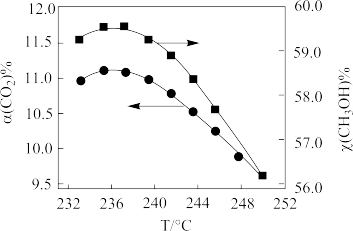
CO2转化率和甲醇选择性随温度的变化曲线
①若233-251℃时催化剂的活性受温度影响不大,分析235℃后图中曲线下降的原因_______ 。
②在压强为P的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为20%,甲醇的选择性为50%,计算CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)在该温度下的平衡常数Kp=_______ 。(列出计算式)
(1)高效催化剂对CO2加氢制甲醇的反应速率影响很大。通过计算机分析,CO2加氢制甲醇在不同催化条件下存在两种反应路径的势能图如下图所示。

①CO2加氢制甲醇的热化学方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=
②
③根据势能图,下列说法合理的是
A.CO2分压越大,催化剂表面积越大,CO2在催化剂表面的吸附速率越大
B.不考虑H3COH*,两种路径中产生的含碳中间体种类均有5种
C.中间体HCOO*比COOH*更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率
(2)CO2催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arrhenius经验公式为
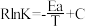 (其中Ea为活化能,k为速率常数,R和C为常数)。
(其中Ea为活化能,k为速率常数,R和C为常数)。
①该反应的活化能Ea=
②当使用更高效的催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图(3)在CO2催化加氢制甲醇过程中也存在竞争反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0,在恒温密闭容器中,维持压强和投料比不变,将CO2和H2按一定流速通过反应器,CO2转化率和甲醇选择性[x(CH3OH)%=
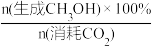 ]随温度变化关系如下图所示:
]随温度变化关系如下图所示:
CO2转化率和甲醇选择性随温度的变化曲线
①若233-251℃时催化剂的活性受温度影响不大,分析235℃后图中曲线下降的原因
②在压强为P的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为20%,甲醇的选择性为50%,计算CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)在该温度下的平衡常数Kp=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】低碳烯烃(乙烯、丙烯等)作为化学工业重要基本有机化工原料,在现代石油和化学工业中起着举足轻重的作用。碘甲烷( )热裂解制低碳烯烃的主要反应有:
)热裂解制低碳烯烃的主要反应有:
反应Ⅰ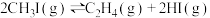

反应Ⅱ

反应Ⅲ

(1)反应Ⅰ、Ⅱ、Ⅲ的 随温度的变化如图1所示。298K下,
随温度的变化如图1所示。298K下,
___________  。
。
(2)针对反应Ⅰ,利于提高碘甲烷的平衡转化率的条件有___________ 。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)利用计算机模拟反应过程。一定压强条件下,测定反应温度对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响如图2所示。结合图1、图2,回答下列问题:
①下列有关说法正确的是___________ 。
A.因为反应Ⅱ、Ⅲ自发,且为熵减小反应,所以 、
、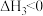
B.若 随温度的上升而增大,则
随温度的上升而增大,则
C.随温度升高,反应Ⅱ、Ⅲ的化学平衡先正向移动后逆向移动
D.当温度范围:T≤715K时,相同条件下的反应Ⅱ的平衡常数小于反应Ⅲ
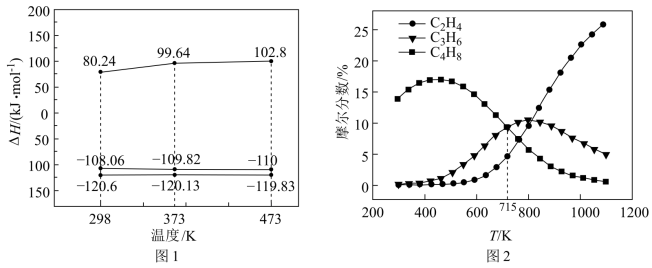
②从图2中可看出,当体系温度高于600K时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:___________ 。
(4)维持温度为810K,压强为0.1MPa,起始投料1mol ,测得平衡体系中
,测得平衡体系中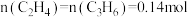 ,
, 。
。
①平衡时 的转化率为
的转化率为___________ 。
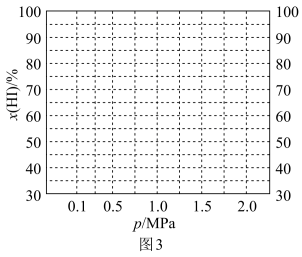
②已知810K条件下,存在等式 (常数)
(常数) (对于气相反应,用某组分B的平衡压强p(B)可代替物质的量浓度c(B),如
(对于气相反应,用某组分B的平衡压强p(B)可代替物质的量浓度c(B),如 ,p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出x(HI)与压强(0.1~2.0MPa)关系的曲线示意图
,p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出x(HI)与压强(0.1~2.0MPa)关系的曲线示意图___________ 。
 )热裂解制低碳烯烃的主要反应有:
)热裂解制低碳烯烃的主要反应有:反应Ⅰ
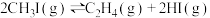

反应Ⅱ


反应Ⅲ


(1)反应Ⅰ、Ⅱ、Ⅲ的
 随温度的变化如图1所示。298K下,
随温度的变化如图1所示。298K下,
 。
。(2)针对反应Ⅰ,利于提高碘甲烷的平衡转化率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)利用计算机模拟反应过程。一定压强条件下,测定反应温度对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响如图2所示。结合图1、图2,回答下列问题:
①下列有关说法正确的是
A.因为反应Ⅱ、Ⅲ自发,且为熵减小反应,所以
 、
、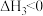
B.若
 随温度的上升而增大,则
随温度的上升而增大,则
C.随温度升高,反应Ⅱ、Ⅲ的化学平衡先正向移动后逆向移动
D.当温度范围:T≤715K时,相同条件下的反应Ⅱ的平衡常数小于反应Ⅲ

②从图2中可看出,当体系温度高于600K时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:
(4)维持温度为810K,压强为0.1MPa,起始投料1mol
 ,测得平衡体系中
,测得平衡体系中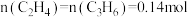 ,
, 。
。①平衡时
 的转化率为
的转化率为②已知810K条件下,存在等式
 (常数)
(常数) (对于气相反应,用某组分B的平衡压强p(B)可代替物质的量浓度c(B),如
(对于气相反应,用某组分B的平衡压强p(B)可代替物质的量浓度c(B),如 ,p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出x(HI)与压强(0.1~2.0MPa)关系的曲线示意图
,p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出x(HI)与压强(0.1~2.0MPa)关系的曲线示意图
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】燃煤火力发电厂会产生大量的NOx、SO2、CO2,排放会对环境造成污染。
(1)通常情况下,当1gC(s)完全燃烧时释放出33kJ热量,该反应的热化学方程式为_______ 。
(2)用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) N2(g)+CO2(g)△H。在2L恒容密闭器中加入足量C与NO发生反应,所得数据如下表。
N2(g)+CO2(g)△H。在2L恒容密闭器中加入足量C与NO发生反应,所得数据如下表。
①700℃时,若反应2min达到平衡,0~2min内的CO2平均反应速率v=_______ ;该温度下的平衡常数K=_______ 。
②结合表中数据,判断该反应的△H_______ 0(填“>”或“<”)。
③判断该反应达到平衡的依据是_______ 。
A.容器内气体密度恒定B.容器内各气体浓度恒定
C.容器内压强恒定D.2v正(NO)=v逆(N2)
(3)已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为_______ 。
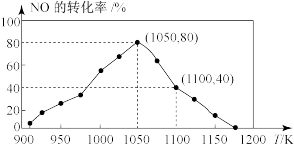
(1)通常情况下,当1gC(s)完全燃烧时释放出33kJ热量,该反应的热化学方程式为
(2)用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)
 N2(g)+CO2(g)△H。在2L恒容密闭器中加入足量C与NO发生反应,所得数据如下表。
N2(g)+CO2(g)△H。在2L恒容密闭器中加入足量C与NO发生反应,所得数据如下表。| 实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
| 1 | 700 | 0.24 | 0.08 |
| 2 | 800 | 0.40 | 0.09 |
②结合表中数据,判断该反应的△H
③判断该反应达到平衡的依据是
A.容器内气体密度恒定B.容器内各气体浓度恒定
C.容器内压强恒定D.2v正(NO)=v逆(N2)
(3)已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为

您最近半年使用:0次



