回答下列问题
(1)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g) ΔH1>0
SiHCl3(g)+HCl(g) ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3
反应③的ΔH3=___________ (用ΔH1,ΔH2表示)。
(2)用惰性电极电解一定浓度的硫酸铜溶液一段时间后,若要恢复到电解前的浓度,须向所得的溶液中加入0.3molCu(OH)2。此电解过程中两个电极共放出气体为___________ mol,若要恢复到电解前的浓度,还可加入0.3mol___________ 和0.3molH2O。
(3)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池示意图如图:
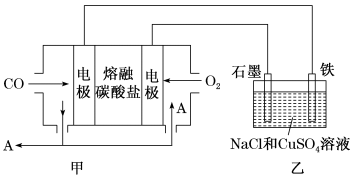
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。该电池负极电极反应为___________ 。
(4)用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如乙图。理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(体积为标准状况下的体积)。
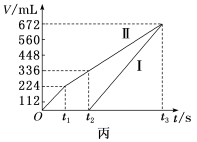
①写出在t1后,石墨电极上的电极反应:___________ ;原NaCl溶液物质的量浓度为___________ mol·L-1(假设溶液体积不变)。
②当向上述甲装置中通入标准状况下的氧气336mL时,理论上在铁电极上可析出铜的质量为___________ g。
(1)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)
 SiHCl3(g)+HCl(g) ΔH1>0
SiHCl3(g)+HCl(g) ΔH1>0②3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0③2SiCl4(g)+H2(g)+Si(s)+HCl(g)
 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3反应③的ΔH3=
(2)用惰性电极电解一定浓度的硫酸铜溶液一段时间后,若要恢复到电解前的浓度,须向所得的溶液中加入0.3molCu(OH)2。此电解过程中两个电极共放出气体为
(3)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池示意图如图:

为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。该电池负极电极反应为
(4)用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如乙图。理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(体积为标准状况下的体积)。

①写出在t1后,石墨电极上的电极反应:
②当向上述甲装置中通入标准状况下的氧气336mL时,理论上在铁电极上可析出铜的质量为
更新时间:2024-04-04 10:42:16
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔHl =-76.0 kJ·mol-1
ⅱ. C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = +113.4 kJ·mol-1
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) ΔH3 =_________ kJ·mol-1。
(2)在反应i中,每放出38.0 kJ热量,有______ g FeO被氧化。
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
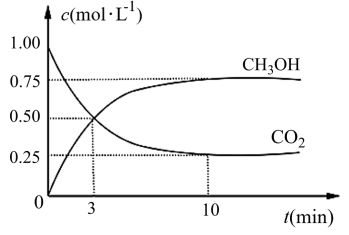
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=________ mol·(L·min) -1。
(4)氢气的转化率=________________________ 。
(5)该反应的平衡常数为__________________________ (保留小数点后2位)。
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
(7)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________ c2的关系(填“>”、“<”或“=”)。
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)将该吸收液蒸干,灼烧至恒重,所得固体的成分是_________ (填化学式)。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔHl =-76.0 kJ·mol-1
ⅱ. C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = +113.4 kJ·mol-1
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) ΔH3 =
(2)在反应i中,每放出38.0 kJ热量,有
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=
(4)氢气的转化率=
(5)该反应的平衡常数为
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.再充入1 mol H2 | D.将H2O(g)从体系中分离出去 |
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)将该吸收液蒸干,灼烧至恒重,所得固体的成分是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】二氧化碳甲烷化技术被认为是二氧化碳循环再利用最有效的技术之一。回答下列问题:
(1)Pd-MgO/SiO2界面上甲烷化的过程如图:
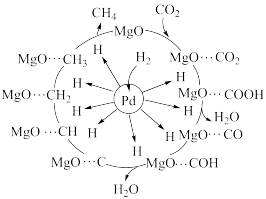
下列说法正确的是______ (填标号)。
A.整个循环过程中镁的价态不断发生改变 B.循环中Pd、MgO、SiO2均未参与反应
C.氢分子在Pd表面被吸附并解离为氢原子 D.总反应为4H2+CO2=CH4+2H2O
(2)已知CO2甲烷化过程中包含下列反应:
I.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+42.1kJ·mol-1K1
CO(g)+H2O(g) △H1=+42.1kJ·mol-1K1
II.CO(g)+3H2(g) CH4(g)+H2O(g) △H2=-206.5kJ·mol-1K2
CH4(g)+H2O(g) △H2=-206.5kJ·mol-1K2
保持压强不变,在0.1MPa下,起始时充入3molH2、1molCO2,不同温度下催化甲烷化时,平衡时物质(H2O未列出)的物质的量分数与温度的关系如图所示:
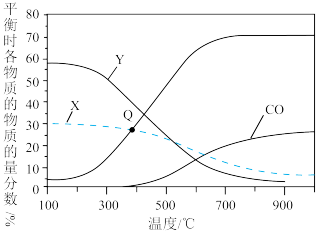
①总反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=_____ kJ·mol-1;其平衡常数K=______ (用含K1、K2的代数式表示)。
②图中X为CO2,则Y表示的物质是_________ (填化学式)。
③温度超过400℃时,升高温度,CO的物质的量分数不断增大,这是因为________ 。
④图中Q点时(对应温度下,可认为体系中不含CO),CH4的压强为_______ MPa,该温度下,甲烷化总反应的平衡常数为__________ (用分压表示,分压=总压×物质的量分数)(MPa)2。
(1)Pd-MgO/SiO2界面上甲烷化的过程如图:

下列说法正确的是
A.整个循环过程中镁的价态不断发生改变 B.循环中Pd、MgO、SiO2均未参与反应
C.氢分子在Pd表面被吸附并解离为氢原子 D.总反应为4H2+CO2=CH4+2H2O
(2)已知CO2甲烷化过程中包含下列反应:
I.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+42.1kJ·mol-1K1
CO(g)+H2O(g) △H1=+42.1kJ·mol-1K1II.CO(g)+3H2(g)
 CH4(g)+H2O(g) △H2=-206.5kJ·mol-1K2
CH4(g)+H2O(g) △H2=-206.5kJ·mol-1K2保持压强不变,在0.1MPa下,起始时充入3molH2、1molCO2,不同温度下催化甲烷化时,平衡时物质(H2O未列出)的物质的量分数与温度的关系如图所示:

①总反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=②图中X为CO2,则Y表示的物质是
③温度超过400℃时,升高温度,CO的物质的量分数不断增大,这是因为
④图中Q点时(对应温度下,可认为体系中不含CO),CH4的压强为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】丙烯是重要的有机化工原料,丙烷脱氢是工业生产丙烯的重要途径,其化学方程式为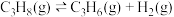 。回答下列相关问题:
。回答下列相关问题:
(1)已知:Ⅰ.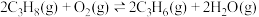
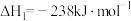
Ⅱ.
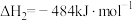
则丙烷脱氢制丙烯反应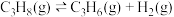 的△H=
的△H=_______ kJ∙mol-1。
(2)一定温度下,向1L的密闭容器中充入1molC3H8发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.5倍。
①0~10min丙烯的化学反应速率v(C3H6)=_______ mol·L-1·min-1。
②下列情况能说明该反应达到平衡状态的是_______ (填字母标号)。
A.△H不变 B.C3H6与H2的物质的量之比保持不变
C.混合气体的总压强不变 D.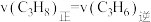
③欲提高丙烷转化率,采取的措施是_______ (填字母标号)。
A.降低温度 B.升高温度 C.加催化剂 D.及时分离出H2
④在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,若n(氩气)/n(丙烷)起始比例增大,则丙烷的平衡转化率_______ (填“增大”、“减小”或“不变”)。
(3)一定温度下,向恒容密闭容器中充入1molC3H8,开始压强为pkPa,C3H8的气体体积分数与反应时间的关系如图所示:
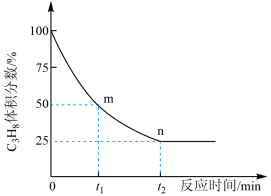
①此温度下该反应的平衡常数Kp=_______ (用含字母p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,各物质的平衡分压=总压×各物质的体积分数)。
②已知该反应过程中, ,
, ,其中
,其中 、
、 为速率常数,只与温度有关,则图中m点处
为速率常数,只与温度有关,则图中m点处 =
=_______ (保留一位小数)。
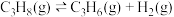 。回答下列相关问题:
。回答下列相关问题:(1)已知:Ⅰ.
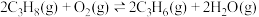
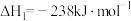
Ⅱ.

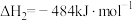
则丙烷脱氢制丙烯反应
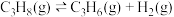 的△H=
的△H=(2)一定温度下,向1L的密闭容器中充入1molC3H8发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.5倍。
①0~10min丙烯的化学反应速率v(C3H6)=
②下列情况能说明该反应达到平衡状态的是
A.△H不变 B.C3H6与H2的物质的量之比保持不变
C.混合气体的总压强不变 D.
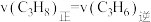
③欲提高丙烷转化率,采取的措施是
A.降低温度 B.升高温度 C.加催化剂 D.及时分离出H2
④在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,若n(氩气)/n(丙烷)起始比例增大,则丙烷的平衡转化率
(3)一定温度下,向恒容密闭容器中充入1molC3H8,开始压强为pkPa,C3H8的气体体积分数与反应时间的关系如图所示:

①此温度下该反应的平衡常数Kp=
②已知该反应过程中,
 ,
, ,其中
,其中 、
、 为速率常数,只与温度有关,则图中m点处
为速率常数,只与温度有关,则图中m点处 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】镍氢电池广泛用于油电一体的混合动力汽车,该电池材料的回收利用也成为研究热点。 I.某品牌镍氢电池的总反应为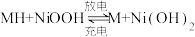 ,其中,MH 为吸附了氢原子的储氢合金。下图为该电池放电时的工作原理示意图。MH
,其中,MH 为吸附了氢原子的储氢合金。下图为该电池放电时的工作原理示意图。MH
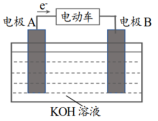
(1)混合动力车上坡时利用电池放电提供能源。
①电极A 是______ (填“正极”或“负极”)。
②正极的电极反应式为________ 。
(2)混合动力车下坡时利用动能回收给电池充电,此时电极A 附近的pH_____ (填“变大”“不 变”或“变小”)。
Ⅱ.该品牌废旧镍氢电池回收过程中,金属镍的转化过程如下。

已知:稀H2SO4 和NaOH 溶液均通过电解Na2SO4 溶液获得,装置如下图,其中,阴离子交换膜可选择性透过阴离子,阳离子交换膜可选择性透过阳离子。
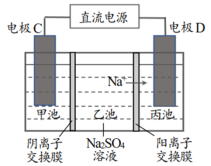
(3)图中,电极C 为电解池的_______ (填“阴极”或“阳极”)。
(4)产生 NaOH 的是_______ (填“甲池”“乙池”或“丙池”),结合化学用语说明产生NaOH 的原理:_______ 。
(5)回收该品牌废旧镍氢电池过程中,在阴极收集到气体134.4 L(标准状况下),理论上可回收得到Ni(OH)2(摩尔质量为 93 g·mol−1)的质量为____ g。
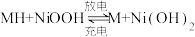 ,其中,MH 为吸附了氢原子的储氢合金。下图为该电池放电时的工作原理示意图。MH
,其中,MH 为吸附了氢原子的储氢合金。下图为该电池放电时的工作原理示意图。MH
(1)混合动力车上坡时利用电池放电提供能源。
①电极A 是
②正极的电极反应式为
(2)混合动力车下坡时利用动能回收给电池充电,此时电极A 附近的pH
Ⅱ.该品牌废旧镍氢电池回收过程中,金属镍的转化过程如下。

已知:稀H2SO4 和NaOH 溶液均通过电解Na2SO4 溶液获得,装置如下图,其中,阴离子交换膜可选择性透过阴离子,阳离子交换膜可选择性透过阳离子。

(3)图中,电极C 为电解池的
(4)产生 NaOH 的是
(5)回收该品牌废旧镍氢电池过程中,在阴极收集到气体134.4 L(标准状况下),理论上可回收得到Ni(OH)2(摩尔质量为 93 g·mol−1)的质量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】恒温下,将amolN2与bmolH2的混合气体通入一个2L的密闭容器中合成氨,当反应进行到5s时,有0.1molNH3生成,并且放出4.62kJ的热量。
(1)0~5s用H2表示该反应的平均反应速率v(H2)=_____ mol·L-1·s-1。
(2)写出合成氨反应的热化学方程式:____ 。
(3)若反应进行到某时刻t时,nt(N2)=3mol,nt(H2)=8mol,nt(NH3)=6mol,
①a=____ ,b=____ 。
②反应达平衡时,混合气体的体积为291.2L(标准状况下),则平衡时NH3的物质的量为____ mol。
③有人设想以N2和H2为反应物,以溶有NH4Cl的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氨的新型燃料电池,装置如图所示。
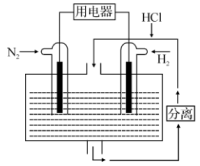
写出该电池负极的电极方程式:____ 。
(1)0~5s用H2表示该反应的平均反应速率v(H2)=
(2)写出合成氨反应的热化学方程式:
(3)若反应进行到某时刻t时,nt(N2)=3mol,nt(H2)=8mol,nt(NH3)=6mol,
①a=
②反应达平衡时,混合气体的体积为291.2L(标准状况下),则平衡时NH3的物质的量为
③有人设想以N2和H2为反应物,以溶有NH4Cl的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氨的新型燃料电池,装置如图所示。

写出该电池负极的电极方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】 是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
Ⅰ.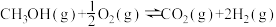 的能量变化如图所示。
的能量变化如图所示。
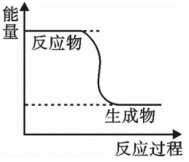
(1)下列说法错误的是___________(填字母)。
Ⅱ. 燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、
燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、 (电解质溶液)构成,其中负极反应式为
(电解质溶液)构成,其中负极反应式为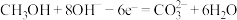 .
.
(2)下列说法正确的是___________ (填序号)。
①电池放电时通入空气的电极为正极
②电池放电时,电解质溶液的碱性逐渐增强
③电池放电时每消耗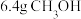 转移1.2
转移1.2 电子
电子
Ⅲ.将 转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入
转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入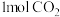 和
和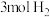 ,一定条件下发生反应:
,一定条件下发生反应: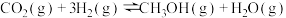
该反应一般认为通过如下分步反应来实现:
①
②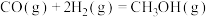
上述反应的能量变化如图所示。
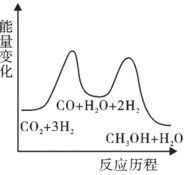
(3)则上述分步反应②为___________ (填吸热或放热)反应。
(4)测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
①a=___________ ;3~6 内,
内,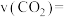
___________  。
。
②能说明上述反应达到平衡状态的是___________ (填标号)。
A.混合气体的压强不随时间的变化而变化
B.反应中 与
与 的物质的量浓度之比为1:1
的物质的量浓度之比为1:1
C.单位时间内生成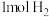 ,同时生成
,同时生成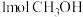
D.混合气体的平均相对分子质量不随时间的变化而变化
③上述反应12 末时,混合气体中
末时,混合气体中 和
和 的物质的量之比是
的物质的量之比是___________ , 的体积分数是
的体积分数是___________ 。
④第3 时
时
___________ (填“>”、“<”、“=”或“无法比较”)第9 时
时 。
。
 是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。Ⅰ.
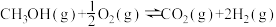 的能量变化如图所示。
的能量变化如图所示。(1)下列说法错误的是___________(填字母)。

A. 转变成 转变成 的过程是一个吸收能量的过程 的过程是一个吸收能量的过程 |
B. 的生成速率与 的生成速率与 的消耗速率之比为1:2 的消耗速率之比为1:2 |
| C.化学变化不仅有新物质生成,同时也伴随着能量变化 |
D.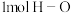 键断裂的同时有 键断裂的同时有 键断裂,则反应达到平衡状态 键断裂,则反应达到平衡状态 |
Ⅱ.
 燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、
燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、 (电解质溶液)构成,其中负极反应式为
(电解质溶液)构成,其中负极反应式为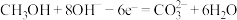 .
.(2)下列说法正确的是
①电池放电时通入空气的电极为正极
②电池放电时,电解质溶液的碱性逐渐增强
③电池放电时每消耗
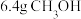 转移1.2
转移1.2 电子
电子Ⅲ.将
 转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入
转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入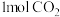 和
和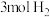 ,一定条件下发生反应:
,一定条件下发生反应: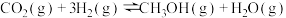
该反应一般认为通过如下分步反应来实现:
①

②
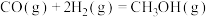
上述反应的能量变化如图所示。

(3)则上述分步反应②为
(4)测得
 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。| 时间 | 0 | 3 | 6 | 9 | 12 |
 | 0 | 0.50 | 0.65 | 0.74 | 0.74 |
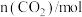 | 1 | 0.50 | a | 0.26 | 0.26 |
①a=
 内,
内,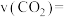
 。
。②能说明上述反应达到平衡状态的是
A.混合气体的压强不随时间的变化而变化
B.反应中
 与
与 的物质的量浓度之比为1:1
的物质的量浓度之比为1:1C.单位时间内生成
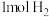 ,同时生成
,同时生成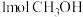
D.混合气体的平均相对分子质量不随时间的变化而变化
③上述反应12
 末时,混合气体中
末时,混合气体中 和
和 的物质的量之比是
的物质的量之比是 的体积分数是
的体积分数是④第3
 时
时
 时
时 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】2021年3月“两会”政府工作报告中提出的“碳达峰”、“碳中和”已成为热词。回答下列问题:
(1)已知:I.
II.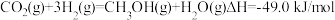
Ⅲ.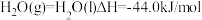
求反应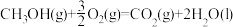 的△H=
的△H=___________ kJ/mol
(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应Ⅱ: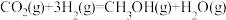 ,其中CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:
,其中CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:
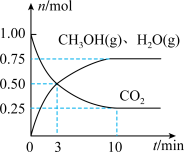
①达到平衡时,用H2(g)表示的化学反应速率v(H2)=_________ 。
②该反应的平衡常数K=_________ (写出计算式即可)。
③恒温下将体积变为2L,平衡时CO2的转化率将_________ (填“变大”、“变小”或“不变”)
④下列措施一定可以提高甲醇生成速率的有_________ 。
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用催化剂
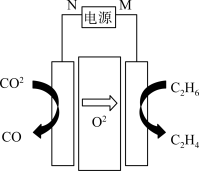
(3)我国科学家使用电化学的方法,用C2H6和CO2合成了C2H4,装置如下图所示。电极N为电源的___________ (选填“正极”、“负极”),阳极电极反应式是_________ 。
(1)已知:I.

II.
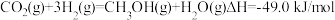
Ⅲ.
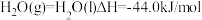
求反应
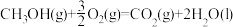 的△H=
的△H=(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应Ⅱ:
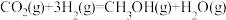 ,其中CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:
,其中CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:
①达到平衡时,用H2(g)表示的化学反应速率v(H2)=
②该反应的平衡常数K=
③恒温下将体积变为2L,平衡时CO2的转化率将
④下列措施一定可以提高甲醇生成速率的有
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用催化剂
(3)我国科学家使用电化学的方法,用C2H6和CO2合成了C2H4,装置如下图所示。电极N为电源的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】如图所示甲、乙两池电极材料均为铁棒与铂棒,请回答下列问题:
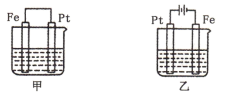
(1)若电池中均为 溶液,则下列说法正确的是
溶液,则下列说法正确的是____ (填标号)。
A.一段时间后,甲、乙两池中Pt棒上都有红色物质析出
B.甲池中Fe棒上发生氧化反应,乙池中Fe棒上发生还原反应
C.甲池中 向Fe棒移动,乙池中
向Fe棒移动,乙池中 向Pt棒移动
向Pt棒移动
D.一段时间后,甲池中Fe棒质量减少,乙池中Fe棒质量增加
(2)若两池中均为饱和NaCl溶液。
①写出乙池中总反应的化学方程式:_____ ,乙池中Pt棒上的电极反应属于____ (填“氧化”或“还原”)反应。
②甲池中Pt棒上的电极反应式是_______ 。
③室温下,若乙池转移0.02mol电子后停止实验,该池中溶液体积为2000mL,则溶液混合均匀后
______ 。

(1)若电池中均为
 溶液,则下列说法正确的是
溶液,则下列说法正确的是A.一段时间后,甲、乙两池中Pt棒上都有红色物质析出
B.甲池中Fe棒上发生氧化反应,乙池中Fe棒上发生还原反应
C.甲池中
 向Fe棒移动,乙池中
向Fe棒移动,乙池中 向Pt棒移动
向Pt棒移动D.一段时间后,甲池中Fe棒质量减少,乙池中Fe棒质量增加
(2)若两池中均为饱和NaCl溶液。
①写出乙池中总反应的化学方程式:
②甲池中Pt棒上的电极反应式是
③室温下,若乙池转移0.02mol电子后停止实验,该池中溶液体积为2000mL,则溶液混合均匀后

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH1=-221 kJ·mol-1
4Al(g)+3O2(g) =2Al2O3(s) ΔH2=-3351 kJ·mol-1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318 kJ·mol-1
碳热还原Al2O3合成 AlN 的总热化学方程式是_______ ;
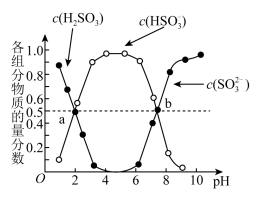
(2)“亚硫酸盐法”吸收烟气中的SO2,室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。请写出a点时n(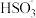 ):n(H2SO3)=
):n(H2SO3)=_______ ,b点时溶液pH=7,则n( ):n(
):n(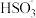 )=
)=_______ ;
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为:4NH3+6NO 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:
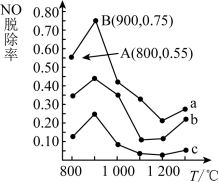
①曲线c对应NH3与NO的物质的量之比是_______ ,
②曲线a中NO的起始浓度为6×10-4 mg·m-3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为_______ mg·m-3·s-1;
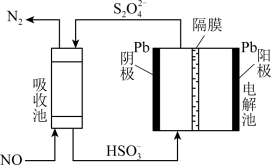
(4)间接电化学法可除NO。其原理如图所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)_______ 。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH1=-221 kJ·mol-1
4Al(g)+3O2(g) =2Al2O3(s) ΔH2=-3351 kJ·mol-1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318 kJ·mol-1
碳热还原Al2O3合成 AlN 的总热化学方程式是
(2)“亚硫酸盐法”吸收烟气中的SO2,室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。请写出a点时n(
 ):n(H2SO3)=
):n(H2SO3)= ):n(
):n(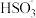 )=
)=
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为:4NH3+6NO
 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:
①曲线c对应NH3与NO的物质的量之比是
②曲线a中NO的起始浓度为6×10-4 mg·m-3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为
(4)间接电化学法可除NO。其原理如图所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂等。工业制取硝酸铵的工艺流程如下:
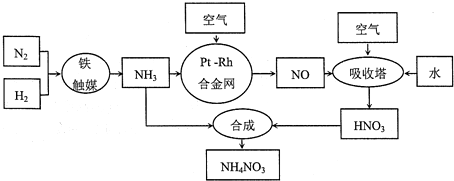
(1)合成氨气的工业设备名称_______________ ,设备中设置热交换器的目的是____________ ,合成氨的原料气必须先脱硫,目的是_______________ ;
(2)吸收塔中反应的化学方程式为_________________________ ,从生产流程看,吸收塔中需要补充空气,其原因是_______________ ;
(3)生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理:
方法一:碱性溶液吸收法
NO+NO2+2NaOH═2NaNO2+H2O;2NO2+Na2CO3═NaNO2+NaNO3+CO2
方法二:NH3还原法
8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H=-2635kJ/mol(NO也有类似的反应)
方法三:甲烷吸收法
CH4(g)+2NO2═CO2(g)+N2+2H2O(g)△H=+867kJ/mol(NO也有类似的反应)
上述三种方法中,方法一的主要缺点是_______________ ;
方法三和方法二相比,方法三的缺点是_______________ ;
(4)工业上也可以通过电解NO制备NH4NO3,其工作原理如图所示.
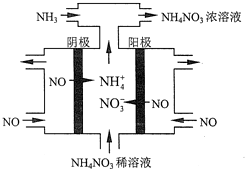
①图中通入NH3的目的是_______________ ;
②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为_____ g;(已知F=96500C•mol-l)(保留2位有效数字).
(5)某化肥厂用NH3制备NH4NO3.已知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为______________ 。

(1)合成氨气的工业设备名称
(2)吸收塔中反应的化学方程式为
(3)生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理:
方法一:碱性溶液吸收法
NO+NO2+2NaOH═2NaNO2+H2O;2NO2+Na2CO3═NaNO2+NaNO3+CO2
方法二:NH3还原法
8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H=-2635kJ/mol(NO也有类似的反应)
方法三:甲烷吸收法
CH4(g)+2NO2═CO2(g)+N2+2H2O(g)△H=+867kJ/mol(NO也有类似的反应)
上述三种方法中,方法一的主要缺点是
方法三和方法二相比,方法三的缺点是
(4)工业上也可以通过电解NO制备NH4NO3,其工作原理如图所示.

①图中通入NH3的目的是
②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为
(5)某化肥厂用NH3制备NH4NO3.已知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
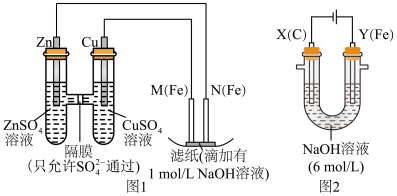
请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是______ (填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)M 极发生反应的电极反应式为____________________________________________________ 。
此装置中发生的总反应化学方程式___________________________________________ 。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH________ (填“增大”“减小”或“不变”)。
(4)电解过程中, 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少________ g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为____________________________________________ 。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是
A.铝 B.石墨 C.银 D.铂
(2)M 极发生反应的电极反应式为
此装置中发生的总反应化学方程式
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH
(4)电解过程中, 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料氯化钠时,设计了以下操作流程:

请回答以下问题:
(1)在所提供的试剂中选择:试剂C是___________________
①Na2CO3 ②BaCl2 ③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、_______________ 、三脚架和玻璃棒。
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按下图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:

A接_______ ,_______ 接_______ ;B接______ ,______ 接_______ 。
(4)写出通入C后,烧杯中所发生的离子反应方程式____________________
(5)电解氯化钠溶液时的离子方程式为_____________________ ,若装入的饱和食盐水为75mL,接通电源一段时间,停止通电后,测得氢气为8.4mL(标准状况)。将U形管内的溶液混合均匀,其pH约为_______ 。(假设电解前后溶液体积变化可忽略不计,产生的气体全部逸出)
(6)若想准确读取所得氢气的体积,应采取的操作有____________________

请回答以下问题:
(1)在所提供的试剂中选择:试剂C是
①Na2CO3 ②BaCl2 ③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按下图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:

A接
(4)写出通入C后,烧杯中所发生的离子反应方程式
(5)电解氯化钠溶液时的离子方程式为
(6)若想准确读取所得氢气的体积,应采取的操作有
您最近一年使用:0次



