运用化学反应原理,研究硫、磷化合物的反应具有重要意义。
(1)已知 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为_______ ,该盐属于_____ (填“正盐”或“酸式盐”)。H3PO2易被氧化为 ,已知常温下
,已知常温下 的电离常数为
的电离常数为 ,
,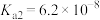 ,
,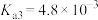 ,请利用以上数据计算推测
,请利用以上数据计算推测 溶液呈
溶液呈____ 性。
(2)常温下,用NaOH溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡______ (填“向左”“向右”或“不”)移动。试计算该溶液中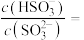
_______ (常温下, 的电离平衡常数
的电离平衡常数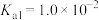 ,
, )。
)。
(3)化工生产中常用FeS作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为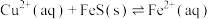
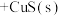 下列有关叙述正确的是_____。
下列有关叙述正确的是_____。
(1)已知
 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为 ,已知常温下
,已知常温下 的电离常数为
的电离常数为 ,
,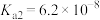 ,
,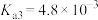 ,请利用以上数据计算推测
,请利用以上数据计算推测 溶液呈
溶液呈(2)常温下,用NaOH溶液吸收
 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡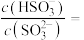
 的电离平衡常数
的电离平衡常数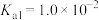 ,
, )。
)。(3)化工生产中常用FeS作沉淀剂除去工业废水中的
 ,其反应原理为
,其反应原理为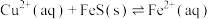
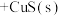 下列有关叙述正确的是_____。
下列有关叙述正确的是_____。A. |
B.达到平衡时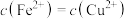 |
C.溶液中加入少量 固体后,溶液中 固体后,溶液中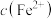 、 、 都减小 都减小 |
D.该反应平衡常数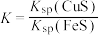 |
更新时间:2024-04-29 10:47:30
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】I.氨是一种重要的工业原料。回答下列问题:
(1)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式____________ ;该反应中氧化产物与还原产物的物质的量之比为____ 。
(2)当运输氨气的管道发生泄漏时,可用一种挥发性液体________ (写试剂名称) 进行检查,出现的现象是___________________________________ 。
II.联氨(N2H4)具有较强的还原性。工业上用过量氨气和NaClO溶液来制备。
(3)制取NaClO所用的原料是_________ 、_________ 。解释氨气过量的原因_________ 。
常温下,向10mL pH=2的盐酸中滴加等浓度氨水。加入氨水的体积(V)与溶液pH的关系如图所示。
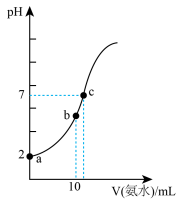
(4)a点溶液中由水电离产生的c(H+)___ 10-7mol/L (填>、<或=);用平衡移动原理解释b点溶液呈酸性的原因___________ 。
(5)比较c点溶液中所有离子浓度大小关系是_________________ 。
(1)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式
(2)当运输氨气的管道发生泄漏时,可用一种挥发性液体
II.联氨(N2H4)具有较强的还原性。工业上用过量氨气和NaClO溶液来制备。
(3)制取NaClO所用的原料是
常温下,向10mL pH=2的盐酸中滴加等浓度氨水。加入氨水的体积(V)与溶液pH的关系如图所示。

(4)a点溶液中由水电离产生的c(H+)
(5)比较c点溶液中所有离子浓度大小关系是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】按要求填空:
(1)下列物质中,属于电解质的是_______ ,属于强电解质的是_______ ,属于弱电解质的是_______ (填序号)。
①H2SO4;②盐酸;③硫酸钡;④乙醇;⑤铜;⑥H2S;⑦蔗糖;⑧氨气;⑨NH4HSO3
(2)已知水的电离平衡曲线如图所示,试回答下列问题:

①图中A、B、C、D、E五点的Kw间的大小关系是_______ 。(用A、B、C、D、E表示)
②若从A点到D点,可采用的措施是_______ 。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl固体
③点B对应温度条件下,某溶液pH=7,此时,溶液呈_______ (酸性、碱性、中性)。
④25 ℃时,若pH=a的100体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前该a+b=_______ 。
(1)下列物质中,属于电解质的是
①H2SO4;②盐酸;③硫酸钡;④乙醇;⑤铜;⑥H2S;⑦蔗糖;⑧氨气;⑨NH4HSO3
(2)已知水的电离平衡曲线如图所示,试回答下列问题:

①图中A、B、C、D、E五点的Kw间的大小关系是
②若从A点到D点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl固体
③点B对应温度条件下,某溶液pH=7,此时,溶液呈
④25 ℃时,若pH=a的100体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前该a+b=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】Ⅰ.实验室用0.100mol/LNaOH标准溶液滴定未知浓度的盐酸。
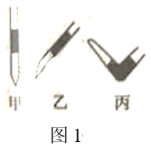
(1)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图1中的___________ 操作(填“甲”、“乙”、“丙”)。选择酚酞作为指示剂,滴定终点的现象为___________ 。
(2)下列操作会导致实验结果偏低的是___________ (填标号)。
A.碱式滴定管未用标准NaOH溶液润洗
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.滴定过程中振荡锥形瓶,液体不慎溅出
(3)某学生进行3次实验得到相关数据如表所示。
则盐酸的物质的量浓度为___________ mol/L。(保留三位小数)
Ⅱ.一定浓度的 溶液中含硫元素所有微粒的物质的量分数随pH的变化如图2所示。
溶液中含硫元素所有微粒的物质的量分数随pH的变化如图2所示。
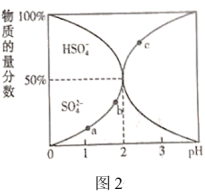
(4)图中a、b、c三点,水电离的 由大到小的顺序分为
由大到小的顺序分为___________ (用a、b、c表示),pH=3时,
___________ 。
(1)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图1中的

(2)下列操作会导致实验结果偏低的是
A.碱式滴定管未用标准NaOH溶液润洗
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.滴定过程中振荡锥形瓶,液体不慎溅出
(3)某学生进行3次实验得到相关数据如表所示。
| 滴定次数 | 待测盐酸的体积/mL | 消耗0.100mol/LNaOH溶液的体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
Ⅱ.一定浓度的
 溶液中含硫元素所有微粒的物质的量分数随pH的变化如图2所示。
溶液中含硫元素所有微粒的物质的量分数随pH的变化如图2所示。
(4)图中a、b、c三点,水电离的
 由大到小的顺序分为
由大到小的顺序分为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】“烂板液”指的是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量Cl-、Fe3+)。某化学兴趣小组用“烂板液”制取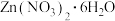 的过程如图:
的过程如图:
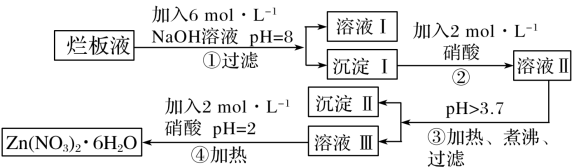
已知:Zn(NO3)2·6H2O是一种无色晶体,其水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂板液”中溶质的主要成分是_______ (填化学式)。
(2)在操作①中保持pH=8的目的是_______ 。
(3)沉淀I的主要成分是_______ (填化学式)。
(4)操作③中加热煮沸的目的是_______ 。
(5)操作④中加热所用的主要玻璃仪器有_______ 。
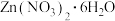 的过程如图:
的过程如图:
已知:Zn(NO3)2·6H2O是一种无色晶体,其水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂板液”中溶质的主要成分是
(2)在操作①中保持pH=8的目的是
(3)沉淀I的主要成分是
(4)操作③中加热煮沸的目的是
(5)操作④中加热所用的主要玻璃仪器有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】(1)21世纪是钛的世界,纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上二氧化钛的制备是:
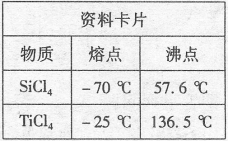
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4,所采取的操作名称是_______
III.用TiCl4制备TiO2·xH2O的化学方程式为________________ ,制备时需要________ ,促进水解趋于完全。
IV.TiO2·xH2O高温分解得到TiO2。如在实验室中进行,则需在________ (填仪器名称)中加热。
(2)亚硫酰氯(SOCl2)是一种液态化合物,沸点为77℃,在农药制药等领域用途广泛。SOCl2遇水剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体可使品红溶液褪色。根据上述实验,写出SOCl2与水反应的化学方程式_________________________________________________ ,AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得无水AlCl3,其原因是______________________________

I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4,所采取的操作名称是
III.用TiCl4制备TiO2·xH2O的化学方程式为
IV.TiO2·xH2O高温分解得到TiO2。如在实验室中进行,则需在
(2)亚硫酰氯(SOCl2)是一种液态化合物,沸点为77℃,在农药制药等领域用途广泛。SOCl2遇水剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体可使品红溶液褪色。根据上述实验,写出SOCl2与水反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】锗是一种重要的半导体材料,同时在航空航天测控、化学催化剂、生物医学等领域都有广泛而重要的应用。实验室模拟生产锗的实验过程如图所示:
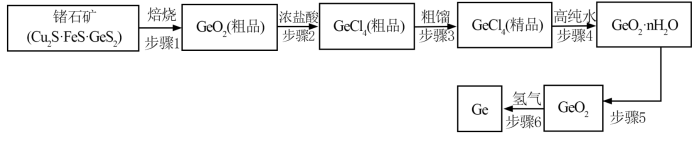
已知:GeCl4的熔点:-49.5℃,沸点:82℃,密度:1.9g·cm-3。
回答下列问题:
(1)在实验室中,若焙烧锗石矿,应将样品放在____ 中灼烧。产生的气体可以用下列____ 方式处理(填标号)。
a. 氢氧化钠溶液 b.
氢氧化钠溶液 b. 酸性高锰酸钾溶液
酸性高锰酸钾溶液
c. 苯和水的分层液 d.
苯和水的分层液 d. 碱石灰
碱石灰
(2)步骤2:将烧渣放入三颈烧瓶中,分批加入浓盐酸并搅拌,控制温度为40℃反应30分钟,反应装置如图所示:
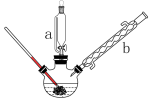
①仪器a的名称是____ ,仪器b的作用是____ ,加热采用的方式为____ 。
②用浓盐酸而不用稀盐酸处理GeO2粗品的原因是____ 。
(3)写出“步骤4”生成GeO2·nH2O反应的化学方程式___ 。
(4)查阅资料得知:“步骤4”生成的GeO2·nH2O实为GeO2·H2O,其在5.0mol·L-1的盐酸中溶解度最小。取10.0mLGeCl4和高纯水反应,欲使GeO2·H2O的产率最高,加入高纯水的体积约为____ mL(忽略混合及反应前后液体体积的变化,保留一位小数)。

已知:GeCl4的熔点:-49.5℃,沸点:82℃,密度:1.9g·cm-3。
回答下列问题:
(1)在实验室中,若焙烧锗石矿,应将样品放在
a.
 氢氧化钠溶液 b.
氢氧化钠溶液 b. 酸性高锰酸钾溶液
酸性高锰酸钾溶液c.
 苯和水的分层液 d.
苯和水的分层液 d. 碱石灰
碱石灰(2)步骤2:将烧渣放入三颈烧瓶中,分批加入浓盐酸并搅拌,控制温度为40℃反应30分钟,反应装置如图所示:

①仪器a的名称是
②用浓盐酸而不用稀盐酸处理GeO2粗品的原因是
(3)写出“步骤4”生成GeO2·nH2O反应的化学方程式
(4)查阅资料得知:“步骤4”生成的GeO2·nH2O实为GeO2·H2O,其在5.0mol·L-1的盐酸中溶解度最小。取10.0mLGeCl4和高纯水反应,欲使GeO2·H2O的产率最高,加入高纯水的体积约为
您最近一年使用:0次
【推荐1】下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
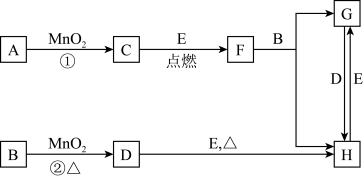
(1)写出有关物质的名称或化学式:F_______ ,H______ 。
若反应①是在加热条件下进行,则A是______________ ;若反应①是在常温条件下进行,则A是________________ 。
(2)写出B与MnO2共热获得D的离子方程式_______________________ 。
(3)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10-4mol/L ,则生成沉淀所需AgNO3溶液的最小浓度为________ 。若向AgX悬浊液中滴加KI溶液,观察到的现象______________ ,沉淀能够发生转化的原因是_________________________ 。

(1)写出有关物质的名称或化学式:F
若反应①是在加热条件下进行,则A是
(2)写出B与MnO2共热获得D的离子方程式
(3)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10-4mol/L ,则生成沉淀所需AgNO3溶液的最小浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
(1) 探究 BaCO3和 BaSO4之间的转化
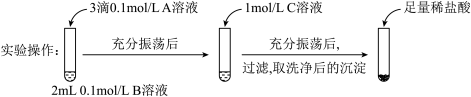
①实验I 说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,__________________ 。
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是__________________________________ 。
③实验Ⅱ 中加入试剂C后,沉淀转化的平衡常数表达式 K =___________ 。
(2)探究AgCl和AgI之间的转化

实验 Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数: a >c>b > 0)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是________ (填标号)。
a AgNO3溶液 b NaCl 溶液 c KI溶液
②实验Ⅳ的步骤i中, B中石墨上的电极反应式是___________________________ 。
③结合信息,解释实验Ⅳ中 b < a 的原因_____________________ 。
④实验Ⅳ的现象能说明 AgI转化为AgCl,理由是_____________________ 。
(3)综合实验Ⅰ~ Ⅳ,可得出的结论是________________________________________ 。
| 物质 | BaSO4 | BaCO3 | AgI | AgCl |
| 溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1) 探究 BaCO3和 BaSO4之间的转化

| 试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
| 实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
| 实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验I 说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是
③实验Ⅱ 中加入试剂C后,沉淀转化的平衡常数表达式 K =
(2)探究AgCl和AgI之间的转化

实验 Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数: a >c>b > 0)。
| 装置 | 步骤 | 电压表读数 |
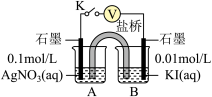 | ⅰ.如图连接装置并加入试剂,闭合 K | a |
| ⅱ.向 B 中滴入AgNO3(aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| ⅳ.重复i,再向B中加入与ⅲ等量NaCl (s) | d |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是
a AgNO3溶液 b NaCl 溶液 c KI溶液
②实验Ⅳ的步骤i中, B中石墨上的电极反应式是
③结合信息,解释实验Ⅳ中 b < a 的原因
④实验Ⅳ的现象能说明 AgI转化为AgCl,理由是
(3)综合实验Ⅰ~ Ⅳ,可得出的结论是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】从海水中提取镁是获得镁的主要来源,如表所示是制取镁的过程中涉及的几种物质的 。
。
回答下列问题:
(1)从海水中提取镁时,往往用到贝壳(主要成分是 ),你认为
),你认为________ (填“能”或“不能”)直接把贝壳研磨成粉末撒入海水中,使 转化为
转化为 沉淀,原因是
沉淀,原因是_________ 。
(2)实际生产中是把 转化为
转化为 沉淀,而不是转化为
沉淀,而不是转化为 沉淀,原因是
沉淀,原因是_______ ,请你推测应将贝壳进行怎样的加工处理:_____ 。
(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在混合体系中加入过量的烧碱溶液,你觉得他__________ (填“能”或“不能”)将 转化为
转化为 沉淀,理由是
沉淀,理由是_________ 。
(4)过滤出 沉淀后,用试剂
沉淀后,用试剂_________ (填化学式)将其溶解,选择该试剂的理由是________ 。
(5)将得到的 溶液在浓缩池中制得
溶液在浓缩池中制得 。然后将
。然后将 转移到干燥塔中,在干燥的
转移到干燥塔中,在干燥的 气流中加热
气流中加热 ,才能得到无水
,才能得到无水 ,原因是
,原因是________ 。
 。
。| 物质 |  |  |  |  |
 数值 数值 | 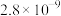 | 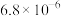 | 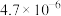 |  |
回答下列问题:
(1)从海水中提取镁时,往往用到贝壳(主要成分是
 ),你认为
),你认为 转化为
转化为 沉淀,原因是
沉淀,原因是(2)实际生产中是把
 转化为
转化为 沉淀,而不是转化为
沉淀,而不是转化为 沉淀,原因是
沉淀,原因是(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在混合体系中加入过量的烧碱溶液,你觉得他
 转化为
转化为 沉淀,理由是
沉淀,理由是(4)过滤出
 沉淀后,用试剂
沉淀后,用试剂(5)将得到的
 溶液在浓缩池中制得
溶液在浓缩池中制得 。然后将
。然后将 转移到干燥塔中,在干燥的
转移到干燥塔中,在干燥的 气流中加热
气流中加热 ,才能得到无水
,才能得到无水 ,原因是
,原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以粉煤灰(主要成分为Al2O3、SiO2、含少量Fe2O3)为原料,制取Al2O3部分工艺流程如下:
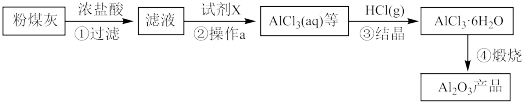
已知25℃时:Ksp[Al(OH)3]=1×10−33,Ksp[Fe(OH)3]=1×10−38,当离子浓度低于10−5 mol·L−1时认为沉淀完全。
(1)粉煤灰加入到NaOH溶液中,反应后所得溶液中溶质有过量的NaOH、_______ (填化学式)。
(2)“操作a”的名称是_______ 。
(3)为达步骤②的目的,控制pH的最小值是_______ 。
(4)步骤③“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因是_______ 。
(5)上述流程可循环利用的物质是_______ 。(填化学式)。
(6)工业上通过产品Al2O3制取铝单质的化学方程式是_______ 。
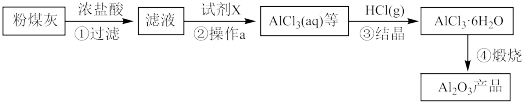
已知25℃时:Ksp[Al(OH)3]=1×10−33,Ksp[Fe(OH)3]=1×10−38,当离子浓度低于10−5 mol·L−1时认为沉淀完全。
(1)粉煤灰加入到NaOH溶液中,反应后所得溶液中溶质有过量的NaOH、
(2)“操作a”的名称是
(3)为达步骤②的目的,控制pH的最小值是
(4)步骤③“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因是
(5)上述流程可循环利用的物质是
(6)工业上通过产品Al2O3制取铝单质的化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铍铜是广泛应用于制造高级弹性元件的良好合金,某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收和铜两种金属的工艺流程如下:
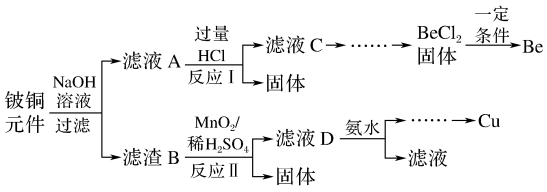
已知:I.铍、铝元素化学性质相似
II.常温下部分难溶物的溶度积常数如下表
(1)滤液A的主要成分除NaOH外,还有____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:_______ 。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为____ 。
a.加入过量的氨水 b.通入过量的CO2 C.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是_____ 。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:___ 。
②若用浓HNO3溶解金属硫化物,缺点是_______ (任写一条)
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于_______ 。
(5)用石墨电极电解NaCl-BeCl2混合熔盐可制备金属铍,
①阴极上得到Be的电极反应式为_____ 。
②电解得到的Be蒸气中约含1%的Na热气除去Be中少量Na的方法为_____ 。
已知部分物质的熔、沸点如下表:

已知:I.铍、铝元素化学性质相似
II.常温下部分难溶物的溶度积常数如下表
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为
a.加入过量的氨水 b.通入过量的CO2 C.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:
②若用浓HNO3溶解金属硫化物,缺点是
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是
(5)用石墨电极电解NaCl-BeCl2混合熔盐可制备金属铍,
①阴极上得到Be的电极反应式为
②电解得到的Be蒸气中约含1%的Na热气除去Be中少量Na的方法为
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
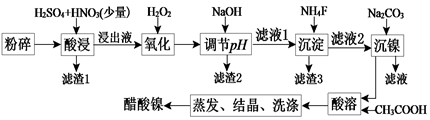
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是________________ 。
(2)调节pH步骤中,溶液pH的调节范围是__________________________________ 。
(3)滤渣1和滤渣3主要成分的化学式分别是________________ ,_____________ 。
(4)氧化步骤中加入H2O2发生反应的离子方程式为____________________________ 。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为____________________ 。
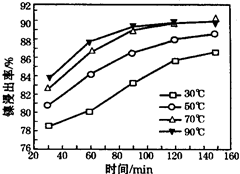
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:_______ ℃、_______ min。
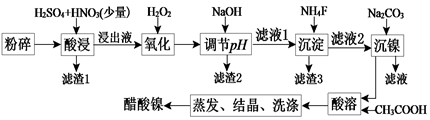
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
| 金属离子 | 开始沉淀pH | 沉淀完全pH | 物质 | 20℃溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-6 |
(2)调节pH步骤中,溶液pH的调节范围是
(3)滤渣1和滤渣3主要成分的化学式分别是

(4)氧化步骤中加入H2O2发生反应的离子方程式为
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:
您最近一年使用:0次



