A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层电子数比次外层多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;D和E的原子序数和为30;在元素周期表中,C是E的不同周期邻族元素。五种元素两两形成的化合物有甲、乙、两、丁四种分子中原子个数比如下表:
(1)写出元素符号:B___________ ,E___________ 。
(2)A元素某原子核内中子数比质子数多1,则该核素的组成符号为___________ 。物质丁的分子为___________ 分子(填“极性”或“非极性”)。
(3)向甲的水溶液中加入MnO2,氧化产物是___________ 。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为___________ 。
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个比 | A∶C=1∶1 | B∶A=1∶2 | D∶E=1∶3 | B∶E=1∶4 |
(1)写出元素符号:B
(2)A元素某原子核内中子数比质子数多1,则该核素的组成符号为
(3)向甲的水溶液中加入MnO2,氧化产物是
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为
更新时间:2024-04-30 16:32:15
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
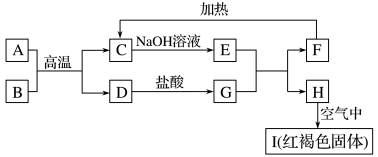
【推荐1】已知A~I均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中需要或生成的水及其他部分产物已略去。
回答下列问题:
(1)写出F的化学式_______
(2)①A能与氢氧化钠溶液反应,写出反应的离子方程式_______
②A与B在高温下反应的化学方程式_______
写出该反应的一个用途_______
③H在空气中转化为I的化学方程式_______
(3)已知E呈碱性,E溶液中所有离子浓度由大到小的顺序是_______
(4)用离子方程式表示G溶液呈酸性的原因_______

回答下列问题:
(1)写出F的化学式
(2)①A能与氢氧化钠溶液反应,写出反应的离子方程式
②A与B在高温下反应的化学方程式
写出该反应的一个用途
③H在空气中转化为I的化学方程式
(3)已知E呈碱性,E溶液中所有离子浓度由大到小的顺序是
(4)用离子方程式表示G溶液呈酸性的原因
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】资料显示Fe2+呈淡绿色、Fe3+呈棕黄色、FeSO3是墨绿色沉淀、Fe(OH)3胶体是红褐色液体。某高三老师在讲授“Fe3+的氧化性”时,组织学生进行探究实验。
(1)在课堂教学探究Na2SO3溶液与FeCl3溶液的实际反应时,同学们有以下猜想,请补充完整:
猜想一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生双水解反应,产生了Fe(OH)3胶体;
猜想三:___________________________________________________________________ 。
(2)甲同学认可猜想一,他预测的实验现象是___________________ ,其反应的离子方程式为______________________________
老师安排甲同学做了如下实验i:

(3)乙同学观察实验现象后认为猜想二合理,并想用红色激光笔照射该红褐色液体以验证自己的猜想正确,他预测的现象是____________________ 。实验发现,乙同学的猜想成立,反应的离子方程式为____________________________________ 。
(4)针对“氧化还原反应有没有发生”,老师组织同学们讨论,同学们思考得出以下检验方案:
方案①:取少量W液体,加铁氰化钾溶液,检验是否有Fe2+
方案②:取少量W液体,加酸性高锰酸钾溶液,检验是否有Fe2+
方案③:取少量W液体,加盐酸酸化,再加氯化钡溶液,检验是否有SO42-
你认为方案②____________ (填“合理”或“不合理”),你的理由是__________________
甲同学在老师的指导下迅速完成了实验ii:

乙同学也在老师的指导下完成了方案①的操作,发现有蓝色沉淀生成。
(5)通过实验探究,大家认识到Fe3+与SO32-的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。老师进一步启发同学们思考能否通过测定溶液中某粒子的量来定量判断反应进行的程度大小,并设计了如下定量测定实验,测定溶液中未被氧化的Ⅳ价S元素(H2SO3、SO32-、HSO3-)的含量:取10mL0.10mol·L-l的Na2SO3溶液,加入FeCl3溶液充分反应,再向充分反应后的混合液中加入10mL0.10mol·L-l的I2溶液,向其中逐滴滴加0.10mol·L-l的Na2S2O3溶液,连接电位传感器进行电位滴定,反应方程式为I2+2S2O32-=2I-+S4O62-,达到终点时平均消耗18.43mLNa2S2O3溶液。通过计算,得出溶液中未被氧化的Ⅳ价S元素(H2SO3、SO32-、HSO3-) 的含量为_______________ (保留两位有效数字)
(1)在课堂教学探究Na2SO3溶液与FeCl3溶液的实际反应时,同学们有以下猜想,请补充完整:
猜想一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生双水解反应,产生了Fe(OH)3胶体;
猜想三:
(2)甲同学认可猜想一,他预测的实验现象是
老师安排甲同学做了如下实验i:

(3)乙同学观察实验现象后认为猜想二合理,并想用红色激光笔照射该红褐色液体以验证自己的猜想正确,他预测的现象是
(4)针对“氧化还原反应有没有发生”,老师组织同学们讨论,同学们思考得出以下检验方案:
方案①:取少量W液体,加铁氰化钾溶液,检验是否有Fe2+
方案②:取少量W液体,加酸性高锰酸钾溶液,检验是否有Fe2+
方案③:取少量W液体,加盐酸酸化,再加氯化钡溶液,检验是否有SO42-
你认为方案②
甲同学在老师的指导下迅速完成了实验ii:

乙同学也在老师的指导下完成了方案①的操作,发现有蓝色沉淀生成。
(5)通过实验探究,大家认识到Fe3+与SO32-的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。老师进一步启发同学们思考能否通过测定溶液中某粒子的量来定量判断反应进行的程度大小,并设计了如下定量测定实验,测定溶液中未被氧化的Ⅳ价S元素(H2SO3、SO32-、HSO3-)的含量:取10mL0.10mol·L-l的Na2SO3溶液,加入FeCl3溶液充分反应,再向充分反应后的混合液中加入10mL0.10mol·L-l的I2溶液,向其中逐滴滴加0.10mol·L-l的Na2S2O3溶液,连接电位传感器进行电位滴定,反应方程式为I2+2S2O32-=2I-+S4O62-,达到终点时平均消耗18.43mLNa2S2O3溶液。通过计算,得出溶液中未被氧化的Ⅳ价S元素(H2SO3、SO32-、HSO3-) 的含量为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
①0.1mol/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN—)____ c(HCO )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa、B.NaCN、C.Na2CO3,其pH由大到小的顺序是_____ (填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____ 。
④室温下,一定浓度的CH3COONa溶液pH=9,溶液中 =
=____ 。
(2)某温度下,pH=3的盐酸中c(OH—)=10-9mol/L。该温度下,pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为____ 。
(3)盐类的水解在日常生活和工农业生产中有很重要的应用,请根据要求回答下列问题。
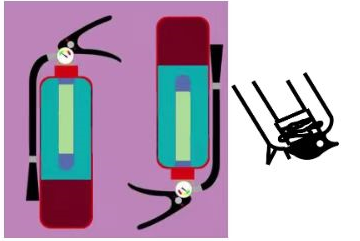
①氟化钠溶液在实验室保存时不能使用玻璃瓶,请用化学方程式说明原因____ 。
②泡沫灭火器中的药品是NaHCO3、Al2(SO4)3,用离子方程式表示泡沫灭火器的原理____ 。外筒的材质是铁,内筒是玻璃,则外筒应该盛放____ 溶液。
(1)已知部分弱酸的电离常数如表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
 )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。②常温下,物质的量浓度相同的三种溶液:A.CH3COONa、B.NaCN、C.Na2CO3,其pH由大到小的顺序是
③将少量CO2通入NaCN溶液,反应的离子方程式是
④室温下,一定浓度的CH3COONa溶液pH=9,溶液中
 =
=(2)某温度下,pH=3的盐酸中c(OH—)=10-9mol/L。该温度下,pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为
(3)盐类的水解在日常生活和工农业生产中有很重要的应用,请根据要求回答下列问题。

①氟化钠溶液在实验室保存时不能使用玻璃瓶,请用化学方程式说明原因
②泡沫灭火器中的药品是NaHCO3、Al2(SO4)3,用离子方程式表示泡沫灭火器的原理
您最近半年使用:0次
【推荐1】W、X、Y、Z、M、Q是原子序数依次增大的前四周期元素,其元素性质或原子结构如下表所示。
(1)W、Z、Q的元素符号分别为_______ 、_______ 、_______ 。
(2)X的基态原子有_______ 种空间运动状态不同的电子,其中能量最高的电子所占据的原子轨道呈_______ 形。
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有_______ 种。
(4)M位于元素周期表的_______ 区, 简化的电子排布式为
简化的电子排布式为_______ 。
(5)Q位于元素周期表的第_______ 周期_______ 族,其价层电子排布图为_______
(6)W、X、Y、Z的电负性由大到小的顺序为_______ (填元素符号)。
| 元素 | 元素性质或原子结构 | ||||||||||||||||||
| W | 电子只有一种自旋取向 | ||||||||||||||||||
| X | 最外层电子排布式为 | ||||||||||||||||||
| Y | 非金属元素,且s能级上的电子总数与p能级上的电子总数相等 | ||||||||||||||||||
| Z |
| ||||||||||||||||||
| M | 前四周期元素中原子核外未成对电子数最多 | ||||||||||||||||||
| Q | 与X同主族 | ||||||||||||||||||
(2)X的基态原子有
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有
(4)M位于元素周期表的
 简化的电子排布式为
简化的电子排布式为(5)Q位于元素周期表的第
(6)W、X、Y、Z的电负性由大到小的顺序为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】周期表中前四周期元素R、W、X、Y、Z的原子序数依次增大。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)YX 的立体构型是
的立体构型是____________ ;与YX 互为等电子体的一种分子为
互为等电子体的一种分子为________ (填化学式)。
(2)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为_______ ;1 mol RX(WH2)2分子中含有σ键数目为________ 。(H为氢元素,下同)
(3)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为_______ 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于____ (填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则该晶体中Z原子和Y原子之间的最短距离为________ cm(只写计算式)(Z原子位于体对角线上)。
(1)YX
 的立体构型是
的立体构型是 互为等电子体的一种分子为
互为等电子体的一种分子为(2)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为
(3)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于
③已知该晶体的密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则该晶体中Z原子和Y原子之间的最短距离为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和 的核外电子数相差1;在Z所在的周期中,Z元素的原子得电子能力最强;四种元素的最外层电子数之和为18,请回答下列问题:
的核外电子数相差1;在Z所在的周期中,Z元素的原子得电子能力最强;四种元素的最外层电子数之和为18,请回答下列问题:
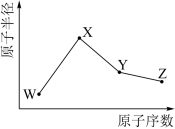
(1)X元素位于元素周期表中位置为_______ 。
(2)Z所在族的简单氢化物中,沸点最高的是_______ (写化学式),原因为_______ 。
(3)W、Ⅹ、Z三种元素形成的一种具有杀菌消毒作用的化合物中化学键类型为_______ ;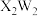 的电子式为
的电子式为_______ 。
(4)Y与Z形成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为_______ 。
 的核外电子数相差1;在Z所在的周期中,Z元素的原子得电子能力最强;四种元素的最外层电子数之和为18,请回答下列问题:
的核外电子数相差1;在Z所在的周期中,Z元素的原子得电子能力最强;四种元素的最外层电子数之和为18,请回答下列问题:
(1)X元素位于元素周期表中位置为
(2)Z所在族的简单氢化物中,沸点最高的是
(3)W、Ⅹ、Z三种元素形成的一种具有杀菌消毒作用的化合物中化学键类型为
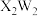 的电子式为
的电子式为(4)Y与Z形成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】完成下列问题
(1)四卤化硅( )的沸点和二卤化铅(
)的沸点和二卤化铅( )的熔点如图所示
)的熔点如图所示

① 的沸点依
的沸点依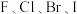 次序升高的原因是
次序升高的原因是_______ 。
②结合 的沸点和
的沸点和 的熔点变化规律,可推断:依
的熔点变化规律,可推断:依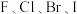 次序,
次序, 晶体中离子键百分数
晶体中离子键百分数_______ (填“增大”、“不变”或“减小”)。
(2)铍及其化合物的应用正日益被重视
①铍与相邻主族的铝元素性质相似。下列有关和铝的叙述正确的有_______ 。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液 均小于7
均小于7
②氯化铍在气态时存在 单分子——a和二聚分子
单分子——a和二聚分子 ——b,固态时则具有如下图所示的链状结构——c
——b,固态时则具有如下图所示的链状结构——c

a属于_______ (填“极性”或“非极性”)分子,二聚分子 中
中 原子的杂化方式相同,且所有原子都在同一平面上,b的结构式为
原子的杂化方式相同,且所有原子都在同一平面上,b的结构式为_______ 。
③ 立方晶胞如下图所示。
立方晶胞如下图所示。

阿伏加德罗常数的数值为 ,若
,若 晶体的密度为
晶体的密度为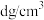 ,则
,则 和
和 之间最近的距离为
之间最近的距离为_______  。
。
(1)四卤化硅(
 )的沸点和二卤化铅(
)的沸点和二卤化铅( )的熔点如图所示
)的熔点如图所示
①
 的沸点依
的沸点依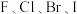 次序升高的原因是
次序升高的原因是②结合
 的沸点和
的沸点和 的熔点变化规律,可推断:依
的熔点变化规律,可推断:依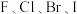 次序,
次序, 晶体中离子键百分数
晶体中离子键百分数(2)铍及其化合物的应用正日益被重视
①铍与相邻主族的铝元素性质相似。下列有关和铝的叙述正确的有
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液
 均小于7
均小于7②氯化铍在气态时存在
 单分子——a和二聚分子
单分子——a和二聚分子 ——b,固态时则具有如下图所示的链状结构——c
——b,固态时则具有如下图所示的链状结构——c
a属于
 中
中 原子的杂化方式相同,且所有原子都在同一平面上,b的结构式为
原子的杂化方式相同,且所有原子都在同一平面上,b的结构式为③
 立方晶胞如下图所示。
立方晶胞如下图所示。
阿伏加德罗常数的数值为
 ,若
,若 晶体的密度为
晶体的密度为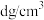 ,则
,则 和
和 之间最近的距离为
之间最近的距离为 。
。
您最近半年使用:0次
【推荐2】钴及其化合物在催化剂、磁性材料、电池等领域应用十分广泛。回答下列问题:
(1)纳米氧化钴可以在室温下将甲醛完全催化氧化为 和
和 。
。
①基态钴原子的核外价层电子排布式为___________ 。
②甲醛分子中三种元素电负性由大到小的顺序为___________ (填元素符号);甲醛分子的立体构型为___________ ;分子中 键与
键与 键数目比为
键数目比为___________ 。
(2) 是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是
是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是___________ , 是
是___________ (填“极性”或“非极性”)分子。
(3) 可用作锂离子电池的电极材料。在元素周期表中,与
可用作锂离子电池的电极材料。在元素周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ (填元素符号),该元素基态原子核外M层电子的自旋状态___________ (填“相同”或“相反”); 的熔点为848℃,属于
的熔点为848℃,属于___________ 晶体。
(4)某钴化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图,已知晶胞参数为 ,则此晶体密度为(列出计算式即可)
,则此晶体密度为(列出计算式即可)___________  。(
。( 代表阿伏伽德罗常数)
代表阿伏伽德罗常数)

(1)纳米氧化钴可以在室温下将甲醛完全催化氧化为
 和
和 。
。①基态钴原子的核外价层电子排布式为
②甲醛分子中三种元素电负性由大到小的顺序为
 键与
键与 键数目比为
键数目比为(2)
 是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是
是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是 是
是(3)
 可用作锂离子电池的电极材料。在元素周期表中,与
可用作锂离子电池的电极材料。在元素周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是 的熔点为848℃,属于
的熔点为848℃,属于(4)某钴化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图,已知晶胞参数为
 ,则此晶体密度为(列出计算式即可)
,则此晶体密度为(列出计算式即可) 。(
。( 代表阿伏伽德罗常数)
代表阿伏伽德罗常数)
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其相关结构或性质信息如下表所示。
(1)Q元素基态原子的电子排布式是___________ 。
(2)比较Y元素与氧元素的第一电离能___________ >___________ (填元素符号);X和Z形成的化合物XZ2为一种液体溶剂,其分子中的σ键和π键数目之比为___________ ,该化合物___________ 溶于水(填“易”或“难”)。
(3)Y的最简单氢化物分子中含有___________ 共价键(填“极性”或“非极性”,下同),是___________ 分子,电子式为___________ 。
(4)M的气态氢化物和氟化氢相比(填写化学式,并从微粒间作用力的角度分析原因),稳定性强的是___________ ,其原因是___________ ;沸点高的是___________ ,其原因是___________ 。
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体,基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
(2)比较Y元素与氧元素的第一电离能
(3)Y的最简单氢化物分子中含有
(4)M的气态氢化物和氟化氢相比(填写化学式,并从微粒间作用力的角度分析原因),稳定性强的是
您最近半年使用:0次