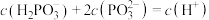部分弱电解质的电离平衡常数如下表:
下列说法不正确的是
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3·H2O |
| 电离平衡常数 (25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力: >CN-> >CN-> >HCOO- >HCOO- |
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c( )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) |
D.0.1mol/L的NaHCO3溶液中:c(Na+)+ c(H+)=c( )+c(OH-)+c( )+c(OH-)+c( ) ) |
更新时间:2015-05-11 17:09:57
|
相似题推荐
单选题
|
困难
(0.15)
名校
解题方法
【推荐1】已知 ℃时,
℃时,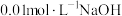 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为
 ℃时,
℃时,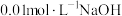 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为A.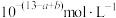 | B. |
C.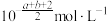 | D.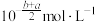 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐1】室温下,下列溶液中粒子浓度大小关系正确的是
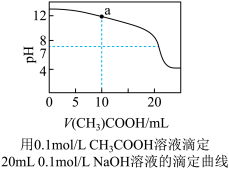

A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO )>c(HCO )>c(HCO )>c(OH-) )>c(OH-) |
| B.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① |
| C.0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐2】常温下,向0.1mol•L-1的乙二胺(H2NCH2CH2NH2)溶液中不断通入HCl气体,溶液中三种含氮微粒的物质的量分数δ与pOH的关系图如图。已知:①乙二胺为无色液体,有类似氨的性质,常温下Kb1=10-4.07,Kb2=10-7.15;②假设溶液体积保持不变。下列说法中不正确 的是{已知:pOH=-lgc(OH-)}
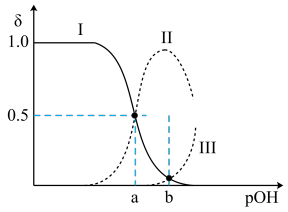

A.曲线Ⅱ代表的微粒符号为H2NCH2CH2NH |
| B.b点的对应pOH=5.61 |
| C.pOH=a时,c(Cl-)>0.05mol•L-1 |
| D.在0.1mol•L-1H2NCH2CH2NH3Cl溶液中:c([H2NCH2CH2NH3]+)>c([H3NCH2CH2NH3]2+)>c(H2NCH2CH2NH2) |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐3】电位滴定法(potentiometric titration)是在滴定过程中通过测量电位变化以确定滴定终点的方法,当电极电位(ERC)产生了突跃,被测离子浓度产生突跃,进而确定滴定终点。向10mL 0.1
 溶液(
溶液( 为二元弱酸)中逐滴滴加0.1
为二元弱酸)中逐滴滴加0.1 二元酸
二元酸 溶液,第一个电位突跃时消耗a mL
溶液,第一个电位突跃时消耗a mL 溶液,第二个电位突跃时又消耗b mL
溶液,第二个电位突跃时又消耗b mL 溶液,根据消耗
溶液,根据消耗 溶液体积,可判断
溶液体积,可判断 和
和 各级电离常数大小关系。下列说法错误的是
各级电离常数大小关系。下列说法错误的是

 溶液(
溶液( 为二元弱酸)中逐滴滴加0.1
为二元弱酸)中逐滴滴加0.1 二元酸
二元酸 溶液,第一个电位突跃时消耗a mL
溶液,第一个电位突跃时消耗a mL 溶液,第二个电位突跃时又消耗b mL
溶液,第二个电位突跃时又消耗b mL 溶液,根据消耗
溶液,根据消耗 溶液体积,可判断
溶液体积,可判断 和
和 各级电离常数大小关系。下列说法错误的是
各级电离常数大小关系。下列说法错误的是A.若a=5mL、b=5mL, 可能为强酸 可能为强酸 |
B.若a=5mL、b=15mL,则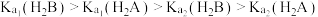 |
C.若a=5mL、b=15mL,第一个电位突跃时,溶液中: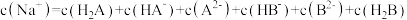 |
D.若a=10mL、b=10mL,则用0.1  溶液滴定10mL 0.1 溶液滴定10mL 0.1 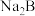 溶液,只有一个电位突跃 溶液,只有一个电位突跃 |
您最近一年使用:0次
单选题
|
困难
(0.15)
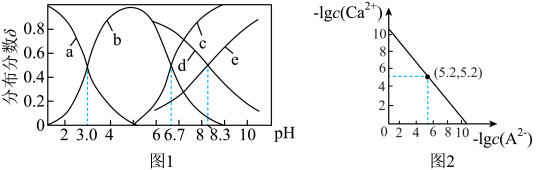
【推荐1】已知常温下水溶液中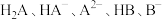 的分布分数
的分布分数 [如
[如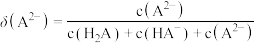 表示
表示 的分布分数]随
的分布分数]随 变化曲线如图1;溶液中
变化曲线如图1;溶液中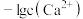 和
和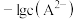 关系如图2。用
关系如图2。用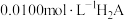 溶液滴定
溶液滴定 溶液,下列说法错误的是
溶液,下列说法错误的是
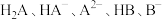 的分布分数
的分布分数 [如
[如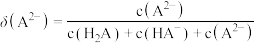 表示
表示 的分布分数]随
的分布分数]随 变化曲线如图1;溶液中
变化曲线如图1;溶液中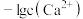 和
和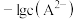 关系如图2。用
关系如图2。用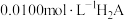 溶液滴定
溶液滴定 溶液,下列说法错误的是
溶液,下列说法错误的是
A.曲线a表示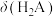 |
B.酸性: |
C.滴定过程中溶液会有 沉淀, 沉淀, |
D.滴定过程中始终存在: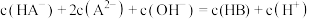 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐2】常温下,向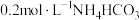 溶液中逐滴滴入NaOH溶液并恢复至常温,溶液中
溶液中逐滴滴入NaOH溶液并恢复至常温,溶液中 、
、 、
、 、
、 的分布比例如图(忽略溶液体积的变化)。已知常温下
的分布比例如图(忽略溶液体积的变化)。已知常温下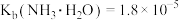 ,
,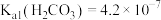 ,
,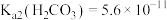 。下列说法错误的是
。下列说法错误的是
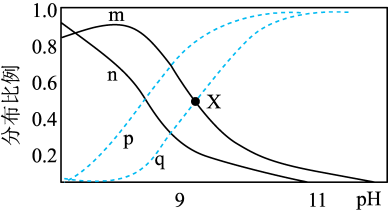
 溶液中逐滴滴入NaOH溶液并恢复至常温,溶液中
溶液中逐滴滴入NaOH溶液并恢复至常温,溶液中 、
、 、
、 、
、 的分布比例如图(忽略溶液体积的变化)。已知常温下
的分布比例如图(忽略溶液体积的变化)。已知常温下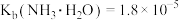 ,
,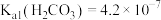 ,
,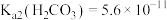 。下列说法错误的是
。下列说法错误的是
A.曲线m表示的是 的变化 的变化 |
B. 比 比 更易于与 更易于与 离子反应 离子反应 |
C.溶液中任意一点存在: |
D.X点溶液中: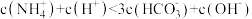 |
您最近一年使用:0次

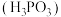 常温下电离平衡常数
常温下电离平衡常数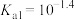 ,
, 。常温下,向
。常温下,向
 溶液中滴加
溶液中滴加 和溶液
和溶液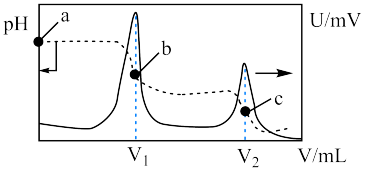
 点对应的溶液中:
点对应的溶液中: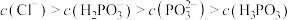
 点溶液中存在
点溶液中存在