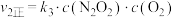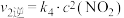已知NO2和N2O4之间发生可逆反应: 2NO2 (g) (红棕色)  N2O4(g) (无色)
N2O4(g) (无色)
(1)在烧瓶A和B中盛有相同浓度的NO2与N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。
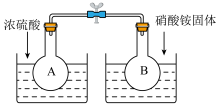
分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中_____________ 。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生__________ 。
(2)下图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是_______________________ 。
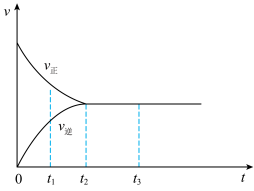
a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某容积2L的密闭容器中充入一定量的NO2和N2O4的混合气体,在一定温度压强下,两者物质的量随时间变化如图所示。
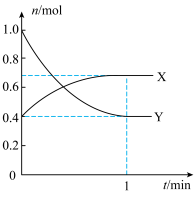
①表示NO2变化的曲线是___ (填“X”或“Y”)。
②在0到1 min内用Y的浓度变化表示的该反应的
反应速率是___ mol·L-1·min-1
 N2O4(g) (无色)
N2O4(g) (无色)(1)在烧瓶A和B中盛有相同浓度的NO2与N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。

分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中
(2)下图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是

a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某容积2L的密闭容器中充入一定量的NO2和N2O4的混合气体,在一定温度压强下,两者物质的量随时间变化如图所示。

①表示NO2变化的曲线是
②在0到1 min内用Y的浓度变化表示的该反应的
反应速率是
更新时间:2019/01/30 18:14:09
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】由γ-丁酸生成γ-丁内酯的反应如下:HOCH2CH2CH2COOH
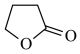 +H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
(1)该反应在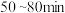 内的平均反应速率为
内的平均反应速率为_______  。
。
(2)该反应化学平衡常数K的表达式是_______ ,298K时该反应的平衡常数K=_______ 。
(3)求120min时γ-羟基丁酸的转化率为_______ (请写出计算过程,注意格式规范)
(4)为提高γ-羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是_______

 +H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题: | 21 | 50 | 80 | 100 | 120 | 160 | 220 |  |
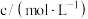 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
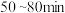 内的平均反应速率为
内的平均反应速率为 。
。(2)该反应化学平衡常数K的表达式是
(3)求120min时γ-羟基丁酸的转化率为
(4)为提高γ-羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐2】砷(As)元素广泛的存在于自然界。金属冶炼过程产生的含砷有毒工业废水经处理转化为粗As2O3流程如图所示。

已知:砷酸盐比亚砷酸盐更难溶。H3AsO3受热易分解为As2O3。
(1)H3AsO3溶液中各组分的物质的量分数随pH变化如图所示:

用NaOH溶液调节pH至11时亚砷酸主要反应的离子方程式为____ 。
(2)通入空气氧化的目的为____ 。
(3)滤渣的主要成分为____ 。
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
①Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq) ΔH<0
②5Ca2+(aq)+OH-(aq)+3 (aq)⇌Ca5(AsO4)3OH(s) ΔH>0
(aq)⇌Ca5(AsO4)3OH(s) ΔH>0
资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是____ 。
(5)还原过程中发生反应的化学方程式为____ 。
(6)上述流程中可循环使用的物质为____ (填写化学式)。

已知:砷酸盐比亚砷酸盐更难溶。H3AsO3受热易分解为As2O3。
(1)H3AsO3溶液中各组分的物质的量分数随pH变化如图所示:

用NaOH溶液调节pH至11时亚砷酸主要反应的离子方程式为
(2)通入空气氧化的目的为
(3)滤渣的主要成分为
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
①Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq) ΔH<0
②5Ca2+(aq)+OH-(aq)+3
 (aq)⇌Ca5(AsO4)3OH(s) ΔH>0
(aq)⇌Ca5(AsO4)3OH(s) ΔH>0资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是
(5)还原过程中发生反应的化学方程式为
(6)上述流程中可循环使用的物质为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】我国提出争取在2030年前实现碳达峰、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。将CO2转化为清洁能源是实现碳中和最直接有效的方法。
方法一:H2还原CO2制取CH4.其反应体系中,主要发生反应的热化学方程式有:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=−164.7 kJ∙mol−1
CH4(g)+2H2O(g) ΔH1=−164.7 kJ∙mol−1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ∙mol−1
CO(g)+H2O(g) ΔH2=+41.2 kJ∙mol−1
反应III:2CO(g)+2H2(g) CO2(g)+CH4(g) ΔH3=−247.1 kJ∙mol−1
CO2(g)+CH4(g) ΔH3=−247.1 kJ∙mol−1
(1)利用上述反应计算CO(g)+3H2(g) CH4(g)+H2O(g)的ΔH
CH4(g)+H2O(g)的ΔH_______ ,已知ΔG=ΔH−TΔS,忽略ΔH、ΔS随温度的变化,若ΔG<0反应自发,则该反应一般在_______ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)向恒压、密闭容器中通入1molCO2和4molH2,平衡时体系内CH4、CO、CO2的物质的量(n)与温度(T)的变化关互系如图所示。

①结合上述反应,解释图中CO2的物质的量随温度的升高先增大后减小的原因:_______ ;
②一定条件下,经tmin平衡后,n(CO)=0.15mol,n(CO2)=0.25mol,甲烷的选择性(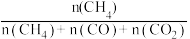 ×100%)=
×100%)=_______ ;
③在实际生产中为了提高化学反应速率和甲烷的选择性,应当_______ 。
方法二:H2还原CO2制取CH3OH。反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH4
CH3OH(g)+H2O(g) ΔH4
(3)CO2催化加氢制CH3OH的一种反应机理历程如图所示(吸附在催化剂表面的物质用“*”标注,如“*CO2”表示CO2吸附在催化剂表面,图中*H已省略)

该反应历程中决速步反应能垒为_______ eV,为避免产生副产物,工艺生产的温度应适当_______ (填“升高”或“降低”)。
(4)已知速率方程υ正=k正·c(CO2)·c3(H2),υ逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度(T)影响。如图表示速率常数的对数lgk与温度的倒数 之间的关系,则ΔH4
之间的关系,则ΔH4_______ 0(填“>”“<”或“=”)。

方法一:H2还原CO2制取CH4.其反应体系中,主要发生反应的热化学方程式有:
反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH1=−164.7 kJ∙mol−1
CH4(g)+2H2O(g) ΔH1=−164.7 kJ∙mol−1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2 kJ∙mol−1
CO(g)+H2O(g) ΔH2=+41.2 kJ∙mol−1反应III:2CO(g)+2H2(g)
 CO2(g)+CH4(g) ΔH3=−247.1 kJ∙mol−1
CO2(g)+CH4(g) ΔH3=−247.1 kJ∙mol−1(1)利用上述反应计算CO(g)+3H2(g)
 CH4(g)+H2O(g)的ΔH
CH4(g)+H2O(g)的ΔH(2)向恒压、密闭容器中通入1molCO2和4molH2,平衡时体系内CH4、CO、CO2的物质的量(n)与温度(T)的变化关互系如图所示。

①结合上述反应,解释图中CO2的物质的量随温度的升高先增大后减小的原因:
②一定条件下,经tmin平衡后,n(CO)=0.15mol,n(CO2)=0.25mol,甲烷的选择性(
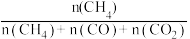 ×100%)=
×100%)=③在实际生产中为了提高化学反应速率和甲烷的选择性,应当
方法二:H2还原CO2制取CH3OH。反应原理为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH4
CH3OH(g)+H2O(g) ΔH4(3)CO2催化加氢制CH3OH的一种反应机理历程如图所示(吸附在催化剂表面的物质用“*”标注,如“*CO2”表示CO2吸附在催化剂表面,图中*H已省略)

该反应历程中决速步反应能垒为
(4)已知速率方程υ正=k正·c(CO2)·c3(H2),υ逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度(T)影响。如图表示速率常数的对数lgk与温度的倒数
 之间的关系,则ΔH4
之间的关系,则ΔH4
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐1】 的回收和综合利用有利于实现“碳中和”。在催化剂作用下,
的回收和综合利用有利于实现“碳中和”。在催化剂作用下, 、
、 同时发生如下反应:
同时发生如下反应:
反应Ⅰ:
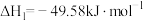
反应Ⅱ:
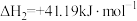
请回答:
(1)反应Ⅰ能自发进行的条件是_______ 。
(2)压强平衡常数(用平衡分压代替平衡浓度,分压=总压×物质的量分数)的对数 与温度倒数
与温度倒数 呈线性关系,如图1所示。其中表示反应Ⅰ的变化曲线为
呈线性关系,如图1所示。其中表示反应Ⅰ的变化曲线为_______ (填“ ”或“
”或“ ”)。
”)。

(3)若 和
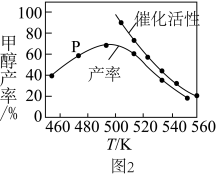
和 按一定比例在装有催化剂的反应器中发生反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图2所示。490K之后甲醇产率下降,其变化的原因是
按一定比例在装有催化剂的反应器中发生反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图2所示。490K之后甲醇产率下降,其变化的原因是_______ 。
(4)在恒温恒容的密闭容器中加入1 mol 和3 mol
和3 mol  发生反应。
发生反应。
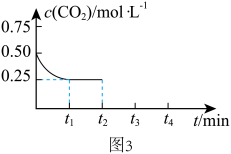
①若只发生反应Ⅰ, 的浓度随时间(
的浓度随时间( )变化如图3所示。其他条件不变,在
)变化如图3所示。其他条件不变,在 时间将容器体积缩小至原来的一半,
时间将容器体积缩小至原来的一半, 时重新达到平衡。请画出
时重新达到平衡。请画出 时段内
时段内 浓度的变化曲线
浓度的变化曲线_______ 。(在答题卷对应区域作图)
②若40 min后反应达到平衡,此时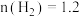 mol,
mol,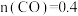 mol,则反应Ⅱ的化学平衡常数为
mol,则反应Ⅱ的化学平衡常数为_______ 。
 的回收和综合利用有利于实现“碳中和”。在催化剂作用下,
的回收和综合利用有利于实现“碳中和”。在催化剂作用下, 、
、 同时发生如下反应:
同时发生如下反应:反应Ⅰ:

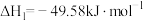
反应Ⅱ:

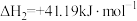
请回答:
(1)反应Ⅰ能自发进行的条件是
(2)压强平衡常数(用平衡分压代替平衡浓度,分压=总压×物质的量分数)的对数
 与温度倒数
与温度倒数 呈线性关系,如图1所示。其中表示反应Ⅰ的变化曲线为
呈线性关系,如图1所示。其中表示反应Ⅰ的变化曲线为 ”或“
”或“ ”)。
”)。
(3)若
 和
和 按一定比例在装有催化剂的反应器中发生反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图2所示。490K之后甲醇产率下降,其变化的原因是
按一定比例在装有催化剂的反应器中发生反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图2所示。490K之后甲醇产率下降,其变化的原因是
(4)在恒温恒容的密闭容器中加入1 mol
 和3 mol
和3 mol  发生反应。
发生反应。
①若只发生反应Ⅰ,
 的浓度随时间(
的浓度随时间( )变化如图3所示。其他条件不变,在
)变化如图3所示。其他条件不变,在 时间将容器体积缩小至原来的一半,
时间将容器体积缩小至原来的一半, 时重新达到平衡。请画出
时重新达到平衡。请画出 时段内
时段内 浓度的变化曲线
浓度的变化曲线②若40 min后反应达到平衡,此时
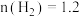 mol,
mol,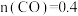 mol,则反应Ⅱ的化学平衡常数为
mol,则反应Ⅱ的化学平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是_______ 。
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______ 184.4kJ。
③已知:

1molN-H键断裂吸收的能量约等于_______ kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
①焓变ΔH(填“>”、“<”或“=”)_______ 0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)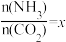 。下图是氨碳比(x)与CO2平衡转化率(α)的关系。
。下图是氨碳比(x)与CO2平衡转化率(α)的关系。
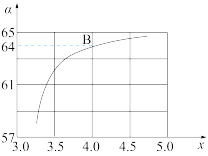
上图中的B点处,NH3的平衡转化率为_______ 。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)
③已知:

1molN-H键断裂吸收的能量约等于
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
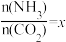 。下图是氨碳比(x)与CO2平衡转化率(α)的关系。
。下图是氨碳比(x)与CO2平衡转化率(α)的关系。
上图中的B点处,NH3的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】回答下列问题。
(1)治理大气中的 以及废水中的硫化物是环境保护的重要课题。加入固硫剂,是一种有效的治理措施。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:
以及废水中的硫化物是环境保护的重要课题。加入固硫剂,是一种有效的治理措施。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:
①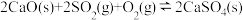
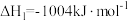
②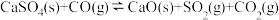
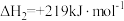
则 的燃烧热为
的燃烧热为___________  。
。
(2)一定条件下铁可以和 发生反应:
发生反应: 。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。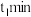 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。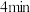 内,
内, 的平均反应速率
的平均反应速率
___________ 。
②下列描述能说明上述反应已达到平衡状态的是___________ (填序号)。
A.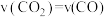
B.单位时间内生成 ,的同时生成
,的同时生成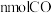
C.容器中气体压强不随时间变化而变化
D.容器中气体的平均相对分子质量不随时间变化而变化
E. 和
和 浓度相等
浓度相等
(3)某温度下在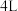 密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:___________ 。
②平衡时,混合气体中X、Y、Z的体积比为___________ 。
(1)治理大气中的
 以及废水中的硫化物是环境保护的重要课题。加入固硫剂,是一种有效的治理措施。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:
以及废水中的硫化物是环境保护的重要课题。加入固硫剂,是一种有效的治理措施。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:①
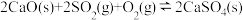
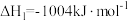
②
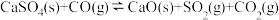
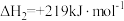
则
 的燃烧热为
的燃烧热为 。
。(2)一定条件下铁可以和
 发生反应:
发生反应: 。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。
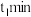 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 内,
内, 的平均反应速率
的平均反应速率
②下列描述能说明上述反应已达到平衡状态的是
A.
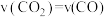
B.单位时间内生成
 ,的同时生成
,的同时生成
C.容器中气体压强不随时间变化而变化
D.容器中气体的平均相对分子质量不随时间变化而变化
E.
 和
和 浓度相等
浓度相等(3)某温度下在
 密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
②平衡时,混合气体中X、Y、Z的体积比为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】 甲醇是重要的能源以及化工原料。
(1)已知:(I)CH3OH(1)+ O2(g)=CO(g)+ 2H2O(g) △H1=−442.8kJ∙mol−1
(II)2CO(g)+O2(g)=2CO2(g) △H2=−566.0kJ∙mol−1
(III)H2O(l)=H2O(g) △H3=+44.0kJ∙mol−1
25°C时,甲醇完全燃烧的热化学方程式为___________ 。
(2)工业上利用CO2和H2制甲醇:
(IV)CO2 (g)+3H2(g) CH3OH(g) + H2O(g) △H=−49 kJ∙mol−1。
CH3OH(g) + H2O(g) △H=−49 kJ∙mol−1。
①借助高分子选择性吸水膜可有效提高CO2平衡利用率。其原因是_____________ 。
②下列关于反应IV的说法正确的是_________ (填序号)。
A.有利于减少碳排放,体现了绿色化学思想
B.充分反应后,放出热量可能大于49 kJ
C.降低温度可提高CH3OH含量,工业生产时应控制低温
D.当气体密度保持不变时,反应一定达到平衡状态
(3)经研究发现,反应IV分两步完成:
(V)CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(VI)CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①当1 mol CO2和3 mol H2投入密闭容器中,当反应V、VI达到平衡后,经测定容器中n(CO2)=n(CO),n(H2)=n(H2O)。则混合气体中水蒸气的体积分数为_____________ 。
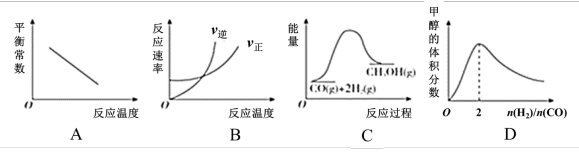
②下列关于反应VI的图象,不正确的是___________ (填序号)。
(1)已知:(I)CH3OH(1)+ O2(g)=CO(g)+ 2H2O(g) △H1=−442.8kJ∙mol−1
(II)2CO(g)+O2(g)=2CO2(g) △H2=−566.0kJ∙mol−1
(III)H2O(l)=H2O(g) △H3=+44.0kJ∙mol−1
25°C时,甲醇完全燃烧的热化学方程式为
(2)工业上利用CO2和H2制甲醇:
(IV)CO2 (g)+3H2(g)
 CH3OH(g) + H2O(g) △H=−49 kJ∙mol−1。
CH3OH(g) + H2O(g) △H=−49 kJ∙mol−1。①借助高分子选择性吸水膜可有效提高CO2平衡利用率。其原因是
②下列关于反应IV的说法正确的是
A.有利于减少碳排放,体现了绿色化学思想
B.充分反应后,放出热量可能大于49 kJ
C.降低温度可提高CH3OH含量,工业生产时应控制低温
D.当气体密度保持不变时,反应一定达到平衡状态
(3)经研究发现,反应IV分两步完成:
(V)CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)(VI)CO(g)+2H2(g)
 CH3OH(g) △H<0
CH3OH(g) △H<0①当1 mol CO2和3 mol H2投入密闭容器中,当反应V、VI达到平衡后,经测定容器中n(CO2)=n(CO),n(H2)=n(H2O)。则混合气体中水蒸气的体积分数为
②下列关于反应VI的图象,不正确的是

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】当发动机工作时,反应产生的NO尾气是主要污染物之一,NO的脱除方法和转化机理是当前研究的热点。请回答下列问题:
(1)已知:
 kJ∙mol−1
kJ∙mol−1

 kJ∙mol−1
kJ∙mol−1
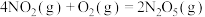
 kJ∙mol−1
kJ∙mol−1
则 是
是______ 反应(填“放热”或“吸热”),以上 氧化脱除氮氧化物的总反应是
氧化脱除氮氧化物的总反应是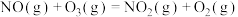

______ ,最后将 与
与______ 剂反应转化为无污染的气体而脱除。
(2)已知: 的反应历程分两步:
的反应历程分两步:
①表中 、
、 、
、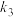 、
、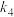 是只随温度变化的常数,温度升高将使其数值
是只随温度变化的常数,温度升高将使其数值______ (填“增大”或“减小”)。
②反应I瞬间建立平衡,因此决定 反应速率快慢的是
反应速率快慢的是______ ,则反应I与反应II的活化能的大小关系为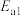
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③反应 的
的
______ (用 、
、 、
、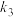 、
、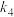 表示)。
表示)。
(3)将一定量的 放入恒容密闭容器中发生下列反应:
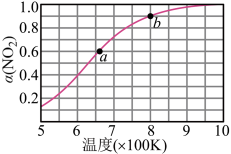
放入恒容密闭容器中发生下列反应: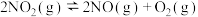 ,测得其平衡转化率
,测得其平衡转化率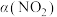 随温度变化如图所示,从b点到a点降温,平衡将向
随温度变化如图所示,从b点到a点降温,平衡将向______ 移动。图中a点对应温度下, 的起始压强为160kPa,该温度下反应的平衡常数
的起始压强为160kPa,该温度下反应的平衡常数
______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)已知:

 kJ∙mol−1
kJ∙mol−1
 kJ∙mol−1
kJ∙mol−1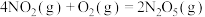
 kJ∙mol−1
kJ∙mol−1则
 是
是 氧化脱除氮氧化物的总反应是
氧化脱除氮氧化物的总反应是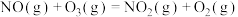

 与
与(2)已知:
 的反应历程分两步:
的反应历程分两步:步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
I |
|
|
|
|
II |
|
|
|
|
 、
、 、
、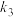 、
、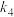 是只随温度变化的常数,温度升高将使其数值
是只随温度变化的常数,温度升高将使其数值②反应I瞬间建立平衡,因此决定
 反应速率快慢的是
反应速率快慢的是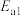
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③反应
 的
的
 、
、 、
、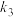 、
、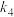 表示)。
表示)。(3)将一定量的
 放入恒容密闭容器中发生下列反应:
放入恒容密闭容器中发生下列反应: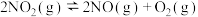 ,测得其平衡转化率
,测得其平衡转化率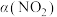 随温度变化如图所示,从b点到a点降温,平衡将向
随温度变化如图所示,从b点到a点降温,平衡将向 的起始压强为160kPa,该温度下反应的平衡常数
的起始压强为160kPa,该温度下反应的平衡常数

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】Ⅰ.已知下列反应的焓变
①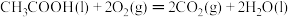
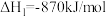
②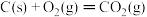

③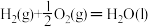
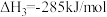
(1)试计算反应 的焓变
的焓变
__________
Ⅱ.可逆反应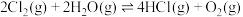
 ,在一定条件下达到平衡后,分别采取下列措施,试回答:(填“增大”、“减小”、或“不变”)
,在一定条件下达到平衡后,分别采取下列措施,试回答:(填“增大”、“减小”、或“不变”)
(2)升高体系温度, 的转化率
的转化率___________
(3)保持容器体积不变,充入氮气,则新平衡时,体系中 的物质的量
的物质的量___________
(4)保持容器的压强不变,充入氮气,则新平衡时, 的体积分数
的体积分数___________
(5)若恒温恒容,从正反应开始至平衡,这个变化过程中,体系中气体的平均摩尔质量___________
①
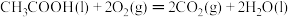
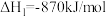
②
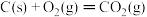

③
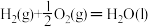
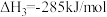
(1)试计算反应
 的焓变
的焓变
Ⅱ.可逆反应
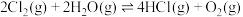
 ,在一定条件下达到平衡后,分别采取下列措施,试回答:(填“增大”、“减小”、或“不变”)
,在一定条件下达到平衡后,分别采取下列措施,试回答:(填“增大”、“减小”、或“不变”)(2)升高体系温度,
 的转化率
的转化率(3)保持容器体积不变,充入氮气,则新平衡时,体系中
 的物质的量
的物质的量(4)保持容器的压强不变,充入氮气,则新平衡时,
 的体积分数
的体积分数(5)若恒温恒容,从正反应开始至平衡,这个变化过程中,体系中气体的平均摩尔质量
您最近一年使用:0次

 (快)
(快)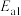
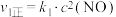
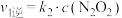
 (慢)
(慢)