在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)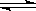 CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
回答下列问题:
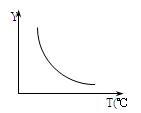
(1)该反应正向为ΔH____ 0;若该反应符合下图所示的关系,则在图中,Y轴是指________________________ 。
(2)能判断该反应达到化学平衡状态的依据是____ (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),由此可以判断此时的温度为_____ ℃。其它条件不变,升高温度,原化学平衡向_____ 反应方向移动(填“正”或“逆”),容器内混合气体的密度______ (填“增大”、“减小”或“不变”),气体平均相对分子质量______ (填“增大”、“减小”或“不变”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol/L和0.100 mol/L,平衡时CO的转化率________ 。
 CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

回答下列问题:
(1)该反应正向为ΔH
(2)能判断该反应达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),由此可以判断此时的温度为
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol/L和0.100 mol/L,平衡时CO的转化率
11-12高二上·河北承德·期末 查看更多[1]
(已下线)2010-2011学年河北省承德市联校高二上学期期末联考化学试卷
更新时间:2016-12-09 01:27:27
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】18.在一定温度、一定体积的密闭容器中,对于N2(g)+3H2(g) 2NH3(g)的反应,达到平衡的标志是
2NH3(g)的反应,达到平衡的标志是_______ 。
A.生成氨的速率与NH3的分解速率相等
B.断开一个N≡N键的同时有6个N—H键生成
C.N2、H2、NH3百分含量不再变化
D.总压强不变
E.N2、H2、NH3分子数之比为1∶3∶2的状态
F.N2、H2、NH3的浓度相等
G.N2、H2不再起反应 H.v(N2)= v(H2)
v(H2)
I.混合气体的密度不变
J.混合气体的平均摩尔质量不变
 2NH3(g)的反应,达到平衡的标志是
2NH3(g)的反应,达到平衡的标志是A.生成氨的速率与NH3的分解速率相等
B.断开一个N≡N键的同时有6个N—H键生成
C.N2、H2、NH3百分含量不再变化
D.总压强不变
E.N2、H2、NH3分子数之比为1∶3∶2的状态
F.N2、H2、NH3的浓度相等
G.N2、H2不再起反应 H.v(N2)=
 v(H2)
v(H2) I.混合气体的密度不变
J.混合气体的平均摩尔质量不变
您最近一年使用:0次
【推荐2】一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)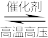 2NH3(g)。
2NH3(g)。
(1)下列描述能说明该可逆反应达到化学平衡状态的有___ 。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3molH-H键断裂,有6molN-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
(2)若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min时测得容器内NH3的浓度为1.5mol·L-1。10min内用N2表示的反应速率为___ ;此时H2的转化率为___ 。
 2NH3(g)。
2NH3(g)。(1)下列描述能说明该可逆反应达到化学平衡状态的有
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3molH-H键断裂,有6molN-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
(2)若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min时测得容器内NH3的浓度为1.5mol·L-1。10min内用N2表示的反应速率为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】科学家研究高效催化剂对汽车尾气进行无害化处理,其反应原理为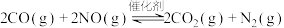
 。回答下列问题:
。回答下列问题:
(1)某温度下,在密闭容器中该反应达到化学平衡后,只改变一种条件对该反应的正、逆反应速率的影响如图甲所示。

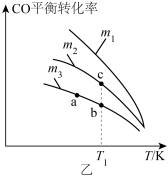
①加催化剂对反应速率影响的图像是______ (填字母,下同)。
②适当升高温度对反应速率影响的图像是A,该反应的正反应是__________ 反应(填“吸热”或“放热”)。
③图像D改变的条件是__________ (任写一条)。
(2)在 密闭容器中充入CO和NO共
密闭容器中充入CO和NO共 ,发生反应
,发生反应
 ,CO的平衡转化率与温度、起始投料比m的关系如图乙所示[起始投料比
,CO的平衡转化率与温度、起始投料比m的关系如图乙所示[起始投料比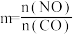 ]。
]。
①该反应的化学平衡常数表达式是__________ 。
②图中a、b、c三点对应的平衡常数 、
、 、
、 相对大小关系是
相对大小关系是__________ , 、
、 、
、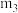 相对大小关系是
相对大小关系是__________ 。
③若 ,温度为
,温度为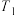 ,反应达到平衡所用的时间为
,反应达到平衡所用的时间为 ,CO的平衡转化率为40%。达平衡过程中平均反应速率
,CO的平衡转化率为40%。达平衡过程中平均反应速率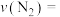
__________  ,平衡时混合气体总物质的量=
,平衡时混合气体总物质的量=__________  ;若
;若 时,该容器中此四种物质均为
时,该容器中此四种物质均为 ,则此时v(正)
,则此时v(正)______ (填“>”“<”或“=”)v(逆)。
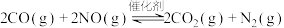
 。回答下列问题:
。回答下列问题:(1)某温度下,在密闭容器中该反应达到化学平衡后,只改变一种条件对该反应的正、逆反应速率的影响如图甲所示。


①加催化剂对反应速率影响的图像是
②适当升高温度对反应速率影响的图像是A,该反应的正反应是
③图像D改变的条件是
(2)在
 密闭容器中充入CO和NO共
密闭容器中充入CO和NO共 ,发生反应
,发生反应
 ,CO的平衡转化率与温度、起始投料比m的关系如图乙所示[起始投料比
,CO的平衡转化率与温度、起始投料比m的关系如图乙所示[起始投料比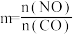 ]。
]。①该反应的化学平衡常数表达式是
②图中a、b、c三点对应的平衡常数
 、
、 、
、 相对大小关系是
相对大小关系是 、
、 、
、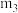 相对大小关系是
相对大小关系是③若
 ,温度为
,温度为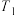 ,反应达到平衡所用的时间为
,反应达到平衡所用的时间为 ,CO的平衡转化率为40%。达平衡过程中平均反应速率
,CO的平衡转化率为40%。达平衡过程中平均反应速率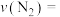
 ,平衡时混合气体总物质的量=
,平衡时混合气体总物质的量= ;若
;若 时,该容器中此四种物质均为
时,该容器中此四种物质均为 ,则此时v(正)
,则此时v(正)
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】已知:Ⅰ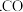 的燃烧热为
的燃烧热为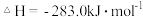
Ⅱ


Ⅲ

则
______ 。
 对于可逆反应
对于可逆反应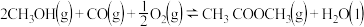 采取以下措施可以提高
采取以下措施可以提高 产率的是
产率的是______  填字母
填字母
A.降低体系的温度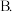 压缩容器的体积
压缩容器的体积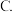 减少水量
减少水量 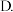 选用适当的催化剂
选用适当的催化剂
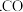 的燃烧热为
的燃烧热为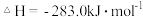
Ⅱ



Ⅲ


则

 对于可逆反应
对于可逆反应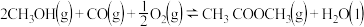 采取以下措施可以提高
采取以下措施可以提高 产率的是
产率的是 填字母
填字母
A.降低体系的温度
 压缩容器的体积
压缩容器的体积 减少水量
减少水量  选用适当的催化剂
选用适当的催化剂
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】恒温刚性密闭容器中通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=2∶13∶85的混合气体,已知某反应条件下只发生如下反应(k,k′为速率常数):
反应II:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) k
反应III:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)-k′p(C3H6),可推测丙烯的浓度随时间的变化趋势为_______ ,其理由是______ 。
反应II:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) k
反应III:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)-k′p(C3H6),可推测丙烯的浓度随时间的变化趋势为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】可逆反应: ;根据图回答:
;根据图回答:
___________  ;(a+b)
;(a+b) ___________ (c+d) (填“>”或“<”下同)。
(2)温度 ℃
℃___________  ℃:ΔH
℃:ΔH___________ 0。
(3)保持体积和温度不变,通入He,平衡会___________ 移动(填“正向”、“逆向”或“不”)。
 ;根据图回答:
;根据图回答: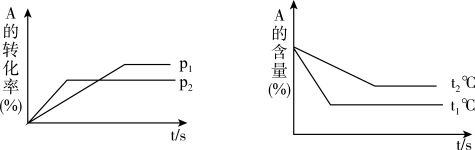

 ;(a+b)
;(a+b) (2)温度
 ℃
℃ ℃:ΔH
℃:ΔH(3)保持体积和温度不变,通入He,平衡会
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】在一体积固定的密闭容器中,某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内,用A表示表示该反应的平均速率
为_______ mol/(L . min)
(2)在实验2,A的初始浓度c2=____________ mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_______________________________ 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______ v1
(填>、=、<),且c3_______ 1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________ 反应(选填吸热、放热)。
理由是___________________________________________________________
(5)根据以上实验请指出要加快该反应可采取什么样的方法(列举方法最少2种)
_____________________________________________________________
 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:| 实验 序号 |   时 间 时 间浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内,用A表示表示该反应的平均速率
为
(2)在实验2,A的初始浓度c2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(填>、=、<),且c3
(4)比较实验4和实验1,可推测该反应是
理由是
(5)根据以上实验请指出要加快该反应可采取什么样的方法(列举方法最少2种)
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________________________ ,该反应为_______________ 反应(选吸热或放热)。
若改变条件使平衡向正反应方向移动,则平衡常数_________ (填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是___________
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验1中以v(CO2) 表示的反应速率为____________ 。实验2达到平衡所需时间比实验1所需时间短的原因是_________________________________________________________ 。
 CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=
若改变条件使平衡向正反应方向移动,则平衡常数
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】某温度下,反应 的平衡常数
的平衡常数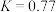 。当
。当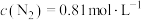 ,
,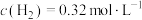 ,
, 时,试通过计算判断反应进行的方向。
时,试通过计算判断反应进行的方向。______
 的平衡常数
的平衡常数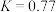 。当
。当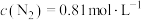 ,
,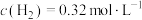 ,
, 时,试通过计算判断反应进行的方向。
时,试通过计算判断反应进行的方向。
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】在容积不变的密闭容器中,一定量的SO2、O2发生反应: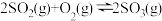 。温度分别为t1和t2时,
。温度分别为t1和t2时, 的体积分数随时间的变化如图。该反应的
的体积分数随时间的变化如图。该反应的
___________ 0(填“>”“<”或“=”,下同);若t1、t2时该反应的化学平衡常数分别为K1、K2,则K1___________ K2。

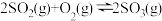 。温度分别为t1和t2时,
。温度分别为t1和t2时, 的体积分数随时间的变化如图。该反应的
的体积分数随时间的变化如图。该反应的

您最近一年使用:0次


 的关系是:
的关系是:

