含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目:_________________________________ 。
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式______________________________ 。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面____________ ,则发生了钝化;若铁棒表面________________ ,则未发生反应。
(4)用Na2SO3吸收法作为治理SO2污染的一种方法,其原理为(用化学方程式表示):______________________________ 。
(5)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。该反应的化学方程式:____________________________ 。
(6)制取硫酸铜有两种方法:方法一:2Cu+O2 2CuO,CuO+ H2SO4= CuSO4+H2O,
2CuO,CuO+ H2SO4= CuSO4+H2O,
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:
CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:_____________________________________________ (答任一点)。
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目:
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
(4)用Na2SO3吸收法作为治理SO2污染的一种方法,其原理为(用化学方程式表示):
(5)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。该反应的化学方程式:
(6)制取硫酸铜有两种方法:方法一:2Cu+O2
 2CuO,CuO+ H2SO4= CuSO4+H2O,
2CuO,CuO+ H2SO4= CuSO4+H2O,方法二:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:
CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:
11-12高一上·浙江温州·期末 查看更多[2]
更新时间:2016-12-08 17:27:52
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】配平(1)(2);用双线桥法表示(3)(4)氧化还原反应的电子转移。
(1)( ) KI+( ) KIO3+( ) H2SO4—( ) I2+( ) K2SO4+( ) H2O
(2)( ) Cu2S + ( ) HNO3 — ( ) Cu(NO3)2 + ( ) H2SO4 + ( ) NO2↑+( ) H2O
(3)MnO2+4HCl(浓) MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O______
(4)3S+6KOH=K2SO3+2K2S+3H2O_______
(1)
(2)
(3)MnO2+4HCl(浓)
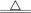 MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O(4)3S+6KOH=K2SO3+2K2S+3H2O
您最近一年使用:0次
【推荐2】根据所学知识回答下列问题:
(1)①写出Fe2(SO4)3在水溶液中的电离方程式:______ 。
②FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为:_____ 。
③写出Al与氢氧化钠溶液反应的离子方程式:_____ 。
(2)高铁酸钠(Na2FeO4)是一种新型净水剂。制取高铁酸钠所发生的反应如下:
______Fe(NO3)3+______NaOH+______Cl2=______Na2FeO4+______NaNO3+______NaCl+______H2O
①配平并用“双线桥”表示电子转移的方向和数目______ 。
②该反应中Na2FeO4是______ (填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”)。
③若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则消耗的Cl2在标准状况下的体积为______ L。
④黄色气体ClO2可用于污水杀菌和饮用水净化,ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为______ 。
(3)已知M2O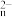 可与R2-作用,R2-被氧化为R单质,M2O
可与R2-作用,R2-被氧化为R单质,M2O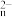 的还原产物中M为+3价;又知c(M2O
的还原产物中M为+3价;又知c(M2O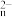 )=0.3mol•L-1的溶液100mL可与c(R2-)=0.6mol•L-1的溶液150mL恰好完全反应,则n值为
)=0.3mol•L-1的溶液100mL可与c(R2-)=0.6mol•L-1的溶液150mL恰好完全反应,则n值为______ 。
(1)①写出Fe2(SO4)3在水溶液中的电离方程式:
②FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为:
③写出Al与氢氧化钠溶液反应的离子方程式:
(2)高铁酸钠(Na2FeO4)是一种新型净水剂。制取高铁酸钠所发生的反应如下:
______Fe(NO3)3+______NaOH+______Cl2=______Na2FeO4+______NaNO3+______NaCl+______H2O
①配平并用“双线桥”表示电子转移的方向和数目
②该反应中Na2FeO4是
③若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则消耗的Cl2在标准状况下的体积为
④黄色气体ClO2可用于污水杀菌和饮用水净化,ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为
(3)已知M2O
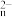 可与R2-作用,R2-被氧化为R单质,M2O
可与R2-作用,R2-被氧化为R单质,M2O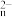 的还原产物中M为+3价;又知c(M2O
的还原产物中M为+3价;又知c(M2O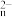 )=0.3mol•L-1的溶液100mL可与c(R2-)=0.6mol•L-1的溶液150mL恰好完全反应,则n值为
)=0.3mol•L-1的溶液100mL可与c(R2-)=0.6mol•L-1的溶液150mL恰好完全反应,则n值为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】土壤的酸碱性对农作物的生长十分重要,但各种自然或人为因素可能导致土壤的酸碱失衡。
(1)①矿石暴露在空气中缓慢氧化并产生无机酸是土壤酸化的原因之一,例如黄铁矿 在空气中会缓慢生成氧化铁和一种强酸,写出该过程的化学方程式:
在空气中会缓慢生成氧化铁和一种强酸,写出该过程的化学方程式:_______ 。
②微生物和细菌,在通风良好的情况下,可以把土壤中的 氧化为
氧化为 (一种弱酸)写出反应的离子方程式:
(一种弱酸)写出反应的离子方程式:_______ 。
③酸雨是加重土壤酸化的人为原因,下面哪些做法能减少酸雨的发生_______ ?
A.燃煤进行脱硫处理
B.通过植树造林,节能减排等形式,推行碳中和理念
C.推行新能源汽车,减少燃油车比例
D.减少含磷洗涤剂的使用
(2)过多的 会导致土壤呈碱性,是盐碱地形成的原因之一、
会导致土壤呈碱性,是盐碱地形成的原因之一、
①可以用 改良盐碱地(用化学方程式表示):
改良盐碱地(用化学方程式表示):_______ 。
②农业上还可以用 进行化学改良,反应得到
进行化学改良,反应得到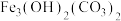 ,写出该过程的离子方程式:
,写出该过程的离子方程式:_______ 。
(1)①矿石暴露在空气中缓慢氧化并产生无机酸是土壤酸化的原因之一,例如黄铁矿
 在空气中会缓慢生成氧化铁和一种强酸,写出该过程的化学方程式:
在空气中会缓慢生成氧化铁和一种强酸,写出该过程的化学方程式:②微生物和细菌,在通风良好的情况下,可以把土壤中的
 氧化为
氧化为 (一种弱酸)写出反应的离子方程式:
(一种弱酸)写出反应的离子方程式:③酸雨是加重土壤酸化的人为原因,下面哪些做法能减少酸雨的发生
A.燃煤进行脱硫处理
B.通过植树造林,节能减排等形式,推行碳中和理念
C.推行新能源汽车,减少燃油车比例
D.减少含磷洗涤剂的使用
(2)过多的
 会导致土壤呈碱性,是盐碱地形成的原因之一、
会导致土壤呈碱性,是盐碱地形成的原因之一、①可以用
 改良盐碱地(用化学方程式表示):
改良盐碱地(用化学方程式表示):②农业上还可以用
 进行化学改良,反应得到
进行化学改良,反应得到 ,写出该过程的离子方程式:
,写出该过程的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】为消除燃煤烟气中含有的SO2、NOx,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
(1)向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4的化学方程式是______ 。
(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。NH3还原NO的化学方程式是______ 。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2、NO转化为SO42−、NO3−,均为放热反应。
①在如图中画出“放热反应”的反应过程中的能量变化示意图。
②NaClO溶液吸收烟气中SO2的离子方程式是______ 。
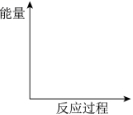
③一定时间内,温度对硫、硝脱除率的影响曲线如图,SO2的脱除率高于NO,可能的原因是______ (写出1种即可)。
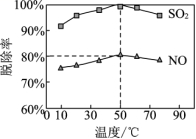
④烟气中SO2和NO的体积比为4∶1,50℃时的脱除率见图2,则此吸收液中烟气转化生成的NO3−和Cl−的物质的量之比为______ 。
(1)向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4的化学方程式是
(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。NH3还原NO的化学方程式是
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2、NO转化为SO42−、NO3−,均为放热反应。
①在如图中画出“放热反应”的反应过程中的能量变化示意图。

②NaClO溶液吸收烟气中SO2的离子方程式是
③一定时间内,温度对硫、硝脱除率的影响曲线如图,SO2的脱除率高于NO,可能的原因是

④烟气中SO2和NO的体积比为4∶1,50℃时的脱除率见图2,则此吸收液中烟气转化生成的NO3−和Cl−的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】中科院官方微信中科院之于2017年3月9日发表《一个“网红”的转化-灰霾专题》,提出灰霾细颗粒物的成因,部分分析如下图所示。
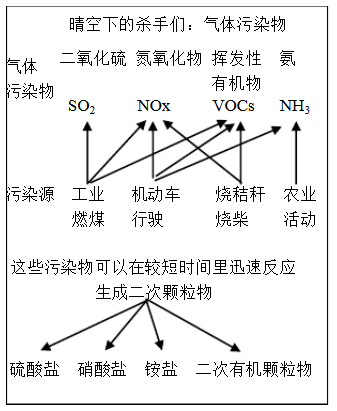
(1)根据上图信息可以看出,下列哪种污染源不产生NOx_________ .
A.工业燃煤 B.机动车尾气 C.烧秸秆 D.农业活动
(2)若某地空气潮湿,且空气含有的大气污染物主要是SO2、NH3,根据上图中所举的“SO2 SO32-
SO32- 盐
盐 SO42-
SO42- 盐”的流程,请写出该地形成二次颗粒物硫酸盐的化学反应方程式:
盐”的流程,请写出该地形成二次颗粒物硫酸盐的化学反应方程式:_____________ 。
(3)当前频繁出现的雾霾天气与汽车尾气的排放有一定的关系,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。

写出净化过程中的总化学方程式:________
(4)将装有amLNO和NO2混合气体的集气瓶倒立在水槽中,然后鼓入一定量O2,最终集气瓶里面剩余气体体积为bmL,则集气瓶内所得HNO3的物质的量浓度为______ mol/L(不考虑集气瓶内硝酸扩散到水槽中,设气体摩尔体积为Vm)。

(1)根据上图信息可以看出,下列哪种污染源不产生NOx
A.工业燃煤 B.机动车尾气 C.烧秸秆 D.农业活动
(2)若某地空气潮湿,且空气含有的大气污染物主要是SO2、NH3,根据上图中所举的“SO2
 SO32-
SO32- 盐
盐 SO42-
SO42- 盐”的流程,请写出该地形成二次颗粒物硫酸盐的化学反应方程式:
盐”的流程,请写出该地形成二次颗粒物硫酸盐的化学反应方程式:(3)当前频繁出现的雾霾天气与汽车尾气的排放有一定的关系,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。

写出净化过程中的总化学方程式:
(4)将装有amLNO和NO2混合气体的集气瓶倒立在水槽中,然后鼓入一定量O2,最终集气瓶里面剩余气体体积为bmL,则集气瓶内所得HNO3的物质的量浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】根据所学知识,回答下列问题:
(1)将一小块铝箔与NaOH溶液混合置于试管中,刚开始无气泡产生,一段时间之后产生大量气泡,用手触摸试管外壁,感觉发烫。刚开始无气泡产生的原因是___________ ;产生大量气泡时,反应的离子方程式为___________ ,该反应是___________ (填“吸”或“放”)热反应。
(2)常温下,将少量铁片投入装有足量浓硫酸的试管中,无明显现象,原因是___________ ;加热试管,马上产生大量气泡,加热时生成气体的化学方程式为___________ ,生成的气体冷却后通入紫色石蕊溶液中,观察到的现象为___________ 。
(3)CO和 是常见的可燃性气体,
是常见的可燃性气体,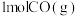 和
和 分别完全燃烧生成
分别完全燃烧生成 、
、 时,放出的热量分别为283kJ和890kJ。已知下述①②中的反应均在相同条件下进行,则:
时,放出的热量分别为283kJ和890kJ。已知下述①②中的反应均在相同条件下进行,则:
① 完全燃烧生成
完全燃烧生成 及
及 时,放出的热量
时,放出的热量___________ (填“>”“<”或“=”)890kJ。
②现有5g由 和
和 组成的混合气体,换算成标准状况下的体积为4.48L,则该混合气体完全燃烧生成
组成的混合气体,换算成标准状况下的体积为4.48L,则该混合气体完全燃烧生成 和
和 时,放出的总热量为
时,放出的总热量为___________ kJ。
(1)将一小块铝箔与NaOH溶液混合置于试管中,刚开始无气泡产生,一段时间之后产生大量气泡,用手触摸试管外壁,感觉发烫。刚开始无气泡产生的原因是
(2)常温下,将少量铁片投入装有足量浓硫酸的试管中,无明显现象,原因是
(3)CO和
 是常见的可燃性气体,
是常见的可燃性气体,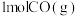 和
和 分别完全燃烧生成
分别完全燃烧生成 、
、 时,放出的热量分别为283kJ和890kJ。已知下述①②中的反应均在相同条件下进行,则:
时,放出的热量分别为283kJ和890kJ。已知下述①②中的反应均在相同条件下进行,则:①
 完全燃烧生成
完全燃烧生成 及
及 时,放出的热量
时,放出的热量②现有5g由
 和
和 组成的混合气体,换算成标准状况下的体积为4.48L,则该混合气体完全燃烧生成
组成的混合气体,换算成标准状况下的体积为4.48L,则该混合气体完全燃烧生成 和
和 时,放出的总热量为
时,放出的总热量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有_______ 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有_______ 性。硝酸应保存在棕色试剂瓶中,这是因为硝酸具有_______ 性。
(2)硝酸铜是制备CuZnAl系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是_______ (填序号)。
①Cu+HNO3(浓)→Cu(NO3)2
②Cu+HNO3(稀)→Cu(NO3)2
③Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
(3)在稀硝酸溶液中加入铜片使之充分反应,写出反应的离子方程式_______ 。
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解。写出该反应的化学方程式_______ 。
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有
(2)硝酸铜是制备CuZnAl系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是
①Cu+HNO3(浓)→Cu(NO3)2
②Cu+HNO3(稀)→Cu(NO3)2
③Cu
 CuO
CuO Cu(NO3)2
Cu(NO3)2(3)在稀硝酸溶液中加入铜片使之充分反应,写出反应的离子方程式
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解。写出该反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
(1)用做消化系统X射线检查的内服药剂“钡餐”的化学式为___________ 。
(2)酸雨的
___________ 5.6(填“>”、“<”、“=”)。
(3) 的电子式
的电子式___________ 。
(4)工业上用焦炭还原石英砂可以制得含有少量杂质的粗硅,化学方程式为___________ 。
(5)己知:①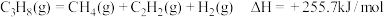
②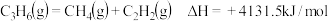
则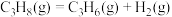 的
的
___________ 。
(1)用做消化系统X射线检查的内服药剂“钡餐”的化学式为
(2)酸雨的

(3)
 的电子式
的电子式(4)工业上用焦炭还原石英砂可以制得含有少量杂质的粗硅,化学方程式为
(5)己知:①
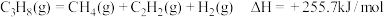
②
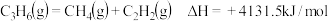
则
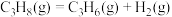 的
的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题
(1)①写出重晶石的化学式___________ ;
②乙烯的结构简式___________ 。
(2)工业上制取粗硅的化学方程式___________ 。
(3)稀硫酸除去多余氨气的离子方程式:___________
(1)①写出重晶石的化学式
②乙烯的结构简式
(2)工业上制取粗硅的化学方程式
(3)稀硫酸除去多余氨气的离子方程式:
您最近一年使用:0次

 碳纳米颗粒
碳纳米颗粒 这种碳纳米颗粒可用氧化气化法提纯
这种碳纳米颗粒可用氧化气化法提纯 标准状况下
标准状况下 在水中的电离方程式
在水中的电离方程式 的电子式
的电子式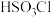 与水反应能生成两种强酸,则
与水反应能生成两种强酸,则 溶液反应的化学反应方程式
溶液反应的化学反应方程式

