 2NH3(g)△H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
2NH3(g)△H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.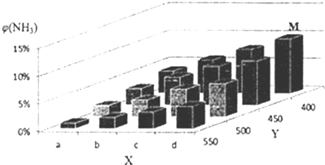
回答下列问题:
(1)已知:①NH3(l)═NH3(g)△H1,②N2(g)+3H2(g)
 2NH3(l)△H2;则反应N2(g)+3H2(g)
2NH3(l)△H2;则反应N2(g)+3H2(g) 2NH3(g)的△H=
2NH3(g)的△H=(2)合成氨的平衡常数表达式为
(3)X轴上a点的数值比b点
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示:
| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
下列判断正确的是
A.放出热量:Ql<Q2<△Hl
B.N2的转化率:Ⅰ>Ⅲ
C.平衡常数:Ⅱ>Ⅰ
D.达平衡时氨气的体积分数:Ⅰ>Ⅱ
(5)常温下,向VmL amol.L-l的稀硫酸溶液中滴加等体积bmol.L-l的氨水,恰好使混合溶液呈中性,此时溶液中c(
 )
)(6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-.写出负极的电极反应式
相似题推荐
 2NH3(g) ΔH=﹣92.4 kJ•mol﹣1。
2NH3(g) ΔH=﹣92.4 kJ•mol﹣1。(1)在一定温度下,若将10amol N2和30amol H2放入2 L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为
(2)若反应起始时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3达到平衡时浓度的范围为
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容,测得反应达到平衡时的有关数据如表:
容器 反应物投入量 | 甲 | 乙 | 丙 | |
| 1molN2、3molH2 | 2molNH3 | 4molNH3 | ||
| 平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q1 | Q1 |
| 反应物转化率 | a1 | a2 | a3 | |
| 体系压强(Pa) | p1 | p2 | p3 | |
则Q1+Q2=

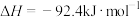 ,他因此获得了1918年诺贝尔化学奖。向密容器中充入2mol
,他因此获得了1918年诺贝尔化学奖。向密容器中充入2mol 和6mol
和6mol ,并使之发生上述反应,请回答下列问题:
,并使之发生上述反应,请回答下列问题:(1)当反应达到平衡时,
 和
和 的浓度之比是
的浓度之比是 和
和 的转化率之比是
的转化率之比是(2)当反应达到平衡时,升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将
(4)若容器恒容、绝热,达到平衡后,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度
(5)若容器恒温恒容,达平衡后,再向容器中充入2mol
 和6mol
和6mol ,再次达平衡后,和原平衡相比NH3的体积分数
,再次达平衡后,和原平衡相比NH3的体积分数 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。(1)已知:A(g)+X(g)
 2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)
2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g) 4C(g) ΔH=-650.4 kJ·mol-1。则a=
4C(g) ΔH=-650.4 kJ·mol-1。则a=(2)不同温度下该反应的平衡常数如表所示。
由此可推知,表中T1
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量
【推荐1】温室气体的利用是当前环境和能源领域的研究热点。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)→NH2COONH4(s) ΔH1=-159.5 kJ/mol
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.5 kJ/mol
总反应Ⅲ:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3=______kJ/mol
①反应Ⅲ的ΔH3=
②一定温度下,在体积固定的密闭容器中将NH3和CO2按2:1投入进行反应合成尿素,下列能说明反应I达到化学平衡状态的是
a.体系内固体质量不改变
b.NH3的物质的量分数不再变化
c.2v正(NH3)=v逆(CO2)
d.容器内混合气体的密度不再变化
(2)工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、H2),发生反应为:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH>0,将等物质的量的甲烷和水蒸气投入一个刚性容器中,图中a、b两条曲线代表压强分别为1MPa、2MPa时甲烷平衡含量曲线,其中表示1MPa的是

(3)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如下图所示。过程②的化学方程式是

(4)已知:
表1 25℃时浓度为0.1mol/L两种溶液的pH
溶质 | NaClO | Na2CO3 |
pH | 9.7 | 11.6 |
表2 25℃时两种酸的电离平衡常数
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①根据表1能不能判断出H2CO3与HClO酸性强弱?
②H2SO3溶液和NaHCO3溶液反应的离子方程式为
 2NH3(g)反应的影响可表示成如图所示的规律(图中
2NH3(g)反应的影响可表示成如图所示的规律(图中 表示温度,
表示温度, 表示物质的量)。
表示物质的量)。
①比较在a、b、c三点处的平衡状态中,反应物N2的转化率最高的是
②若容器容积为1L,
 =3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为
=3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为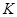 =
=③图象中
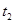 和
和 的关系是t2
的关系是t2 (2)氨气和氧气与145
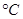 时开始反应,在不同温度和催化剂条件下生成不同产物(如图所示)
时开始反应,在不同温度和催化剂条件下生成不同产物(如图所示)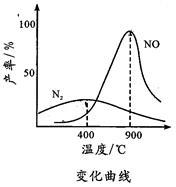
4NH3+5O2
 4NO+6H2O
4NO+6H2O4NH3+3O2
 2N2+6H2O
2N2+6H2O温度较低时以生成
 时,NO产率下降的原因是
时,NO产率下降的原因是WO3 (s) + 3H2 (g)
 W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)用H2还原WO2也可得到金属钨。已知:
WO2 (s) + 2H2 (g)
 W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1
W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1WO2 (g) + 2H2 (g)
 W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1则WO2 (s)
 WO2 (g) 的ΔH =
WO2 (g) 的ΔH = (4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)
 WI4 (g)。下列说法正确的有
WI4 (g)。下列说法正确的有a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是
(2)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体③
(3)25 ℃时,测得HCN和NaCN的混合溶液的pH=11,则
 约为
约为II.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。

(4)该微生物燃料电池,负极为
(5)该电池正极电极反应式为
(6)当电路中有0.5mol电子发生转移,则有
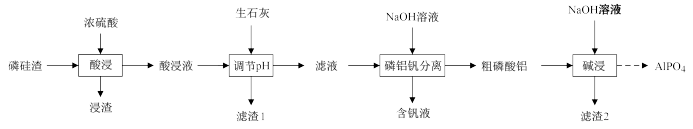
回答下列问题:
(1)酸浸液中含磷元素的主要粒子是
(2)生石灰除了调节pH外,另一作用是
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2-,该水解反应的离子方程式为
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是
(5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图所示:
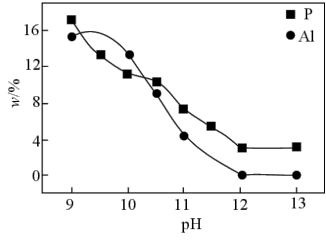
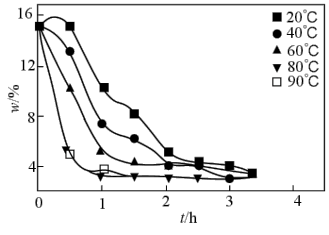
则最优反应条件是
(6)固相反应制备磷酸铝的方法之一是在900℃的焙烧炉内加热磷酸二氢铵与氧化铝混合物,写出该反应的化学方程式:

已知部分氢氧化物沉淀的pH如下表:
| 沉淀物 | Fe( OH)3 | Al( OH)3 | Mg(OH)2 |
| 开始沉淀时的pH (离子初始浓度为0. 01mol·L-1) | 2.2 | 3.7 | 9. 6 |
| 完全沉淀时的pH (离子浓度<10-5mol·L-1) | 3.2 | 4.7 | 11.1 |
请回答下列问题:
(1)为了加快铝土矿和盐酸的反应速率,可以采取的措施为
(2)固体A的主要成分是
(3)“溶液C”调节pH的范围为
(4)为了验证“溶液C”中是否含有Fe3+,可取少量“溶液C”于试管中,向其中加入
(5)操作⑤反应的化学方程式为

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的"1”表示液体,“s”表示固体。
③硫酸铅,氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+C1-=[PbCl3]-。
(1)铅蓄电池的正极材料是
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbO2+Pb+4HCl=2PbCl2+2H2O,PbO+2HCl=PbCl2+H2O,PbSO4+2NaCl=PbCl2+Na2SO4,PbCl2+Cl-=[PbCl3]-,除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是
(3)PbCl2在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙进行沉淀转化,若无此步骤,直接循环使用,则会导致的结果是
①甲的电子式为
②A的单质与C的单质燃烧产物的类型
③A与C、D与C可形成化合物A2C、A2C2、D2C、D2C2,说出D2C2的一种用途
(2)某元素的同位素X,它的氯化物XCl 1.49 g溶于水制成溶液后,加入1mol·L-1的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,试通过计算确定:
①X元素在周期表中的位置
②把一小粒X的单质放入水中,写出反应的离子方程式
(3)选择适宜的材料和试剂设计一个原电池,以便完成下列反应:2Fe3++Fe=3Fe3+。画出原电池的示意图标注电极名称
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是洗去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是(用离子方程式表示)
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是
(3)利用图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(4)已知:H2O2是弱酸,在碱性条件下以HO2-存在。目前研究比较热门的Al-H2O2燃料电池,其原理如下图所示:

电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O 。写出负极反应式为



