研究CO2与CH4反应转化为CO和H2,对减缓燃料危机、减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=___ kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
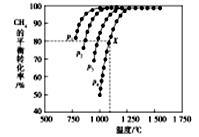
①下列事实能说明该反应一定达到平衡的是____ 。
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位______ ,理由是____ 。
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=____ (用平衡分压代替平衡浓度计算,分压=总压*物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____ ,NH4+水解平衡常数KA=____ 。
(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式____________ 。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。

①下列事实能说明该反应一定达到平衡的是
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O
 NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式
更新时间:2016-12-09 17:15:03
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】根据要求回答下列问题:
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
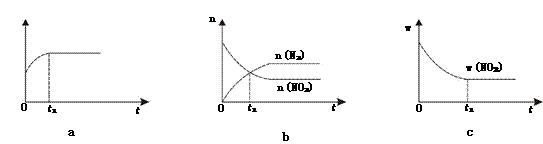
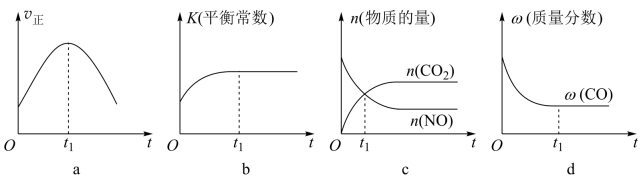
①下列图象说明该反应进行到t1时刻未达平衡状态的是________ (填选项字母)。
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。
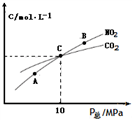
图中A、B、C三点NO2的转化率最高的是_____ ,该反应的平衡常数Kp=_______ (Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______ 。
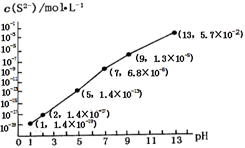
②25℃时,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____ mol·L-1;
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____ 性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
②CaSO4(s)+ 4CO(g) CaS(s)+ 4CO2(g) △H = -189.2kJ•mol-1
CaS(s)+ 4CO2(g) △H = -189.2kJ•mol-1
则:CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) △H=
CaS(s)+3CO2(g) △H=_______ kJ•mol-1.
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s)
 N2(g)+2CO2(g)。
N2(g)+2CO2(g)。①下列图象说明该反应进行到t1时刻未达平衡状态的是

②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。

图中A、B、C三点NO2的转化率最高的是
(2)已知:弱电解质的电离平衡常数为
| 物质 | H2CO₃ | H2S | HNO2 |
| 电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是
②25℃时,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=

③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈
(3)已知:①CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1②CaSO4(s)+ 4CO(g)
 CaS(s)+ 4CO2(g) △H = -189.2kJ•mol-1
CaS(s)+ 4CO2(g) △H = -189.2kJ•mol-1则:CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g) △H=
CaS(s)+3CO2(g) △H=
您最近一年使用:0次
【推荐2】丁烷广泛存在于油田气、湿天然气和裂化气中,可用作燃料、溶剂、制冷剂和有机合成原料。回答下列问题:
(1)已知正丁烷在一定条件下可发生如下反应: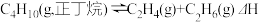 ,相关物质的燃烧热数据如下表所示:
,相关物质的燃烧热数据如下表所示:
①相同条件下稳定性:正丁烷______ (填“大于”或“小于”)异丁烷;
_____  。
。
②写出一种提高该反应平衡转化率的措施:___ 。
(2)向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷。测得乙烯平衡产率与温度关系如图所示。

①当温度高于600℃后,乙烯的产率降低,可能的原因是________ 。
②280℃时,该反应的平衡常数Kc为________ 。
(3)科学家利用电解原理,将正丁烷和二氧化碳转化为乙烯和一氧化碳。
①正丁烷气体应通入___________ (填“阴极”或“阳极”)室;电解过程中的总反应方程式为___________ 。
②若生成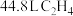 (标准状况下),则反应过程中转移电子的物质的量为
(标准状况下),则反应过程中转移电子的物质的量为___ 。
(1)已知正丁烷在一定条件下可发生如下反应:
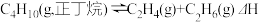 ,相关物质的燃烧热数据如下表所示:
,相关物质的燃烧热数据如下表所示:| 物质 | 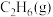 |  | 正丁烷 | 异丁烷 |
| 燃烧热△H/(kJ·mol-1) | -1560 | -1411 | -2878 | -2869.6 |

 。
。②写出一种提高该反应平衡转化率的措施:
(2)向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷。测得乙烯平衡产率与温度关系如图所示。

①当温度高于600℃后,乙烯的产率降低,可能的原因是
②280℃时,该反应的平衡常数Kc为
(3)科学家利用电解原理,将正丁烷和二氧化碳转化为乙烯和一氧化碳。
①正丁烷气体应通入
②若生成
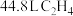 (标准状况下),则反应过程中转移电子的物质的量为
(标准状况下),则反应过程中转移电子的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】载人航天工程对科学研究及太空资源开发具有重要意义,载人航天器必须给航天员提供基本的生存条件,其中涉及氧气再生、二氧化碳清除、水处理以及食物供给等。
(1)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。
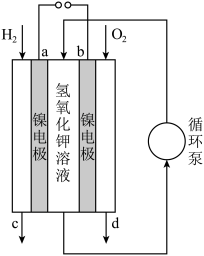
①电池的正极是___________ (填“a”或“b”),该电极上发生的电极反应是___________ 。
②电池工作时产生的水会以水蒸气的形式被反应物气体带出,在出口加装冷凝器可以将水回收。冷凝器应装在出口___________ (填“c”或“d”)处。
③电池工作时,电解质溶液会因稀释及吸收 而变质,此时电解质溶液的
而变质,此时电解质溶液的 将
将___________ (填“升高”或“降低”)。通过循环泵可及时浓缩或更换变质的溶液,维特电池的正常工作。
(2)我国自行研制的“神舟”飞船使用了镍镉蓄电池组,其充放电时发生的反应为: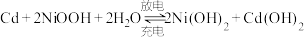 ,其电池装置如图所示,阴离子交换膜两侧均注入
,其电池装置如图所示,阴离子交换膜两侧均注入 溶液。
溶液。
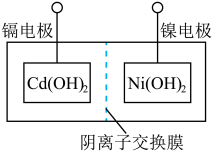
①下列对于该镍镉电池的分析中,正确的是___________ 。
A.图示中的电池应先充电后,再使用
B.充电时, 从镍电极区迁移进入镉电极区
从镍电极区迁移进入镉电极区
C.放电时,镍电极为电池的负极,镉电极为电池的正极
D.充电或放电一段时间后,两电极区溶液中 的物质的量均未改变
的物质的量均未改变
②镍镉电池在充电时,镉电极上发生的电极反应为___________ ;当 和
和 耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体
耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体___________ (填化学式);镍电极上则会发生反应___________ (填电极反应式)而产生 。
。
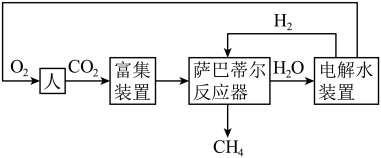
(3)载人航天器中氧气的再生是一个重要环节。利用萨巴蒂尔反应可将人呼出的二氧化碳转化为甲烷和水,配合太阳能电解水可以实现氧气的再生(大体流程如下图)。
已知:

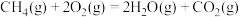
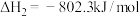
萨巴蒂尔反应: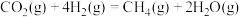

①萨巴蒂尔反应的焓变
___________ 。
②电解水装置中 产生于
产生于___________ (填“正”、“负”、“阴”或“阳”)极。
③通过巴萨尔反应器和电解水装置能否实现H2与 的完全再生?
的完全再生?___________ (填“能”或“否”)
(1)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。

①电池的正极是
②电池工作时产生的水会以水蒸气的形式被反应物气体带出,在出口加装冷凝器可以将水回收。冷凝器应装在出口
③电池工作时,电解质溶液会因稀释及吸收
 而变质,此时电解质溶液的
而变质,此时电解质溶液的 将
将(2)我国自行研制的“神舟”飞船使用了镍镉蓄电池组,其充放电时发生的反应为:
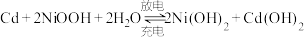 ,其电池装置如图所示,阴离子交换膜两侧均注入
,其电池装置如图所示,阴离子交换膜两侧均注入 溶液。
溶液。
①下列对于该镍镉电池的分析中,正确的是
A.图示中的电池应先充电后,再使用
B.充电时,
 从镍电极区迁移进入镉电极区
从镍电极区迁移进入镉电极区C.放电时,镍电极为电池的负极,镉电极为电池的正极
D.充电或放电一段时间后,两电极区溶液中
 的物质的量均未改变
的物质的量均未改变②镍镉电池在充电时,镉电极上发生的电极反应为
 和
和 耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体
耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体 。
。(3)载人航天器中氧气的再生是一个重要环节。利用萨巴蒂尔反应可将人呼出的二氧化碳转化为甲烷和水,配合太阳能电解水可以实现氧气的再生(大体流程如下图)。

已知:


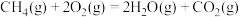
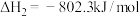
萨巴蒂尔反应:
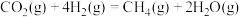

①萨巴蒂尔反应的焓变

②电解水装置中
 产生于
产生于③通过巴萨尔反应器和电解水装置能否实现H2与
 的完全再生?
的完全再生?
您最近一年使用:0次
【推荐1】乙烯是重要的有机化学原料,工业上可利用乙烷脱氢制备乙烯。
(1)乙烷裂解为乙烯为自由基反应,其可能的引发反应及对应化学键的解离能如下:
根据表格信息,乙烷裂解引发的反应主要为________________________ 。
(2)经过引发的后续反应历程为(已略去链终止过程):
……
 ΔH1
ΔH1
 ΔH2
ΔH2
①C2H4(g) +H2(g) →C2H6(g)的ΔH=________________________ (用含ΔH1和ΔH2的式子表示)。
②上述历程中“……”所代表的反应为____________________________________ 。
(3)CH3·中的单电子不能占据杂化轨道,则CH3·中碳原子的杂化方式为________________________ 。
(4)乙烷裂解中主要发生的反应及其在不同温度下的平衡常数如下表:
①当裂解反应达到平衡状态时,体系将会产生大量积碳。由表中数据分析,平衡时混合气体中____________ (填化学式)的百分含量最大,原因是______________ 。
②为提高乙烯的产率,工业生产的适宜反应条件为______ (填标号)。
A.高温 较长的反应时间 B.高温 较短的反应时间
C.低温 较长的反应时间 D.低温 较短的反应时间
③在某温度下投入 molC2H6发生上述反应,平衡时混合体系的压强为p,其中C2H6、C2H4、CH4的物质的量分别为mmol、nmol、rmol,未检测出C2H2。则此温度下反应Ⅰ的平衡常数Kp
molC2H6发生上述反应,平衡时混合体系的压强为p,其中C2H6、C2H4、CH4的物质的量分别为mmol、nmol、rmol,未检测出C2H2。则此温度下反应Ⅰ的平衡常数Kp
____________ (以分压表示,分压=总压 物质的量分数)。
物质的量分数)。
(5)工业上制备乙烯常使用Ni-Cr-Fe合金炉,某Ni-Cr-Fe合金的晶胞结构如图所示, 表示Ni原子,
表示Ni原子, 表示Fe原子,由4个Ni原子和2个Fe原子所形成的八面体空隙中心的一半填充Cr原子(如图中
表示Fe原子,由4个Ni原子和2个Fe原子所形成的八面体空隙中心的一半填充Cr原子(如图中 位置),则该合金可表示为
位置),则该合金可表示为__________ (填化学式)。

(1)乙烷裂解为乙烯为自由基反应,其可能的引发反应及对应化学键的解离能如下:
可能的引发反应 | 有关键的解离能( kJ/mol) |
C2H6(g) →C2H5 ·(g) +H·(g) | 410 |
C2H6(g)→ 2CH3·(g) | 368 |
(2)经过引发的后续反应历程为(已略去链终止过程):
……
 ΔH1
ΔH1 ΔH2
ΔH2①C2H4(g) +H2(g) →C2H6(g)的ΔH=
②上述历程中“……”所代表的反应为
(3)CH3·中的单电子不能占据杂化轨道,则CH3·中碳原子的杂化方式为
(4)乙烷裂解中主要发生的反应及其在不同温度下的平衡常数如下表:
反应 | 1100K | 1300K | 1500K |
I.C2H6 C2H4+H2 C2H4+H2 | 1.6 | 18.9 | 72.0 |
II.C2H6  C2H4 +CH4 C2H4 +CH4 | 60.9 | 108.7 | 165.8 |
III.C2H4 C2H2 +H2 C2H2 +H2 | 0.015 | 0.33 | 3.2 |
IV.C2H2 2C+H2 2C+H2 | 6.5×107 | 1.5×106 | 1.0×105 |
②为提高乙烯的产率,工业生产的适宜反应条件为
A.高温 较长的反应时间 B.高温 较短的反应时间
C.低温 较长的反应时间 D.低温 较短的反应时间
③在某温度下投入
 molC2H6发生上述反应,平衡时混合体系的压强为p,其中C2H6、C2H4、CH4的物质的量分别为mmol、nmol、rmol,未检测出C2H2。则此温度下反应Ⅰ的平衡常数Kp
molC2H6发生上述反应,平衡时混合体系的压强为p,其中C2H6、C2H4、CH4的物质的量分别为mmol、nmol、rmol,未检测出C2H2。则此温度下反应Ⅰ的平衡常数Kp
 物质的量分数)。
物质的量分数)。(5)工业上制备乙烯常使用Ni-Cr-Fe合金炉,某Ni-Cr-Fe合金的晶胞结构如图所示,
 表示Ni原子,
表示Ni原子, 表示Fe原子,由4个Ni原子和2个Fe原子所形成的八面体空隙中心的一半填充Cr原子(如图中
表示Fe原子,由4个Ni原子和2个Fe原子所形成的八面体空隙中心的一半填充Cr原子(如图中 位置),则该合金可表示为
位置),则该合金可表示为
您最近一年使用:0次
【推荐2】甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为2H2(g)+CO(g)=CH3OH(g) △H=akJ·mol-1,在不同温度下,K(500℃)=2.5(ml·L-1)-2,K(700℃)=0.2(mol·L-1)-2。
①△H___________ 0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH3OH物质的量分别为2mol、1mol、3mol,则此时生成CH3OH的速率____________ 消耗CH3OH的速率(填“>”、“<”、“=”)
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。甲醇制烯烃的主要反应有:
i 2CH3OH(g) C2H4(g)+2H2O(g) △H1=-20.9 kJ·mol-1
C2H4(g)+2H2O(g) △H1=-20.9 kJ·mol-1
ii 3CH3OH(g) C3H6(g)+3H2O (g) △H2=-98.1 kJ·mol-1
C3H6(g)+3H2O (g) △H2=-98.1 kJ·mol-1
iii 4CH3OH(g) C4H8(g)+4H2O(g) △H3=-118.1 kJ·mol-1
C4H8(g)+4H2O(g) △H3=-118.1 kJ·mol-1
①C3H6转化为C2H4的热化学方程式为iv:2C3H6(g) 3C2H4(g) △H4
3C2H4(g) △H4___________ 。
②加入N2作为稀释剂,反应i中C2H4的产率将___________ (填“增大”、“减小”或“不变”)
(3)为研究不同条件对反应的影响,测得不同温度下平衡时C2H4、C3H6和C4H8的物质的量分数变化,如图所示:
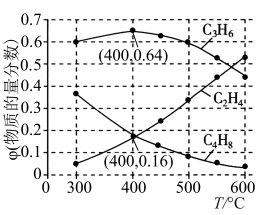
①随着温度的升高,C3H6的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是_________________________________ 。
②体系总压为0.1MPa,400℃时反应iv的平衡常数Kp=___________ (列式计算,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③为了获得更高的C2H4在产物中的比例,控制的条件较适宜的是___________ 。
A.较低温度 B.较高温度 C.增加水醇比 D.降低水醇比
(1)煤的液化发生的主要反应之一为2H2(g)+CO(g)=CH3OH(g) △H=akJ·mol-1,在不同温度下,K(500℃)=2.5(ml·L-1)-2,K(700℃)=0.2(mol·L-1)-2。
①△H
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH3OH物质的量分别为2mol、1mol、3mol,则此时生成CH3OH的速率
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。甲醇制烯烃的主要反应有:
i 2CH3OH(g)
 C2H4(g)+2H2O(g) △H1=-20.9 kJ·mol-1
C2H4(g)+2H2O(g) △H1=-20.9 kJ·mol-1ii 3CH3OH(g)
 C3H6(g)+3H2O (g) △H2=-98.1 kJ·mol-1
C3H6(g)+3H2O (g) △H2=-98.1 kJ·mol-1iii 4CH3OH(g)
 C4H8(g)+4H2O(g) △H3=-118.1 kJ·mol-1
C4H8(g)+4H2O(g) △H3=-118.1 kJ·mol-1①C3H6转化为C2H4的热化学方程式为iv:2C3H6(g)
 3C2H4(g) △H4
3C2H4(g) △H4②加入N2作为稀释剂,反应i中C2H4的产率将
(3)为研究不同条件对反应的影响,测得不同温度下平衡时C2H4、C3H6和C4H8的物质的量分数变化,如图所示:

①随着温度的升高,C3H6的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
②体系总压为0.1MPa,400℃时反应iv的平衡常数Kp=
③为了获得更高的C2H4在产物中的比例,控制的条件较适宜的是
A.较低温度 B.较高温度 C.增加水醇比 D.降低水醇比
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】填空。
(1)在25℃、 下,一定质量的无水乙醇完全燃烧时放出热量
下,一定质量的无水乙醇完全燃烧时放出热量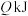 ,其燃烧生成的
,其燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得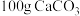 沉淀,则乙醇燃烧的热化学方程式为
沉淀,则乙醇燃烧的热化学方程式为______ 。
(2)如图1是反应 在不同温度下CO的转化率随时间变化的曲线。
在不同温度下CO的转化率随时间变化的曲线。
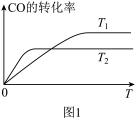
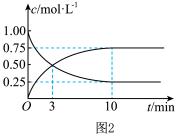
①T1和T2温度下的平衡常数大小关系是K1______ (填“>”“<”或“=”)K2。在T1温度下,往体积为1L的密闭容器中,充入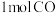 和
和 ,经测得CO和
,经测得CO和 的浓度随时间变化如图2所示。则0~3min内,以CO表示的该反应速率
的浓度随时间变化如图2所示。则0~3min内,以CO表示的该反应速率
______ (保留两位小数),达平衡时CO的转化率为______ ,该反应的平衡常数为______ 。
②若容器容积不变,下列措施可增加CO转化率的是______ (填字母)。
a.升高温度
b.将 从体系中分离
从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为 )与CO平衡转化率的关系,曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为。
)与CO平衡转化率的关系,曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为。______ 。

(1)在25℃、
 下,一定质量的无水乙醇完全燃烧时放出热量
下,一定质量的无水乙醇完全燃烧时放出热量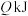 ,其燃烧生成的
,其燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得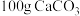 沉淀,则乙醇燃烧的热化学方程式为
沉淀,则乙醇燃烧的热化学方程式为(2)如图1是反应
 在不同温度下CO的转化率随时间变化的曲线。
在不同温度下CO的转化率随时间变化的曲线。
①T1和T2温度下的平衡常数大小关系是K1
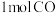 和
和 ,经测得CO和
,经测得CO和 的浓度随时间变化如图2所示。则0~3min内,以CO表示的该反应速率
的浓度随时间变化如图2所示。则0~3min内,以CO表示的该反应速率

②若容器容积不变,下列措施可增加CO转化率的是
a.升高温度
b.将
 从体系中分离
从体系中分离c.使用合适的催化剂
d.充入He,使体系总压强增大
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为
 )与CO平衡转化率的关系,曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为。
)与CO平衡转化率的关系,曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
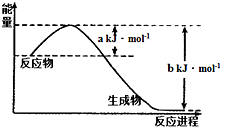
(1)右图是1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出此反应的热化学方程式为__________________________ ;
(2)在不同温度下,向VL密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:

请回答下列问题:
①T1℃时,该反应的平衡常数K=_______ ,若开始时反应物的用量均减小一半,平衡后NO的转化率将______________ (“增大”、“减小”或“不变”)
②当该反应达到平衡后下列说法正确的是______ (填序号)。
A.2v(CO2)消耗=v(NO)生成
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO2的物质的量浓度均不再变化
③若T1<T2,则△H0____________ (填“大于”或“小于”),
④T1℃时,若改变反应条件,导致NO浓度增大,则改变的条件可能是___________ (填序号)。
A.增加NO的量 B.加入催化剂 C.减小CO2的量 D.缩小容器体积 E.升温
(3)若用CO和氧气构成燃料电池,以熔融Li2CO3—K2CO3作电解质,负极电极反应式是_________
(1)右图是1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出此反应的热化学方程式为

(2)在不同温度下,向VL密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)
 N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:
请回答下列问题:
①T1℃时,该反应的平衡常数K=
②当该反应达到平衡后下列说法正确的是
A.2v(CO2)消耗=v(NO)生成
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO2的物质的量浓度均不再变化
③若T1<T2,则△H0
④T1℃时,若改变反应条件,导致NO浓度增大,则改变的条件可能是
A.增加NO的量 B.加入催化剂 C.减小CO2的量 D.缩小容器体积 E.升温
(3)若用CO和氧气构成燃料电池,以熔融Li2CO3—K2CO3作电解质,负极电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】雾霾天气多次肆虐我国中东部地区,京津地区一度诞生了“雾霾假期”.要有效控制雾霾改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
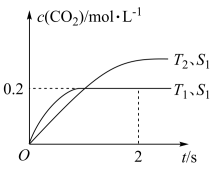
(1)汽车尾气净化的主要原理为 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时, 随温度
随温度 、催化剂的表面积
、催化剂的表面积 和时间
和时间 的变化曲线,如下图所示。据此判断:
的变化曲线,如下图所示。据此判断:
①该反应的
_______ 0(填“>”或“<”)。
②在 温度下,
温度下,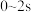 内的平均反应速率
内的平均反应速率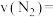
_______ 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积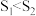 ,在图中画出
,在图中画出 在
在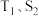 条件下达到平衡过程中的变化曲线
条件下达到平衡过程中的变化曲线_______ 。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到 时刻达到平衡状态的是
时刻达到平衡状态的是_______ (填字母)。
(2)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为 条件下,将
条件下,将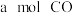 与
与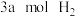 的混合气体在催化剂作用下反应生成甲醇:
的混合气体在催化剂作用下反应生成甲醇:
①若容器容积不变,下列措施可提高CO转化率的是_______ 。
A.升高温度 B.将 从体系中分离
从体系中分离
C.充入 ,使体系总压强增大 D.再充入
,使体系总压强增大 D.再充入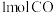 和
和
②经测定不同温度下该反应的平衡常数如下:
若某时刻, 测得该反应的反应物与生成物的浓度分别为
测得该反应的反应物与生成物的浓度分别为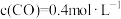 、
、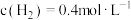 、
、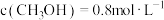 ,则此时v正
,则此时v正_______ v逆(填“>”、“<”或“=”)。
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO: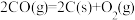 ,已知该反应的
,已知该反应的 ,判断该设想能否实现,并简述原因:
,判断该设想能否实现,并简述原因:_______ 。
(1)汽车尾气净化的主要原理为
 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时, 随温度
随温度 、催化剂的表面积
、催化剂的表面积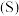 和时间
和时间 的变化曲线,如下图所示。据此判断:
的变化曲线,如下图所示。据此判断:
①该反应的

②在
 温度下,
温度下,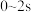 内的平均反应速率
内的平均反应速率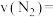
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积
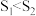 ,在图中画出
,在图中画出 在
在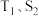 条件下达到平衡过程中的变化曲线
条件下达到平衡过程中的变化曲线④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到
 时刻达到平衡状态的是
时刻达到平衡状态的是
(2)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为
 条件下,将
条件下,将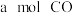 与
与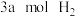 的混合气体在催化剂作用下反应生成甲醇:
的混合气体在催化剂作用下反应生成甲醇:
①若容器容积不变,下列措施可提高CO转化率的是
A.升高温度 B.将
 从体系中分离
从体系中分离C.充入
 ,使体系总压强增大 D.再充入
,使体系总压强增大 D.再充入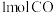 和
和
②经测定不同温度下该反应的平衡常数如下:
温度 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
若某时刻,
 测得该反应的反应物与生成物的浓度分别为
测得该反应的反应物与生成物的浓度分别为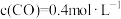 、
、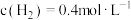 、
、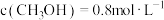 ,则此时v正
,则此时v正③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
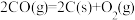 ,已知该反应的
,已知该反应的 ,判断该设想能否实现,并简述原因:
,判断该设想能否实现,并简述原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol-1
② CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
 CaS(s)+CO2(g) ΔH=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH=-47.3 kJ·mol-1
反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ΔH=
CaS(s)+3CO2(g) ΔH=________ kJ·mol-1
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
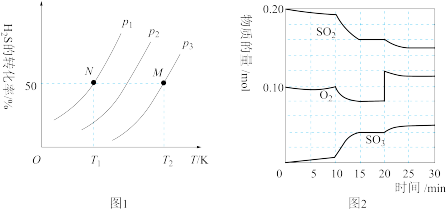
图1中压强p1、p2、p3的由大到小的顺序为__________ 。理由是_________________ 。计算温度T1、压强p1下(N点)平衡常数Kp=__________ 。(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是__________ 。
②据图2判断,反应进行至20 min时,曲线发生变化的原因是__________ (用文字表达)。10min到15 min的曲线变化的原因可能是__________ (填写字母)。
A.加了催化剂 B.降低温度 C.缩小容器体积 D.增加SO2的物质的量
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol-1②
 CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
 CaS(s)+CO2(g) ΔH=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH=-47.3 kJ·mol-1反应CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g) ΔH=
CaS(s)+3CO2(g) ΔH=(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。

图1中压强p1、p2、p3的由大到小的顺序为
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)
 2SO3(g) ΔH<0
2SO3(g) ΔH<0①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是
②据图2判断,反应进行至20 min时,曲线发生变化的原因是
A.加了催化剂 B.降低温度 C.缩小容器体积 D.增加SO2的物质的量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的_______ (填写编号),然后测定溶液的pH(已知25℃时,CH3COONH4溶液呈中性)。
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若_______ 的解释正确(填“甲”或“乙”),溶液的pH应_______ (填“增大”、“减小”或“不变”)。
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液。判断:
①溶液中共有_______ 种粒子。
②溶液中n(CH3COO-)+n(OH-)-n(H+)=_______ mol。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液。判断:
①溶液中共有
②溶液中n(CH3COO-)+n(OH-)-n(H+)=
您最近一年使用:0次
【推荐2】废旧钴金属片中的钴有+2 价和+3 价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回 收钴的工艺流程:
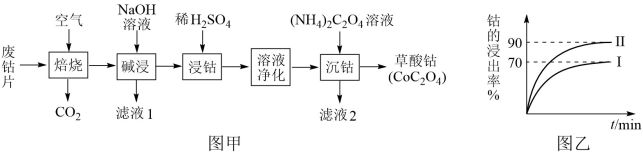
已知:①焙烧后 Mn 元素的化合价为+2
②
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是_____________ (任写一条)。
(2)滤液 1 含有的阴离子是____________ 。
(3)该流程中浸钴时,钴的浸出率最高只能达到 70%,后来改进方法,加入使用硫酸进行第一次浸取后, 再加入 Na2SO3溶液进行第二次浸取,从而使钴的浸出率达 90%以上,写出第二次浸出钴时溶液中发生反 应的离子方程式:___________________
(4)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液 pH 为 1.5~2.0 后,加 H2O2,反应一段时间,加 8%Na2CO3溶液,将溶液 的 pH 调至 4.0~5.0。请用化学平衡移动原理解释加入 Na2CO3溶液能除去溶液中铁元素的原因____________ 。
②除锰:加入 NaClO 溶液。写出该离子方程式:___________________ 。
③减钙镁:加入 NH4F 溶液,沉淀大部分的钙、镁的离子。 试解释为何草酸铵溶液沉钴前要减钙镁:_____ 。
(5)树德中学化学兴趣小组欲探究 CoC2O4•2H2O 受热后的分解产物,取 5.49gCoC2O4•2H2O(摩尔质量为183g/mol)于硬质玻璃管中加热一段时间,冷却、称量,剩余氧化物固体的质量为 2.41g。书写 CoC2O4•2H2O受热分解的化学方程式___________________________________ 。

已知:①焙烧后 Mn 元素的化合价为+2
②
| 物质 | MgF2 | CaF2 | CoF2 | MgC2O4 | CaC2O4 | CoC2O4 |
| 溶度积 | 4×10-9 | 5.3×10-9 | 4×10-3 | 5×10-6 | 6.4×10-9 | 1.7×10-7 |
(2)滤液 1 含有的阴离子是
(3)该流程中浸钴时,钴的浸出率最高只能达到 70%,后来改进方法,加入使用硫酸进行第一次浸取后, 再加入 Na2SO3溶液进行第二次浸取,从而使钴的浸出率达 90%以上,写出第二次浸出钴时溶液中发生反 应的离子方程式:
(4)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液 pH 为 1.5~2.0 后,加 H2O2,反应一段时间,加 8%Na2CO3溶液,将溶液 的 pH 调至 4.0~5.0。请用化学平衡移动原理解释加入 Na2CO3溶液能除去溶液中铁元素的原因
②除锰:加入 NaClO 溶液。写出该离子方程式:
③减钙镁:加入 NH4F 溶液,沉淀大部分的钙、镁的离子。 试解释为何草酸铵溶液沉钴前要减钙镁:
(5)树德中学化学兴趣小组欲探究 CoC2O4•2H2O 受热后的分解产物,取 5.49gCoC2O4•2H2O(摩尔质量为183g/mol)于硬质玻璃管中加热一段时间,冷却、称量,剩余氧化物固体的质量为 2.41g。书写 CoC2O4•2H2O受热分解的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】科学探究要实事求是、严谨细致。某化学兴趣小组设计实验进行有关氯化物的探究实验,回答下列问题:
Ⅰ.FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了以Fe粉和Cl2为原料制备无水FeCl3的实验方案,装置示意图如下:___________ 。
(2)装置A中设计g管的作用是___________ 。
(3)装置A中发生反应的离子方程式为___________ 。
Ⅱ.利用惰性电极电解0.1mol/LFeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
实验数据如表所示:
(4)由实验1、2现象可以得出结论:增大pH,___________ 优先于___________ 放电;
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol/L硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量X”是___________ ;
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验___________ 作对照实验;
③实验目的ii是___________ ;
④氯化铵在生产生活中有很多实用的用途,请写出一种应用:___________ 。
Ⅰ.FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了以Fe粉和Cl2为原料制备无水FeCl3的实验方案,装置示意图如下:
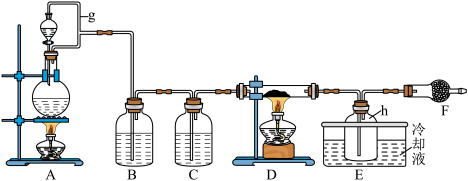
(2)装置A中设计g管的作用是
(3)装置A中发生反应的离子方程式为
Ⅱ.利用惰性电极电解0.1mol/LFeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
实验数据如表所示:
| 实验编号 | 电压/V | pH | 阳极现象 | 阴极现象 |
| 1 | 1.5 | 1.00 | 无气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
| 2 | 1.5 | 5.52 | 无气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 3 | 3.0 | 5.52 | 少量气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 4 | 4.5 | 5.52 | 大量气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
(4)由实验1、2现象可以得出结论:增大pH,
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
| 实验编号 | c(NH4Cl)/mol·L-1 | 温度/℃ | 待测物理量X | 实验目的 |
| 5 | 0.5 | 30 | a | ___________ |
| 6 | 1.5 | i | b | 探究浓度对氯化铵水解平衡的影响 |
| 7 | 1.5 | 35 | c | ii |
| 8 | 2.0 | 40 | d | 探究温度、浓度同时对氯化铵化解平衡的影响 |
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol/L硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量X”是
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验
③实验目的ii是
④氯化铵在生产生活中有很多实用的用途,请写出一种应用:
您最近一年使用:0次



