在某一容积为5 L的体积不变的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:

(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=________ mol/(L·min),该温度(800℃)下的平衡常数K=____________ 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有_______ (填字母)
E.加入催化剂
G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=___________ mol/L。
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率_____________ (填“升高”、“降低”还是“不变”)。
(5)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2)=c(H2)=0.13mol/L,则此反应是否处于平衡状态:____________ (填“是”或“否”),若没有处于平衡状态则该反应向____________ 方向移动。(填“正反应”或“逆反应”)
 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
| A.升高温度 |
| B.降低温度 |
| C.增大压强 |
| D.减小压强 |
E.加入催化剂
G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率
(5)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2)=c(H2)=0.13mol/L,则此反应是否处于平衡状态:
更新时间:2016-12-09 17:27:42
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
(1)已知:还原性HSO >I-,氧化性IO
>I-,氧化性IO >I2,在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应:NaIO3+NaHSO3→I2+Na2SO4+H2SO4+H2O
>I2,在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应:NaIO3+NaHSO3→I2+Na2SO4+H2SO4+H2O
①配平上述反应的化学方程式_______ ;并写出其氧化产物_______ 。
②在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为_______ (填化学式);
(2)向某密闭容器中加入0.15 mol/LA、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
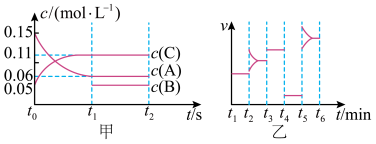
①若t4时改变的条件为减小压强,则B的起始物质的量浓度为_______ mol/L;
②若t1=15 s,则t0~t1阶段以C浓度变化表示的平均反应速率为v(C)=_______ mol/(L·s)。
③t3时改变的某一反应条件可能是_______ (选填序号)。
a.用催化剂 b.增大大压强 c.增大反应物浓度
④有甲、乙两个容积均为2L的密闭容器,在控制两容器温度相同且恒定情况下,向甲中通入3mol A,达到平衡时,B的体积分数为20%,则向乙容器中充入1 mol C和0.5mol B,达到平衡时,C的浓度c(C)=_______
(1)已知:还原性HSO
 >I-,氧化性IO
>I-,氧化性IO >I2,在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应:NaIO3+NaHSO3→I2+Na2SO4+H2SO4+H2O
>I2,在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应:NaIO3+NaHSO3→I2+Na2SO4+H2SO4+H2O①配平上述反应的化学方程式
②在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为
(2)向某密闭容器中加入0.15 mol/LA、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。

①若t4时改变的条件为减小压强,则B的起始物质的量浓度为
②若t1=15 s,则t0~t1阶段以C浓度变化表示的平均反应速率为v(C)=
③t3时改变的某一反应条件可能是
a.用催化剂 b.增大大压强 c.增大反应物浓度
④有甲、乙两个容积均为2L的密闭容器,在控制两容器温度相同且恒定情况下,向甲中通入3mol A,达到平衡时,B的体积分数为20%,则向乙容器中充入1 mol C和0.5mol B,达到平衡时,C的浓度c(C)=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】为加快实现“双碳”目标,有效应对全球气候变化、构建低碳社会,CO2资源化利用受到越来越多的关注。
I.利用CO2与CH4制备合成气CO、H2的反应历程如下:
第一步:CH4(g)+CO2(g)→C(ads)+2H2(g)+CO2(g) ΔH1=E1kJ·mol-1;
第二步:C(ads)+2H2(g)+CO2(g)→2CO(g)+2H2(g) ΔH2=E2kJ·mol-1;
说明:ads为吸附型催化剂。
(1)制备合成气总反应的反应热ΔH=___________ kJ·mol-1;
(2)一定条件下ads对CO2也有吸附作用。结合下图分析ads吸附CO2的适宜条件是___________ 。

(3)由甲烷生成乙烷的反应如下:2CH4 C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:
C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:
该反应的速率方程为:v=___________ mol·L-1·min-1[用含c(CH4)的代数式表示]。
Ⅱ.CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
反应1:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应2:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(4)已知温度为T时,向0.5L恒容密闭容器中充入2molCO2和6molH2,一段时间后达到平衡,测得体系中生成2.5molH2O,压强变为原来的75%,反应1的平衡常数K=___________ (用分数表示),CH4选择性=___________ (CH4选择性= ,保留三位有效数字)。
,保留三位有效数字)。
I.利用CO2与CH4制备合成气CO、H2的反应历程如下:
第一步:CH4(g)+CO2(g)→C(ads)+2H2(g)+CO2(g) ΔH1=E1kJ·mol-1;
第二步:C(ads)+2H2(g)+CO2(g)→2CO(g)+2H2(g) ΔH2=E2kJ·mol-1;
说明:ads为吸附型催化剂。
(1)制备合成气总反应的反应热ΔH=
(2)一定条件下ads对CO2也有吸附作用。结合下图分析ads吸附CO2的适宜条件是

(3)由甲烷生成乙烷的反应如下:2CH4
 C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:
C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:| 实验编号 | 1 | 2 | 3 | 4 |
| c(CH4)/(mol·L-1) | 0.1000 | 0.2000 | 0.3000 | 0.4000 |
| v/(mol·L-1·min-1) | 0.0076 | 0.0153 | 0.0227 | 0.0306 |
Ⅱ.CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
反应1:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)反应2:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)(4)已知温度为T时,向0.5L恒容密闭容器中充入2molCO2和6molH2,一段时间后达到平衡,测得体系中生成2.5molH2O,压强变为原来的75%,反应1的平衡常数K=
 ,保留三位有效数字)。
,保留三位有效数字)。
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) ΔH=−41 kJ·mol−1
H2(g)+CO2(g) ΔH=−41 kJ·mol−1
②C(s)+2H2(g) CH4(g) ΔH=−73 kJ·mol−1
CH4(g) ΔH=−73 kJ·mol−1
③2CO(g) C(s)+CO2(g) ΔH=−171 kJ·mol−1
C(s)+CO2(g) ΔH=−171 kJ·mol−1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:__________________ 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①反应的化学方程式为:___________________________ 。
②从反应开始到平衡,氢气的平均反应速率v(H2)=_____________ mol/(L∙min)。
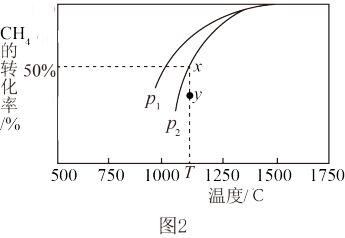
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g) H2(g)+CO2(g)中CO的平衡转化率随
H2(g)+CO2(g)中CO的平衡转化率随 及温度变化关系如图所示:[p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
及温度变化关系如图所示:[p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
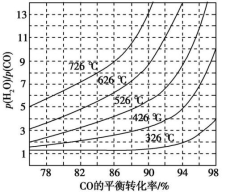
上述反应的逆反应方向是_____________ 反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=______________ ,提高 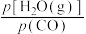 ,则Kp
,则Kp_____________ (填“变大”、“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、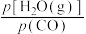 =3~5,采用此条件的原因可能是
=3~5,采用此条件的原因可能是___________ 。
(1)已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH=−41 kJ·mol−1
H2(g)+CO2(g) ΔH=−41 kJ·mol−1②C(s)+2H2(g)
 CH4(g) ΔH=−73 kJ·mol−1
CH4(g) ΔH=−73 kJ·mol−1③2CO(g)
 C(s)+CO2(g) ΔH=−171 kJ·mol−1
C(s)+CO2(g) ΔH=−171 kJ·mol−1写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①反应的化学方程式为:
②从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)
 H2(g)+CO2(g)中CO的平衡转化率随
H2(g)+CO2(g)中CO的平衡转化率随 及温度变化关系如图所示:[p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
及温度变化关系如图所示:[p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
上述反应的逆反应方向是
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=
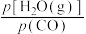 ,则Kp
,则Kp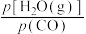 =3~5,采用此条件的原因可能是
=3~5,采用此条件的原因可能是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.分别取40mL0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热 。请回答下列问题:
。请回答下列问题:
(1)本实验除烧杯、量筒外还缺少的玻璃仪器名称为___________ 。
(2)若某同学通过该实验测定出中和热 偏大,请分析可能的原因是
偏大,请分析可能的原因是___________ (填序号)。
A.用量筒量取盐酸时仰视读数
B.分多次将NaOH溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.为探究化学反应速率的影响因素,设计的实验方案如下表:(已知KI溶液、 溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
(3)写出混合溶液中滴入H2O2溶液反应的离子方程式为___________ 。
(4)表中的V=___________ mL,t1、t2、t3由小到大的顺序为___________ 。
(5)某同学研究浓度对化学平衡的影响。他向5mL 0.1mol/L K2Cr2O7溶液中加入几滴5mol/L NaOH溶液溶液颜色变化为___________ 。
 。请回答下列问题:
。请回答下列问题:(1)本实验除烧杯、量筒外还缺少的玻璃仪器名称为
(2)若某同学通过该实验测定出中和热
 偏大,请分析可能的原因是
偏大,请分析可能的原因是A.用量筒量取盐酸时仰视读数
B.分多次将NaOH溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.为探究化学反应速率的影响因素,设计的实验方案如下表:(已知KI溶液、
 溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)| 向烧杯中加入的试剂及用量/mL | |||||||
| 0.1mol/L KI溶液 | 0.1mol/L H2O2溶液 | 0.1mol/L H2SO4溶液 | 淀粉溶液 | H2O | 时间/s | ||
| ① | 25℃ | 20.0 | 10.0 | 5.0 | 1.0 | 0.0 | t1 |
| ② | 40℃ | 20.0 | 10.0 | 5.0 | 1.0 | 0.0 | t2 |
| ③ | 25℃ | 20.0 | 5.0 | 5.0 | 1.0 | V | t3 |
(4)表中的V=
(5)某同学研究浓度对化学平衡的影响。他向5mL 0.1mol/L K2Cr2O7溶液中加入几滴5mol/L NaOH溶液溶液颜色变化为
您最近半年使用:0次
【推荐2】重铬酸钾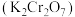 具有强氧化性,在实验室和工业中都有广泛的应用。
具有强氧化性,在实验室和工业中都有广泛的应用。 (黄色)和
(黄色)和 (橙色)在溶液中可相互转化。
(橙色)在溶液中可相互转化。
(1) 中元素铬(Cr)的化合价为
中元素铬(Cr)的化合价为_______ 。
(2)室温下,初始浓度为 的
的 溶液中
溶液中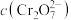 随
随 的变化如图所示。(忽略溶液体积变化)
的变化如图所示。(忽略溶液体积变化)

①用离子方程式表示 溶液中的转化反应
溶液中的转化反应_______ 。
②计算B点时 的转化率为
的转化率为_______ 。
③根据A点数据,计算上述反应的平衡常数_______ 。
(3)向橙色的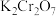 溶液中,滴加
溶液中,滴加 溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是_______ ,用平衡移动的原理解释溶液pH变小的原因是_______ 。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定二价铁含量。
用 溶液滴定20.00mL未知浓度的含
溶液滴定20.00mL未知浓度的含 的溶液,恰好完全反应时消耗
的溶液,恰好完全反应时消耗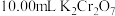 溶液,则溶液中
溶液,则溶液中 的物质的量浓度是
的物质的量浓度是_______ (已知: (未配平)。
(未配平)。
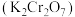 具有强氧化性,在实验室和工业中都有广泛的应用。
具有强氧化性,在实验室和工业中都有广泛的应用。 (黄色)和
(黄色)和 (橙色)在溶液中可相互转化。
(橙色)在溶液中可相互转化。(1)
 中元素铬(Cr)的化合价为
中元素铬(Cr)的化合价为(2)室温下,初始浓度为
 的
的 溶液中
溶液中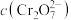 随
随 的变化如图所示。(忽略溶液体积变化)
的变化如图所示。(忽略溶液体积变化)
①用离子方程式表示
 溶液中的转化反应
溶液中的转化反应②计算B点时
 的转化率为
的转化率为③根据A点数据,计算上述反应的平衡常数
(3)向橙色的
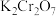 溶液中,滴加
溶液中,滴加 溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是(4)用重铬酸钾法(一种氧化还原滴定法)可测定二价铁含量。
用
 溶液滴定20.00mL未知浓度的含
溶液滴定20.00mL未知浓度的含 的溶液,恰好完全反应时消耗
的溶液,恰好完全反应时消耗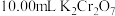 溶液,则溶液中
溶液,则溶液中 的物质的量浓度是
的物质的量浓度是 (未配平)。
(未配平)。
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
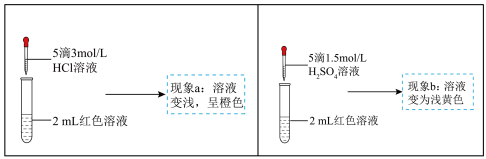
【推荐3】实验小组探究酸对 平衡的影响。将0.005mol/LFeCl3溶液(接近无色)和0.01mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
平衡的影响。将0.005mol/LFeCl3溶液(接近无色)和0.01mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
(1) 水解显酸性的原因是
水解显酸性的原因是_____ (用方程式表示)。
(2)甲同学认为加入酸后,会使 体系中
体系中_____ 浓度改变,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】
① 和
和 、
、 均能发生络合反应:
均能发生络合反应:
 (黄色);
(黄色); (无色)。
(无色)。
②0.005mol/L时, 显无色。
显无色。
实验I.探究现象a中溶液颜色变化的原因
(3)实验①的目的是_____ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:_____ 。
实验Ⅱ.探究现象b中溶液呈浅黄色的原因
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是 和
和_____
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒不是 ,请将实验④的操作及现象补充完整:
,请将实验④的操作及现象补充完整:_____ 、_____ 。
 平衡的影响。将0.005mol/LFeCl3溶液(接近无色)和0.01mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
平衡的影响。将0.005mol/LFeCl3溶液(接近无色)和0.01mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。(1)
 水解显酸性的原因是
水解显酸性的原因是(2)甲同学认为加入酸后,会使
 体系中
体系中【设计并实施实验】

【查阅资料】
①
 和
和 、
、 均能发生络合反应:
均能发生络合反应: (黄色);
(黄色); (无色)。
(无色)。②0.005mol/L时,
 显无色。
显无色。实验I.探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol/LKCl溶液 | 溶液颜色变浅,呈橙色 |
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验Ⅱ.探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
| ③ | 取1mL0.0025mol/L 溶液(无色),加入1mL0.01 溶液(无色),加入1mL0.01mol/LKSCN溶液,再加入5滴1.5mol/L  溶液 溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL0.005mol/L 溶液,_____ 溶液,_____ | _____ |
 和
和(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒不是
 ,请将实验④的操作及现象补充完整:
,请将实验④的操作及现象补充完整:
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:
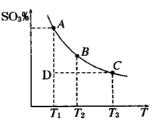
①2SO2(g)+O2(g) 2SO3(g)的△H
2SO3(g)的△H__________ 0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是_________ 。
a.体系的密度不发生变化 b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化 d.单位时间内反应物转移4 mol 电子,同时消耗2 mol SO3 e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
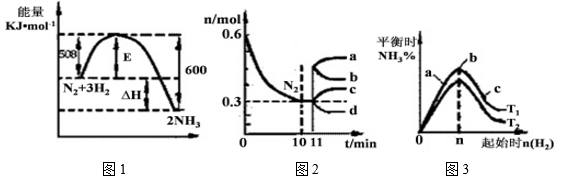
①升高温度,该反应的平衡常数__________ (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=________ ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为________ (填“a”或“b”或“c”或“d”)。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______ 点,温度T1 ___ T2(填“>”或“=”或“<”)。
(1)硫酸生产过程中2SO2(g)+O2(g)
 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:
①2SO2(g)+O2(g)
 2SO3(g)的△H
2SO3(g)的△H②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是
a.体系的密度不发生变化 b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化 d.单位时间内反应物转移4 mol 电子,同时消耗2 mol SO3 e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)
 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
①升高温度,该反应的平衡常数
②由图2信息,计算0~10min内该反应的平均速率v(H2)=
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________ 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________ 。
(2)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)________ 。

(3)某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________ (可用分数表示)。
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________ b(填“>”、“=”或“<”,下同),Q1________ Q2,Q1_______ Q。
 2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越
(2)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)

(3)某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】乙炔可用于照明、焊接及切割金属,也是制备乙醛、苯、合成橡胶等的基本原料。甲烷催化裂解是工业上制备乙炔的方法之一、回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(l) △H1= - 572 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H2= - 2600 kJ/mol
CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) △H 3= - 885 kJ/mol
则2CH4(g)=C2H2(g)+3H2(g) △H=___________ kJ/mol。
(2)某科研小组利用固体催化工艺进行CH4裂解制备C2H2。
①用 和
和 分别表示 CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程可表示如下:
分别表示 CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程可表示如下:
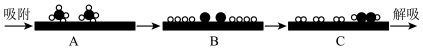
从“吸附”到“解吸”过程中,能量状态最高的是___________ 。 (填标号),理由是___________ 。
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率a(CH4)随温度t0℃/C的关系如图甲所示,t0℃后a(CH4)急剧下降的原因可能是___________ 。

(3)甲烷分解体系中几种气体的平衡分压(p/Pa)与温度(t/℃)的关系如图乙所示。
①在某温度下,向V L恒容密闭容器中充入0.12 mol CH4,若只发生反应:2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得p(H2)=p(CH4),则CH4的平衡转化率为
C2H4(g)+2H2(g),达到平衡时,测得p(H2)=p(CH4),则CH4的平衡转化率为___________ (结果保留两位有效数字)。
②T℃时,反应2CH4(g) C2H2(g)+ 3H2(g)的压强平衡常数Kp=
C2H2(g)+ 3H2(g)的压强平衡常数Kp=___________ Pa2。
(1)已知:2H2(g)+O2(g)=2H2O(l) △H1= - 572 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H2= - 2600 kJ/mol
CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) △H 3= - 885 kJ/mol
则2CH4(g)=C2H2(g)+3H2(g) △H=
(2)某科研小组利用固体催化工艺进行CH4裂解制备C2H2。
①用
 和
和 分别表示 CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程可表示如下:
分别表示 CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程可表示如下:
从“吸附”到“解吸”过程中,能量状态最高的是
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率a(CH4)随温度t0℃/C的关系如图甲所示,t0℃后a(CH4)急剧下降的原因可能是

(3)甲烷分解体系中几种气体的平衡分压(p/Pa)与温度(t/℃)的关系如图乙所示。
①在某温度下,向V L恒容密闭容器中充入0.12 mol CH4,若只发生反应:2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得p(H2)=p(CH4),则CH4的平衡转化率为
C2H4(g)+2H2(g),达到平衡时,测得p(H2)=p(CH4),则CH4的平衡转化率为②T℃时,反应2CH4(g)
 C2H2(g)+ 3H2(g)的压强平衡常数Kp=
C2H2(g)+ 3H2(g)的压强平衡常数Kp=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】在工业上,常用CO和H2合成甲醇,其相关的反应原理方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知:①CO(g)+ O2(g)= CO2(g) △H1= a kJ/mol
O2(g)= CO2(g) △H1= a kJ/mol
②H2(g)+ O2(g)=H2O(g) △H2= b kJ/mol
O2(g)=H2O(g) △H2= b kJ/mol
③CH3OH(g)+ O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
回答下列问题:
(1)△H=___________ kJ/mol 。
(2)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是___________(填字母)。
CH3OH(g)已达平衡状态的是___________(填字母)。
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。

①当起始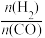 =2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)
=2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)___________ 。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将___________ (选填“增大”、“减小”或“不变”);
②当起始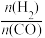 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________ 点(选填“D”、“E”或“F”) 。
(4)已知CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1___________ P2(选填“>” “<” 或“=”);当压强为P2时,在y点:v(正)___________ v(逆)(选填“大于”、“小于”或“等于”)。若P2=3MPa且在恒压体系中发生,则T℃时该反应的平衡常数Kp = ___________ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 CH3OH(g) △H
CH3OH(g) △H 已知:①CO(g)+
 O2(g)= CO2(g) △H1= a kJ/mol
O2(g)= CO2(g) △H1= a kJ/mol ②H2(g)+
 O2(g)=H2O(g) △H2= b kJ/mol
O2(g)=H2O(g) △H2= b kJ/mol③CH3OH(g)+
 O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol 回答下列问题:
(1)△H=
(2)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是___________(填字母)。
CH3OH(g)已达平衡状态的是___________(填字母)。| A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |

①当起始
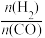 =2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)
=2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)②当起始
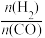 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的(4)已知CO2(g)+CH4(g)
 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲醇是重要的化工原料,也是重要的绿色能源。
(1)已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=﹣1323kJ•mol﹣1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1292kJ•mol﹣1
乙烯水合也可得到CH3OH(g),写出相应的热化学方程式:___________ 。若使用更高效的催化剂,则C2H4、H2O的活化分子数目会因___________ 的减小而增加。
(2)在某刚性密闭容器中进行的反应:3H2(g)+CO2(g) CH3OH(g)+H2O(g)。测得投料比X[X=
CH3OH(g)+H2O(g)。测得投料比X[X=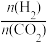 ]不同的情况下,CO2的平衡转化率与温度关系如图所示。
]不同的情况下,CO2的平衡转化率与温度关系如图所示。
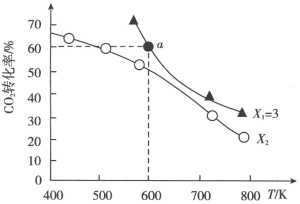
①X2___________ (填“>”或“<”,下同)3,该反应的△H___________ 0。
②a点时H2的平衡转化率为___________ ,若反应开始时压强为p0,用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数,则a点时的Kp=___________ 。
③写出在一定温度下进行反应时,能提高CO2转化率的一种方法:___________ 。
(1)已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=﹣1323kJ•mol﹣1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1292kJ•mol﹣1
乙烯水合也可得到CH3OH(g),写出相应的热化学方程式:
(2)在某刚性密闭容器中进行的反应:3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)。测得投料比X[X=
CH3OH(g)+H2O(g)。测得投料比X[X=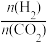 ]不同的情况下,CO2的平衡转化率与温度关系如图所示。
]不同的情况下,CO2的平衡转化率与温度关系如图所示。
①X2
②a点时H2的平衡转化率为
③写出在一定温度下进行反应时,能提高CO2转化率的一种方法:
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】煤制天然气的过程中涉及到煤气化反应和水气变换反应。回答下列问题:
煤气化反应Ⅰ:C(s)+H2O(g) CO(g)+H2(g) ∆H=+135 kJ∙mol-1
CO(g)+H2(g) ∆H=+135 kJ∙mol-1
水气变换反应Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) ∆H=-42.3 kJ∙mol-1
CO2(g)+H2(g) ∆H=-42.3 kJ∙mol-1
为了进一步探究反应条件对反应Ⅱ的影响,某活动小组设计了三个实验,实验曲线如图二所示:
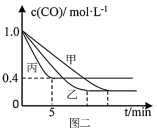
(1)请依据图二的实验曲线补充完整表格中的实验条件:X=__ ℃,Y=__ MPa。
(2)实验丙从开始至5 min末,平均反应速率v(CO)__ 。
(3)达平衡时CO的转化率:实验乙__ 实验丙(填“大于”、“小于”或“等于”)。
(4)530℃时,反应Ⅱ的平衡常数K=1,若往某刚性容器中投入0.2 mol·L-1CO、0.2 mol·L-1H2O、0.1 mol·L-1CO2、0.2 mol·L-1H2,列简式计算并说明该反应进行的方向___ 。
煤气化反应Ⅰ:C(s)+H2O(g)
 CO(g)+H2(g) ∆H=+135 kJ∙mol-1
CO(g)+H2(g) ∆H=+135 kJ∙mol-1水气变换反应Ⅱ:CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H=-42.3 kJ∙mol-1
CO2(g)+H2(g) ∆H=-42.3 kJ∙mol-1为了进一步探究反应条件对反应Ⅱ的影响,某活动小组设计了三个实验,实验曲线如图二所示:

| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| 甲 | 530 ℃ | 3 MPa | 1.0 mol·L-1 | 3.0 mol·L-1 |
| 乙 | X | Y | 1.0 mol·L-1 | 3.0 mol·L-1 |
| 丙 | 630 ℃ | 5 MPa | 1.0 mol·L-1 | 3.0 mol·L-1 |
(2)实验丙从开始至5 min末,平均反应速率v(CO)
(3)达平衡时CO的转化率:实验乙
(4)530℃时,反应Ⅱ的平衡常数K=1,若往某刚性容器中投入0.2 mol·L-1CO、0.2 mol·L-1H2O、0.1 mol·L-1CO2、0.2 mol·L-1H2,列简式计算并说明该反应进行的方向
您最近半年使用:0次



