运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)已知:①NH3 (g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.5kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
写出氨高温催化氧化生成NO的热化学方程式___________ 。
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+302=2N2+6H2O。已知电解质溶液为KOH溶液,则负极的电极反应式为________ 。
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如下:

由上表数据可知该反应的△H_______ 0 填“> ”、“< ”或“=”) ;
理论上,为了增大平衡时H2的转化率,可采取的措施是_______ (选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2 mol·L-1、l mol·L-1,此时刻该反应的V正(N2)=______ V逆(N2)。(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38, Ksp[Al(OH)3]=3.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol·L-1时,可以认为沉淀完全。在含Fe3+、A13+的浓度均为1. 05mol·L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数____________ 。
(1)已知:①NH3 (g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.5kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
写出氨高温催化氧化生成NO的热化学方程式
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+302=2N2+6H2O。已知电解质溶液为KOH溶液,则负极的电极反应式为
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如下:

由上表数据可知该反应的△H
理论上,为了增大平衡时H2的转化率,可采取的措施是
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2 mol·L-1、l mol·L-1,此时刻该反应的V正(N2)=
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38, Ksp[Al(OH)3]=3.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol·L-1时,可以认为沉淀完全。在含Fe3+、A13+的浓度均为1. 05mol·L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数
更新时间:2017-05-08 21:26:31
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】我国要在2030年前实现碳达峰、2060年前实现碳中和的目标, 的捕集与转化是研究的重要课题。
的捕集与转化是研究的重要课题。

(1) 和
和 重整可制合成气CO和
重整可制合成气CO和 ,其热化学反应方程式为
,其热化学反应方程式为
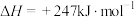 。已知下列热化学反应方程式:
。已知下列热化学反应方程式:
反应1: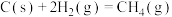

反应2:
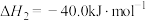
反应3:
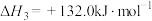
则
_____  。
。
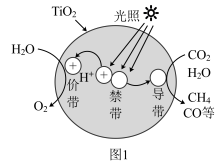
(2)光催化还原法实现 甲烷化可能的反应机理如图1所示。该过程可简述为:光照条件下,催化剂
甲烷化可能的反应机理如图1所示。该过程可简述为:光照条件下,催化剂 表面的价带(VB)中失去的电子(图中电子以
表面的价带(VB)中失去的电子(图中电子以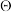 表示)激发至导带(CB)中,价带中形成电子空穴
表示)激发至导带(CB)中,价带中形成电子空穴 (图中
(图中 以
以 表示,
表示, 具有强氧化性),
具有强氧化性), 在VB端,
在VB端, 在CB端发生类似于电解原理的反应。
在CB端发生类似于电解原理的反应。
①在价带的电极反应式为_____ 。
②在催化剂 表面,每生成
表面,每生成 ,则价带产生的空穴
,则价带产生的空穴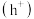 数为
数为_____  。
。
(3)一种电化学法将 转化为乙烯的原理如图2所示。
转化为乙烯的原理如图2所示。
①阴极上的电极反应式为_____ 。
②已知铅蓄电池发生的总反应为: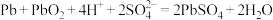 。以铅蓄电池为电源,每生成
。以铅蓄电池为电源,每生成 乙烯,理论上需消耗铅蓄电池中硫酸的物质的量为
乙烯,理论上需消耗铅蓄电池中硫酸的物质的量为_____ 。
(4) 和
和 可合成甲烷,合成过程中发生如下反应:
可合成甲烷,合成过程中发生如下反应:

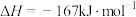


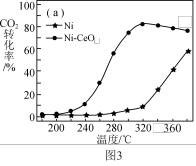
反应的压强和 与
与 气体比例一定,在两种不同催化剂条件下反应相同时间,测得
气体比例一定,在两种不同催化剂条件下反应相同时间,测得 的转化率随温度变化关系如图3所示。高于320℃后,以
的转化率随温度变化关系如图3所示。高于320℃后,以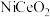 为催化剂,
为催化剂, 转化率略有下降,以Ni为催化剂,
转化率略有下降,以Ni为催化剂, 转化率大幅上升,其原因是
转化率大幅上升,其原因是_____ 。
 的捕集与转化是研究的重要课题。
的捕集与转化是研究的重要课题。


(1)
 和
和 重整可制合成气CO和
重整可制合成气CO和 ,其热化学反应方程式为
,其热化学反应方程式为
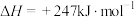 。已知下列热化学反应方程式:
。已知下列热化学反应方程式:反应1:
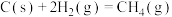

反应2:

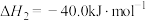
反应3:

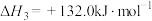
则

 。
。(2)光催化还原法实现
 甲烷化可能的反应机理如图1所示。该过程可简述为:光照条件下,催化剂
甲烷化可能的反应机理如图1所示。该过程可简述为:光照条件下,催化剂 表面的价带(VB)中失去的电子(图中电子以
表面的价带(VB)中失去的电子(图中电子以 表示)激发至导带(CB)中,价带中形成电子空穴
表示)激发至导带(CB)中,价带中形成电子空穴 (图中
(图中 以
以 表示,
表示, 具有强氧化性),
具有强氧化性), 在VB端,
在VB端, 在CB端发生类似于电解原理的反应。
在CB端发生类似于电解原理的反应。①在价带的电极反应式为
②在催化剂
 表面,每生成
表面,每生成 ,则价带产生的空穴
,则价带产生的空穴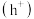 数为
数为 。
。(3)一种电化学法将
 转化为乙烯的原理如图2所示。
转化为乙烯的原理如图2所示。①阴极上的电极反应式为
②已知铅蓄电池发生的总反应为:
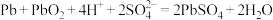 。以铅蓄电池为电源,每生成
。以铅蓄电池为电源,每生成 乙烯,理论上需消耗铅蓄电池中硫酸的物质的量为
乙烯,理论上需消耗铅蓄电池中硫酸的物质的量为(4)
 和
和 可合成甲烷,合成过程中发生如下反应:
可合成甲烷,合成过程中发生如下反应:
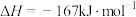


反应的压强和
 与
与 气体比例一定,在两种不同催化剂条件下反应相同时间,测得
气体比例一定,在两种不同催化剂条件下反应相同时间,测得 的转化率随温度变化关系如图3所示。高于320℃后,以
的转化率随温度变化关系如图3所示。高于320℃后,以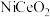 为催化剂,
为催化剂, 转化率略有下降,以Ni为催化剂,
转化率略有下降,以Ni为催化剂, 转化率大幅上升,其原因是
转化率大幅上升,其原因是
您最近一年使用:0次
【推荐2】甲醇作为新型清洁可再生燃料,对缓解能源危机以及实现“碳中和”目标具有重要的战略意义。
I.二氧化碳在某种催化剂条件下加氢制甲醇反应过程如下:
①
②
(1)二氧化碳加氢制甲醇的总反应热化学方程式:________ 。
(2)该催化条件下,实际工业生产中,需要在 、压强恒为
、压强恒为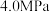 的反应釜中进行上述反应。初始时向反应釜中加入0.01mol CO2(g)和0.03molH2(g),为确保反应的连续性,需向反应釜中以进气流量0.04mol /min、
的反应釜中进行上述反应。初始时向反应釜中加入0.01mol CO2(g)和0.03molH2(g),为确保反应的连续性,需向反应釜中以进气流量0.04mol /min、 持续通入原料,同时控制出气流量。
持续通入原料,同时控制出气流量。
①需控制出气流量小于进气流量的原因为________ 。
②已知出气流量为0.03mol/min,单位时间CO2(g)的转化率为60%,则流出气体中CO(g)的百分含量为________ 。
(3)另一种CO2催化加氢合成CH3OH机理如图1所示(吸附在催化剂表面的物种用*标注)。

从化学键视角,图中ⅰ与ⅱ的过程可描述为________ 。
Ⅱ.用电解法可将CO2转化为多种燃料,原理如图2所示。
(4)若阴极只生成 ,且各产物生成速率相同,则相同条件下,Pt电极产生的O2与Cu电极上产生的C2H4的体积比为
,且各产物生成速率相同,则相同条件下,Pt电极产生的O2与Cu电极上产生的C2H4的体积比为________ 。
(5)甲醇作为一种高能量密度的能源载体,具有广阔的发展前景。
已知:燃料的能量密度是单位体积的燃料包含的能量,单位kJ/m3。热值是单位质量的燃料完全燃烧时所放出的热量,单位kJ/g。
在一定温度和催化剂作用下,车载甲醇可直接转变为氢气,从而为氢氧燃料电池提供氢源。已知氢气和甲醇的热值分别为143kJ/g和23kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优点是________ 。
I.二氧化碳在某种催化剂条件下加氢制甲醇反应过程如下:
①

②

(1)二氧化碳加氢制甲醇的总反应热化学方程式:
(2)该催化条件下,实际工业生产中,需要在
 、压强恒为
、压强恒为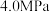 的反应釜中进行上述反应。初始时向反应釜中加入0.01mol CO2(g)和0.03molH2(g),为确保反应的连续性,需向反应釜中以进气流量0.04mol /min、
的反应釜中进行上述反应。初始时向反应釜中加入0.01mol CO2(g)和0.03molH2(g),为确保反应的连续性,需向反应釜中以进气流量0.04mol /min、 持续通入原料,同时控制出气流量。
持续通入原料,同时控制出气流量。①需控制出气流量小于进气流量的原因为
②已知出气流量为0.03mol/min,单位时间CO2(g)的转化率为60%,则流出气体中CO(g)的百分含量为
(3)另一种CO2催化加氢合成CH3OH机理如图1所示(吸附在催化剂表面的物种用*标注)。

从化学键视角,图中ⅰ与ⅱ的过程可描述为
Ⅱ.用电解法可将CO2转化为多种燃料,原理如图2所示。
(4)若阴极只生成
 ,且各产物生成速率相同,则相同条件下,Pt电极产生的O2与Cu电极上产生的C2H4的体积比为
,且各产物生成速率相同,则相同条件下,Pt电极产生的O2与Cu电极上产生的C2H4的体积比为(5)甲醇作为一种高能量密度的能源载体,具有广阔的发展前景。
已知:燃料的能量密度是单位体积的燃料包含的能量,单位kJ/m3。热值是单位质量的燃料完全燃烧时所放出的热量,单位kJ/g。
在一定温度和催化剂作用下,车载甲醇可直接转变为氢气,从而为氢氧燃料电池提供氢源。已知氢气和甲醇的热值分别为143kJ/g和23kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优点是
您最近一年使用:0次
【推荐3】CO、CO2的转化和利用是环境化学研究的热点课题。
(1)已知:CO的燃烧热为-283.0 kJ·mol1。CO(g)+O2(g) CO2(g) +O(g) ΔH=-33.5 kJ·mol1,
CO2(g) +O(g) ΔH=-33.5 kJ·mol1,
则2O(g) O2(g) ΔH=
O2(g) ΔH=_________ kJ·mol1。
(2)沥青混凝土可作为反应2CO(g)+O2(g) 2CO2(g)的催化剂。在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系如图所示。
2CO2(g)的催化剂。在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系如图所示。
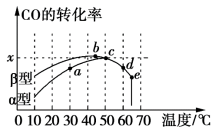
①a、b、c、d 四点中,未达到平衡状态的点是_________________ (填字母代号)。d点对应的转化率比b点低,其主要原因是___________________________ 。
②在均未达到平衡状态时,同温度下对上述反应催化效率较高的是_________ (填“α”或“β”)型沥青混凝土。e点CO的转化率突变,其可能的原因是___________________________ 。
③已知c点时容器中O2浓度为0.04 mol·L1,则50 ℃时,在α型沥青混凝土中CO转化反应的平衡常数K=____________ (用含x的代数式表示)。
(3)CO也是一种燃料。CO-空气碱性(KOH为电解质)燃料电池中,正极区充入_________ (填“CO”或“空气”);若在放电过程中恰好生成KHCO3,写出此时负极的电极反应式:__________________ 。
(1)已知:CO的燃烧热为-283.0 kJ·mol1。CO(g)+O2(g)
 CO2(g) +O(g) ΔH=-33.5 kJ·mol1,
CO2(g) +O(g) ΔH=-33.5 kJ·mol1,则2O(g)
 O2(g) ΔH=
O2(g) ΔH=(2)沥青混凝土可作为反应2CO(g)+O2(g)
 2CO2(g)的催化剂。在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系如图所示。
2CO2(g)的催化剂。在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系如图所示。
①a、b、c、d 四点中,未达到平衡状态的点是
②在均未达到平衡状态时,同温度下对上述反应催化效率较高的是
③已知c点时容器中O2浓度为0.04 mol·L1,则50 ℃时,在α型沥青混凝土中CO转化反应的平衡常数K=
(3)CO也是一种燃料。CO-空气碱性(KOH为电解质)燃料电池中,正极区充入
您最近一年使用:0次
【推荐1】异丁烯是一种重要的化工原料,主要用于制备甲基叔丁基醚、丁基橡胶、甲基丙烯腈等。将异丁烷脱氢制备异丁烯,可提高异丁烷的附加值,具有良好的经济与社会效益。回答下列问题。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
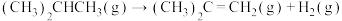 ∆H=
∆H=____________ kJ·mol-1。
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成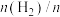 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。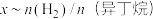 为曲线
为曲线_________ (填“M”或“N”),催化剂易被副反应产生的加聚产物__________ (填写结构简式)影响而失活。
(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是_____________ ,若生产过程中加入的空气过多,产生的主要问题是_____________ 。
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属_____________ (填元素符号)是酸性位点;而电负性较小的金属是碱性位点,吸附________________ (填“异丁烷”或“CO2”)。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
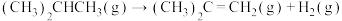 ∆H=
∆H=| 物质 | 异丁烷(g) | 异丁烯(g) | 氢气(g) |
| 燃烧热/(kJ·mol-1) | 2868 | 2700 | 286 |
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成
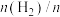 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
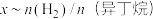 为曲线
为曲线(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】草酸亚铁晶体( FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。

(1)装置D的名称为___________ ,作用是_________________________________ 。
(2)按照气流从左到右的方向,上述装置的连接顺序为a→_____________ →d→e→b→c→尾气处理装置(填仪器接口的小字母编号)。
(3)能证明分解产物中存在CO的现象是_____________________ 。
II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:

(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为__________ 。
Ⅲ.文献表明:相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论进行以下实验。
)的还原性强于Fe2+。为检验这一结论进行以下实验。
资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3− Fe3++ 3C2O
Fe3++ 3C2O K=6.3×10−21
K=6.3×10−21
通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱
的还原性强弱
(5)取实验中的少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红。加硫酸后溶液变红的原因是__________________________________ 。
(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是_____________ 。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。

(1)装置D的名称为
(2)按照气流从左到右的方向,上述装置的连接顺序为a→
(3)能证明分解产物中存在CO的现象是
II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:

(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为
Ⅲ.文献表明:相同条件下,草酸根(C2O
 )的还原性强于Fe2+。为检验这一结论进行以下实验。
)的还原性强于Fe2+。为检验这一结论进行以下实验。资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3−
 Fe3++ 3C2O
Fe3++ 3C2O K=6.3×10−21
K=6.3×10−21通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱
的还原性强弱| 操作 | 现象 |
| 在避光处,向10mL0.5mol∙L-1FeCl3溶液中缓慢加入0.5mol∙L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到翠绿色溶液和翠绿色晶体 |
(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】反应 Fe(s)+CO2(g)⇌FeO(s)+CO(g) △H1,平衡常数为 K1,反应 Fe(s)+H2O(g)⇌FeO(s)+H2(g) △H2,平衡常数为 K2;在不同温度时 K1、K2 的值如表:
(1) 反应 CO2(g)+H2(g)⇌CO(g)+H2O(g)的反应热为△H ,平衡常数为 K,则△H=____________ (用△H1 和△H2 表 示), K= _______________ (用 K1 和 K2 表示),且由上述计算可知,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)是______________________________ 反应(填“吸热”或“放热”)。
(2) 现有反应:mA(g)+nB(g) ⇌ pC(g)达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为反应___________ (填“吸热”或“放热”,且 m+n___ p(填“>"“=或“<”)
②减压使容器容积增大时,A的质量分数____________ (填“增大”“减小”或“不变”,下同)。
③若容积不变加入B,则A的转化率_______________ , B的转化率 ______________
④ 若加入催化剂,平衡时气体混合物的总物质的量____________
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
(1) 反应 CO2(g)+H2(g)⇌CO(g)+H2O(g)的反应热为△H ,平衡常数为 K,则△H=
(2) 现有反应:mA(g)+nB(g) ⇌ pC(g)达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为反应
②减压使容器容积增大时,A的质量分数
③若容积不变加入B,则A的转化率
④ 若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲烷-CO2重整反应可以得到用途广泛的合成气,已知方程式为CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0。回答下列问题:
(1)相关物质的燃烧热数据如表所示:
①ΔH=_______ kJ·mol-1
②用Ni基双金属催化,反应的活化能降低,ΔH_______ (填“变大”、“变小”或者“不变”)
(2)控制其它条件不变,改变温度对合成气中甲烷质量分数的影响如图。

若充入amolCH4,经过2小时后达到如图A点,2小时内用CH4表示的平均反应速率为_______ mol/h(用a表示);假设A为平衡态,此时压强为2MPa,平衡常数Kp=_______ (用平衡分压代替平衡浓度,分压=总压x物质的量分数,保留2位小数)。
(3)甲烷的重整反应速率可以表示为η=k·p(CH4) [p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是_______ 。
a.增加甲烷的浓度,η增大 b.加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)一定温度下反应会出现积碳现象而降低催化剂活性。图是Ni基双金属催化剂抗积碳的示意图。

结合图示:
①写出一个可能的积碳反应方程式_______ 。
②金属钴能有效消碳的原因是_______ 。
(1)相关物质的燃烧热数据如表所示:
| 物质 | CH4(g) | CO(g) | H2(g) |
| 燃烧热(kJ/mol) | 890.3 | 283.0 | 285.8 |
②用Ni基双金属催化,反应的活化能降低,ΔH
(2)控制其它条件不变,改变温度对合成气中甲烷质量分数的影响如图。

若充入amolCH4,经过2小时后达到如图A点,2小时内用CH4表示的平均反应速率为
(3)甲烷的重整反应速率可以表示为η=k·p(CH4) [p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是
a.增加甲烷的浓度,η增大 b.加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)一定温度下反应会出现积碳现象而降低催化剂活性。图是Ni基双金属催化剂抗积碳的示意图。

结合图示:
①写出一个可能的积碳反应方程式
②金属钴能有效消碳的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。利用甲烷制备合成气的化学方程式CH4(g)+H2O(g) CO(g)+3H2(g) ΔH。
CO(g)+3H2(g) ΔH。
①ΔH=__ kJ/mol。
②一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有___ (填字母)。
A.v正(CH4)=v逆(H2O)
B.气体压强不再变化
C.单位时间每消耗1molCH4,同时产生3molH2
D.CH4与H2的物质的量之比为1∶3
(2)在某密闭容器中通入2molCH4和2molH2O(g),在不同条件下发生反应CH4(g)+H2O(g)⇌CO(g)+3H2(g),测得平衡时CH4的体积分数与温度、压强的关系如图所示。
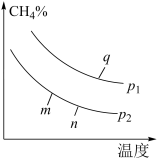
①p1___ p2(填“<”、“>”或“=”),该反应为___ (填吸或放)热反应。
②m、n、q三点的化学平衡常数大小关系为__ 。
③若q点对应的纵坐标为30,此时甲烷的转化率为___ ,该条件下的化学平衡常数Kp=___ (用含有P1的表达式表示,Kp为以分压表示的平衡常数)。
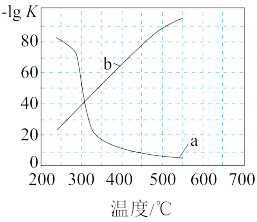
(3)实验测定该反应的化学平衡常数Kp随温度变化的曲线是如图中的___ (填a、b),理由是___ 。
(1)已知CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。利用甲烷制备合成气的化学方程式CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH。
CO(g)+3H2(g) ΔH。①ΔH=
②一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有
A.v正(CH4)=v逆(H2O)
B.气体压强不再变化
C.单位时间每消耗1molCH4,同时产生3molH2
D.CH4与H2的物质的量之比为1∶3
(2)在某密闭容器中通入2molCH4和2molH2O(g),在不同条件下发生反应CH4(g)+H2O(g)⇌CO(g)+3H2(g),测得平衡时CH4的体积分数与温度、压强的关系如图所示。

①p1
②m、n、q三点的化学平衡常数大小关系为
③若q点对应的纵坐标为30,此时甲烷的转化率为
(3)实验测定该反应的化学平衡常数Kp随温度变化的曲线是如图中的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】一定温度下,向一容积为2L的恒容密闭容器中充入0.4 molSO2和0.2mol O2发生反应: 2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ/mol。 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) △H=-196 kJ/mol。 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是_______ (填字母)。
a. SO2、O2、SO3三者的浓度之比为2:1:2
b.容器内气体的压强不再变化
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)有利于提高SO2的平衡转化率的措施有:_______ (填字母)
a.使用催化剂 b.降低温度 c.及时分离出SO3
(3)①SO2的平衡转化率为_______ 。
②此温度下该反应的平衡常数K=_______ 。
(4)如图所示平衡时SO3的体积分数随压强和温度变化的曲线,则:
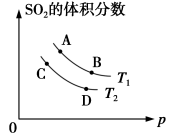
①温度关系:T1_______ T2(填“>”“<”或“=”,下同)
②平衡常数文关系:KA_______ KB,KA _______ KD。
 2SO3(g) △H=-196 kJ/mol。 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) △H=-196 kJ/mol。 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(1)判断该反应达到平衡状态的标志是
a. SO2、O2、SO3三者的浓度之比为2:1:2
b.容器内气体的压强不再变化
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)有利于提高SO2的平衡转化率的措施有:
a.使用催化剂 b.降低温度 c.及时分离出SO3
(3)①SO2的平衡转化率为
②此温度下该反应的平衡常数K=
(4)如图所示平衡时SO3的体积分数随压强和温度变化的曲线,则:

①温度关系:T1
②平衡常数文关系:KA
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某同学用如图所示做水果电池的实验,测得数据如下表所示:

请回答以下问题:
(1)实验6中负极的电极反应式为____ 。
(2)实验1、5中电流方向相反的原因是____ 。
(3)影响水果电池电压的因素有_____ 、____ 。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做____ 。(填“合理”或“不合理”)

| 试验编号 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑桔 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
请回答以下问题:
(1)实验6中负极的电极反应式为
(2)实验1、5中电流方向相反的原因是
(3)影响水果电池电压的因素有
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片做电极,但甲同学将电极放入6mol·L-1的硫酸溶液中,乙同学将电极放入6mol·L-1的NaOH溶液中,如图所示。
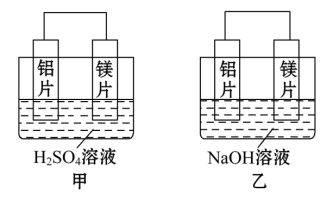
(1)写出甲中正极的电极反应式_______ 。
(2)乙中负极为_______ ,总反应的化学方程式_______ 。
(3)甲与乙同学均认为“如果构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出_______ 活动性更强,而乙会判断出_______ 活动性更强(填写元素符号)。
(4)由此实验得出的下列结论中,正确的有_______。

(1)写出甲中正极的电极反应式
(2)乙中负极为
(3)甲与乙同学均认为“如果构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(4)由此实验得出的下列结论中,正确的有_______。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:
试根据表中的实验现象完成下列问题:
(1)实验①、②中铝所作的电极(指正极或负极)________ (填“相同”或“不相同”)。
(2)实验③中铝为________ 极,电极反应式为________________ ;石墨为________ 极,电极反应式为_______________ ;电池总反应式为_____________________________ 。
(3)实验④中铝作负极还是正极?_____ ,理由是___________________________________ ,铝电极的电极反应式为_______________________________ 。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为_____________________ 。
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| ① | 镁、铝 | 稀盐酸 | 偏向铝 |
| ② | 铝、铜 | 稀盐酸 | 偏向铜 |
| ③ | 铝、石墨 | 稀盐酸 | 偏向石墨 |
| ④ | 镁、铝 | 氢氧化钠溶液 | 偏向镁 |
试根据表中的实验现象完成下列问题:
(1)实验①、②中铝所作的电极(指正极或负极)
(2)实验③中铝为
(3)实验④中铝作负极还是正极?
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为
您最近一年使用:0次



