A、B、C、D、E、F为原子序数依次增大的短周期主族元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。
(1)A、C形成的分子极易溶于水,除因为它们都是极性分子外,还因为_____________________ 。
(2)比较E、F的第一电离能:E____ F 。(选填“>”或“<”)
(3) BD2在高温高压下所形成的晶胞如图所示:
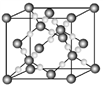
该晶体的类型属于____ 选填(分子晶体、原子晶体、离子晶体或金属晶体),该晶体中B原子的杂化形式____ 。
(4)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则 [F(OH)4]-中存在____ 。(填序号)
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
(1)A、C形成的分子极易溶于水,除因为它们都是极性分子外,还因为
(2)比较E、F的第一电离能:E
(3) BD2在高温高压下所形成的晶胞如图所示:

该晶体的类型属于
(4)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则 [F(OH)4]-中存在
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
更新时间:2017-07-05 16:04:52
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】回答下列问题
(1)Na原子核外共有______ 种不同运动状态的电子,有_____ 种不同能量的电子。
(2)相同压强下,部分元素氟化物的熔点见下表:
试解释上表中氟化物熔点差异的原因:_______ 。
(3)SiF4分子的空间构型为_______ 。
(4)热稳定性:NH3______PH3(填“>”“<”)。沸点:Br2>Cl2,试分析原因__________ 。
(5)试配平该反应的化学方程式,并用短线标出电子转移方向及总数__________ 。
NaIO3+ NaHSO3→ NaHSO4+ Na2SO4+ I2+ H2O
(1)Na原子核外共有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
(3)SiF4分子的空间构型为
(4)热稳定性:NH3______PH3(填“>”“<”)。沸点:Br2>Cl2,试分析原因
(5)试配平该反应的化学方程式,并用短线标出电子转移方向及总数
NaIO3+ NaHSO3→ NaHSO4+ Na2SO4+ I2+ H2O
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】揭示原子内部结构的奥秘,有助于我们理解所处的物质世界。下表是元素周期表中的一部分,回答有关问题。
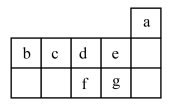
(1)上表中元素f的氢化物的电子式是_______ ,此氢化物的热稳定性比元素g的氢化物热稳定性_______ (填“强”或“弱”)。
(2)某元素形成的气态氢化物中氢的含量是所有氢化物中最高的,该元素形成的化合物种类也最多,该元素是_______ (填编号)。该元素有多种同位素,在理论上和科学上均有重要的应用,写出其中一种用途:_______ 。
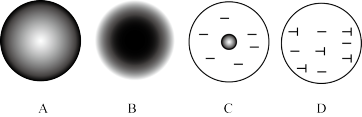
(3)α粒子是_______ (填编号)原子所形成的一种粒子,1911年,卢瑟福等人做了用α粒子轰击金箔的实验,从而提出原子结构的行星模型,下列选项中能正确表示这种模型的是_______ (填字母)。

(1)上表中元素f的氢化物的电子式是
(2)某元素形成的气态氢化物中氢的含量是所有氢化物中最高的,该元素形成的化合物种类也最多,该元素是
(3)α粒子是

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】制备 的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:
的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:
(1)“沉淀溶解”时发生反应的离子方程式为_______
(2)基态 价层电子排布式为
价层电子排布式为_______ 。
(3)N、O、S三种元素的第一电离能由大到小的顺序为_______ 。
(4)沸点: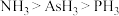 ,原因为
,原因为_______ 。
(5)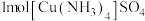 含有σ键的数目为
含有σ键的数目为_______ 。
(6)写出一种与 互为等电子体的分子的化学式
互为等电子体的分子的化学式_______ 。
(7)S与 形成的某化合物晶体的晶胞(实心点表示
形成的某化合物晶体的晶胞(实心点表示 ,空心点表示S)如图所示:
,空心点表示S)如图所示:
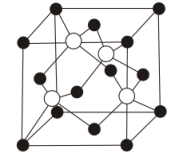
①该化合物的化学式为_______ 。
②已知该晶胞的晶胞参数为 ,阿伏加德罗常数为NA,则该晶胞的密度为
,阿伏加德罗常数为NA,则该晶胞的密度为_____  。
。
 的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:
的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:(1)“沉淀溶解”时发生反应的离子方程式为
(2)基态
 价层电子排布式为
价层电子排布式为(3)N、O、S三种元素的第一电离能由大到小的顺序为
(4)沸点:
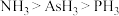 ,原因为
,原因为(5)
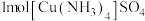 含有σ键的数目为
含有σ键的数目为(6)写出一种与
 互为等电子体的分子的化学式
互为等电子体的分子的化学式(7)S与
 形成的某化合物晶体的晶胞(实心点表示
形成的某化合物晶体的晶胞(实心点表示 ,空心点表示S)如图所示:
,空心点表示S)如图所示:
①该化合物的化学式为
②已知该晶胞的晶胞参数为
 ,阿伏加德罗常数为NA,则该晶胞的密度为
,阿伏加德罗常数为NA,则该晶胞的密度为 。
。
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知:Y为地壳中含量最多的元素,M原子的最外层电子数与次外层电数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
(1)M在元素周期表中的位置__ ;Z+离子的结构示意图为__ 。
(2)写出X、Y、R按原子个数之比1:1:1形成的化合物的电子式__ 。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__ 。
(4)实验室制备R的单质,该反应的离子方程式为__ 。
(5)R非金属性强于M,下列选项中能证明这一事实的是__ (填字母序号)。
A.常温下的R单质熔沸点比M单质的高
B.R的氢化物比M的氢化物更稳定
C.一定条件下R和M的单质都能与NaOH溶液反应
D.最高价氧化物对应水化物的酸性强弱:R>M
(6)由X、Y、Z、M四种元素组成的一种弱酸酸式盐A。向A溶液中通入氯气,得到无色溶液,写出该反应的离子方程式__ 。
(1)M在元素周期表中的位置
(2)写出X、Y、R按原子个数之比1:1:1形成的化合物的电子式
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式
(4)实验室制备R的单质,该反应的离子方程式为
(5)R非金属性强于M,下列选项中能证明这一事实的是
A.常温下的R单质熔沸点比M单质的高
B.R的氢化物比M的氢化物更稳定
C.一定条件下R和M的单质都能与NaOH溶液反应
D.最高价氧化物对应水化物的酸性强弱:R>M
(6)由X、Y、Z、M四种元素组成的一种弱酸酸式盐A。向A溶液中通入氯气,得到无色溶液,写出该反应的离子方程式
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐2】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
请回答:
(1)画出d元素的原子结构示意图___________ 。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有___________ 种。
(4)a与其相邻同主族元素的最高价氧化物的熔点相差较大的原因是___________ 。
(5)若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,与A互为等电子体的一种分子为___________ (填化学式)。
(6)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为___________ ,若该晶体的相对分子质量为M,密度为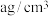 ,则晶胞的体积为
,则晶胞的体积为___________ ( 用表示阿伏伽德罗常数的值)。
用表示阿伏伽德罗常数的值)。
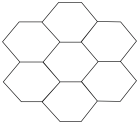
(7)a形成的某种单质的层状结构如图,其中a原子数、a-a键数之比为___________ 。
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第8纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(1)画出d元素的原子结构示意图
(2)b与其同周期相邻元素第一电离能由大到小的顺序为
(3)c的氢化物水溶液中存在的氢键有
(4)a与其相邻同主族元素的最高价氧化物的熔点相差较大的原因是
(5)若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,与A互为等电子体的一种分子为
(6)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为
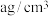 ,则晶胞的体积为
,则晶胞的体积为 用表示阿伏伽德罗常数的值)。
用表示阿伏伽德罗常数的值)。(7)a形成的某种单质的层状结构如图,其中a原子数、a-a键数之比为

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐3】下图是元素周期表的一部分,针对表中①~⑦元素,填写下列空白:
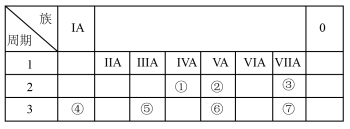
(1)②表示的元素是____ (填元素符号)。
(2)被选作相对原子质量标准的核素是_______ (填字母序号)。
a. b.
b. c.
c.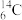 d.
d.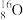
(3)②和⑥两种元素的原子半径大小为:②_____ ⑥(填“<”或“>”)。
(4)④和⑤两种元素的金属性强弱顺序为:④____ ⑤(填“<”或“>”)。
(5)元素④与⑦形成的化合物属于_______ (填“共价”或“离子”)化合物。
(6)最高价氧化物的水化物中,酸性最强的化合物的是______ (填字母序号,下同),碱性最强的化合物的是_________ 。
a.NaOH b.HNO3 c.HClO4 d.Al(OH)3
(7)在①~⑦元素中,最高价氧化物是两性氧化物的元素在第_____ 族,写出它的氧化物与氢氧化钠溶液反应的离子方程式_____________________ 。

(1)②表示的元素是
(2)被选作相对原子质量标准的核素是
a.
 b.
b. c.
c.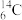 d.
d.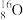
(3)②和⑥两种元素的原子半径大小为:②
(4)④和⑤两种元素的金属性强弱顺序为:④
(5)元素④与⑦形成的化合物属于
(6)最高价氧化物的水化物中,酸性最强的化合物的是
a.NaOH b.HNO3 c.HClO4 d.Al(OH)3
(7)在①~⑦元素中,最高价氧化物是两性氧化物的元素在第
您最近一年使用:0次
【推荐1】下表是元素周期表的一部分,表中的字母分别代表一种化学元素。

(1)上述元素中,原子中未成对电子数最多的是___________ (填字母),写出该元素基态原子的核外电子排布式: ___________ 。
(2)根据下表所提供的电离能数据,回答下列问题。
①表中X可能为以上13种元素中的 _____________ (填字母)元素。用元素符号表示X和j形成的一种化合物的化学式: _____________ 。
②Y是周期表中第_____________ 族元素。

(1)上述元素中,原子中未成对电子数最多的是
(2)根据下表所提供的电离能数据,回答下列问题。
| 锂 | X | Y | |
| I1 | 520 | 496 | 580 |
| I2 | 7296 | 4562 | 1820 |
| I3 | 11799 | 6912 | 2750 |
| I4 | 9543 | 11600 |
②Y是周期表中第
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐2】W、X、Y、Z、M是原子序数依次增大的5种短周期元素,其元素性质或原子结构如下:
请完成下列空白:
(1)W的元素符号为________ 。
(2)写出Y的价层电子排布式:_________ 。
(3)下列状态的X中,电离最外层一个电子所需能量最小的是______ (填序号)。
a.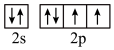 b.
b.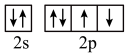 c.
c.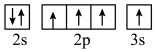
(4)基态M-占据的最高能级的电子云轮廓图的形状是_______ 。
(5)X、Z和M三种元素的电负性由大到小的顺序:_____ (请填元素符号)。
(6)X与同周期相邻的其它两种元素,它们的第一电离能由大到小的顺序:______ (请填元素符号)。
| 元素 | 元素性质或原子结构 |
| W | 电子只有一种自旋取向 |
| X | 原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Z | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
| M | 只有一个未成对电子 |
(1)W的元素符号为
(2)写出Y的价层电子排布式:
(3)下列状态的X中,电离最外层一个电子所需能量最小的是
a.
 b.
b. c.
c.
(4)基态M-占据的最高能级的电子云轮廓图的形状是
(5)X、Z和M三种元素的电负性由大到小的顺序:
(6)X与同周期相邻的其它两种元素,它们的第一电离能由大到小的顺序:
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】W、X、Y、Z、M是原子序数依次增大的5种短周期元素,其元素性质或原子结构如下:
请完成下列空白:
(1)W的元素符号为________ 。
(2)写出Y的价层电子排布式:_________ 。
(3)下列状态的X中,电离最外层一个电子所需能量最小的是______ (填序号)。
a. b.
b. c.
c.
(4)基态M-占据的最高能级的电子云轮廓图的形状是_______ 。
(5)X、Z和M三种元素的电负性由大到小的顺序:_____ (请填元素符号)。
(6)X与同周期相邻的其它两种元素,它们的第一电离能由大到小的顺序:______ (请填元素符号)。
| 元素 | 元素性质或原子结构 |
| W | 电子只有一种自旋取向 |
| X | 原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Z | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
| M | 只有一个未成对电子 |
(1)W的元素符号为
(2)写出Y的价层电子排布式:
(3)下列状态的X中,电离最外层一个电子所需能量最小的是
a.
 b.
b. c.
c.
(4)基态M-占据的最高能级的电子云轮廓图的形状是
(5)X、Z和M三种元素的电负性由大到小的顺序:
(6)X与同周期相邻的其它两种元素,它们的第一电离能由大到小的顺序:
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)写出M原子的外围电子排布式_____ 。
(2)画出Y的负一价离子的电子式_____ ,元素Y的含氧酸中,酸性最强的是_____ (写化学式)。
(3)Y的同周期元素中,第一电离能最大的是______ (写元素符号);同周期主族元素从左到右,原子半径逐渐______ ,原因是______ 。
(4)M与Y形成的一种化合物MY,该化合物难溶于水但易溶于氨水,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______ 。
(1)写出M原子的外围电子排布式
(2)画出Y的负一价离子的电子式
(3)Y的同周期元素中,第一电离能最大的是
(4)M与Y形成的一种化合物MY,该化合物难溶于水但易溶于氨水,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐3】A、B、C、D、E、F、G、W是原子序数依次增大的8种元素,A元素原子的2p原子轨道上有2个未成对的电子,B元素在同周期中原子半径最大,与A可形成原子个数比为1:1和2:1的两种化合物,C单质是一种常见的半导体材料,F有9个原子轨道,且只有一个未成对电子,没有空轨道,G的单质是一种常见金属,其+2价离子G2+有4个未成对电子,W能形成红色(或砖红色)的W2A和黑色的WA两种化合物。
(1)C元素在元素周期表中的位置___________ ,W位于元素周期表___________ 区,W的简化电子排布式___________ 。
(2)EF2中心原子杂化轨道类型___________ ,EA 的VSEPR模型
的VSEPR模型___________ ,EA 的空间构型
的空间构型___________ 。
(3)D、E、F三元素第一电离能从大到小的顺序是___________ (用元素符号及“ ”表示)。
”表示)。
(4)A、B、C、D四元素电负性由大到小顺序___________ (用元素符号及“ ”表示)。
”表示)。
(5)G3+比G2+稳定,原因是___________ 。
(1)C元素在元素周期表中的位置
(2)EF2中心原子杂化轨道类型
 的VSEPR模型
的VSEPR模型 的空间构型
的空间构型(3)D、E、F三元素第一电离能从大到小的顺序是
 ”表示)。
”表示)。(4)A、B、C、D四元素电负性由大到小顺序
 ”表示)。
”表示)。(5)G3+比G2+稳定,原因是
您最近一年使用:0次

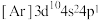 ,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:

