常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,

下列关系正确的是

下列关系正确的是
| A.a点: c(H+)>c(Cl-)>c(ClO-) |
B.b点: c(Cl-)=c( )=0.005 mol·L-1 )=0.005 mol·L-1 |
C.c点: c(Na+)=2c( )+2c( )+2c( )+2c( )+2c( ) ) |
D.d点: c(Na+)+ c(H+)=c(Cl-)+2c( )+c( )+c( )+2c( )+2c( ) ) |
更新时间:2017-07-04 10:23:55
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】常温下,将 溶液与
溶液与 溶液混合,可制得
溶液混合,可制得 ,混合过程中有气体产生。已知:
,混合过程中有气体产生。已知: ;
; ;
; ;
; 下列说法
下列说法不正确 的是
 溶液与
溶液与 溶液混合,可制得
溶液混合,可制得 ,混合过程中有气体产生。已知:
,混合过程中有气体产生。已知: ;
; ;
; ;
; 下列说法
下列说法A.向 的氨水中通入少量 的氨水中通入少量 ,反应后溶液中存在: ,反应后溶液中存在: |
B. 溶液中: 溶液中: |
C.生成 的离子方程式为: 的离子方程式为: |
D.生成 沉淀后的上层清液中: 沉淀后的上层清液中: |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】部分弱电解质的电离平衡常数如下:
下列说法错误的是
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=1.8×10-5 |
| A.结合H+的能力:CO32->CN->HCO3->HCOO- |
| B.0.1mol/L的HCOONH4溶液中存在以下关系式:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) |
| C.pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水) |
| D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者等于后者 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
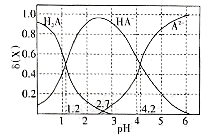
【推荐1】改变0.1mol/L的二元弱酸H2A溶液的pH。 溶液中的H2A。HA-、A2-的δ(X)随pH的变化如图所示。已知δ(X)= 。下列叙述正确的是
。下列叙述正确的是
 。下列叙述正确的是
。下列叙述正确的是
| A.K1(H2A)的数量级是10-1 |
| B.pH=4.2时,c(HA-)=c(A2-)>c(H+)>c(OH-) |
| C.0.1mol/L的NaHA溶液pH<2.7 |
| D.在pH由1~4.2的过程中。水的电离程度变小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,向 的
的 溶液中缓缓加入
溶液中缓缓加入 粉末(溶液的体积不变),
粉末(溶液的体积不变), 、
、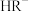 、
、 在含
在含 粒子总物质的量浓度中所占分数
粒子总物质的量浓度中所占分数 随溶液
随溶液 的变化关系如图所示。下列有关说法正确的是
的变化关系如图所示。下列有关说法正确的是
 的
的 溶液中缓缓加入
溶液中缓缓加入 粉末(溶液的体积不变),
粉末(溶液的体积不变), 、
、 、
、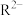 在含
在含 粒子总物质的量浓度中所占分数
粒子总物质的量浓度中所占分数 随溶液
随溶液 的变化关系如图所示。下列有关说法正确的是
的变化关系如图所示。下列有关说法正确的是
A. 对应微粒为 对应微粒为 |
B. 时: 时: |
C.25℃时, |
D. 的 的 溶液: 溶液: |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温下,在烧杯中将0.025 mol  粉末加水配成1 L悬浊液,然后向烧杯中加入
粉末加水配成1 L悬浊液,然后向烧杯中加入 固体并充分搅拌(忽略溶液体积的变化)。加入
固体并充分搅拌(忽略溶液体积的变化)。加入 固体的过程中溶液中几种离子的浓度变化曲线如图。下列说法正确的是
固体的过程中溶液中几种离子的浓度变化曲线如图。下列说法正确的是
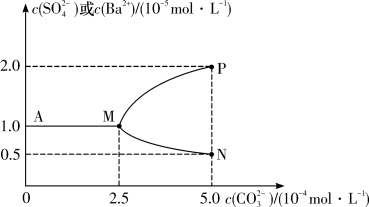
 粉末加水配成1 L悬浊液,然后向烧杯中加入
粉末加水配成1 L悬浊液,然后向烧杯中加入 固体并充分搅拌(忽略溶液体积的变化)。加入
固体并充分搅拌(忽略溶液体积的变化)。加入 固体的过程中溶液中几种离子的浓度变化曲线如图。下列说法正确的是
固体的过程中溶液中几种离子的浓度变化曲线如图。下列说法正确的是
A.常温下,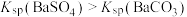 |
B. 在水中的溶解度、 在水中的溶解度、 均比在 均比在 溶液中的大 溶液中的大 |
C.MP曲线表示的是溶液中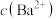 的变化 的变化 |
D. 恰好全部转化为 恰好全部转化为 时,离子浓度大小关系为 时,离子浓度大小关系为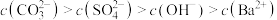 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温时,配制一组c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1的混合溶液,溶液中c(CO32-)、c(HCO3-)与pH的关系如图所示。下列说法中错误的是(已知:CO32-+H2O HCO3-+OH- K=2×10-4,1g5=0.7)
HCO3-+OH- K=2×10-4,1g5=0.7)

 HCO3-+OH- K=2×10-4,1g5=0.7)
HCO3-+OH- K=2×10-4,1g5=0.7)
| A.a点的溶液中:c(HCO3-)> c(H2CO3)+c(CO32-) |
| B.b点横坐标数值大约为10.3 |
| C.c点的溶液中:c(Na+)<2c(CO32-)+c(HCO3-) |
| D.溶液中水的电离程度:a<b<c |
您最近一年使用:0次

 溶液(不考虑空气的影响)中缓慢通入0.05 mol
溶液(不考虑空气的影响)中缓慢通入0.05 mol ,充分混合,完全,整个过程中无气体逸出,忽略溶液中体积和温度的变化,测得溶液的pH与通入
,充分混合,完全,整个过程中无气体逸出,忽略溶液中体积和温度的变化,测得溶液的pH与通入 ,
, 。下列说法错误的是
。下列说法错误的是
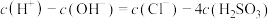
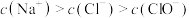
 时,
时, 的
的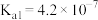 ,
, ,室温下向10mL
,室温下向10mL 溶液中逐滴加入
溶液中逐滴加入 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象 因有逸出未画出
因有逸出未画出 。下列说法错误的是
。下列说法错误的是

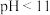
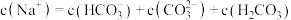
 点发生反应的离子方程式为
点发生反应的离子方程式为
 )+c(OH-)
)+c(OH-) 、
、
 、
、 、
、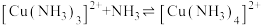 ,平衡常数依次为
,平衡常数依次为 已知
已知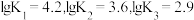 ,体系中含Cu物种的组分分布系数δ与
,体系中含Cu物种的组分分布系数δ与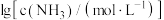 的关系如图所示,N点的横坐标为-2.2,δ(x)=
的关系如图所示,N点的横坐标为-2.2,δ(x)=  。下列说法错误的是
。下列说法错误的是
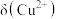 的变化曲线
的变化曲线
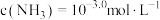 时,
时,


