已知某反应的平衡常数表达式为:K=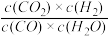 其平衡常数随温度变化如下表所示:请回答下列问题:
其平衡常数随温度变化如下表所示:请回答下列问题:
(1)该反应的ΔH______ 0(填“>”或“<”)。
(2)若在500 ℃时进行上述反应,某时刻测得四种物质的体积分数彼此相等,则此时反应_____ 向进行中(“正”或“逆”);
(3)850 ℃时在一个固定体(反应器中,投入2 molCO和3 molH2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则
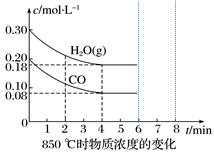
①4 min时H2的物质的量分数=___________ ;②K1=_____________ ;
③若4分钟时测得反应的热效应数值为a kJ,则该反应的热化学方程式为:_________ ;
④若第6分钟将容器压缩为5L,画出6~8分钟CO的浓度变化图象(注明起点坐标)______________ ;
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度随时间变化如下表。
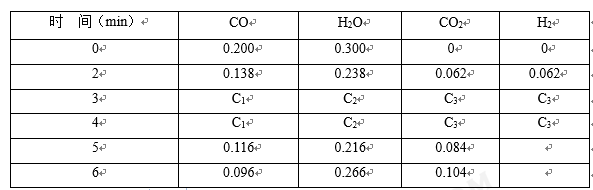
①3~4min时,v正________ v逆(填“>”或“=”或“<”),C1 ____ 0.08 mol/L(填“>”或“=”或“<”);
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是_________ (单选),反应在5 min~6 min,平衡向正方向移动,可能的原因是___________ (单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
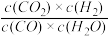 其平衡常数随温度变化如下表所示:请回答下列问题:
其平衡常数随温度变化如下表所示:请回答下列问题:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | K1 |
(1)该反应的ΔH
(2)若在500 ℃时进行上述反应,某时刻测得四种物质的体积分数彼此相等,则此时反应
(3)850 ℃时在一个固定体(反应器中,投入2 molCO和3 molH2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则

①4 min时H2的物质的量分数=
③若4分钟时测得反应的热效应数值为a kJ,则该反应的热化学方程式为:
④若第6分钟将容器压缩为5L,画出6~8分钟CO的浓度变化图象(注明起点坐标)
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度随时间变化如下表。

①3~4min时,v正
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
更新时间:2017-11-09 13:52:28
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】V2-、W3-、X2+、Y2-、Z-是由短周期元素形成的简单离子,其中V2-、W3-、X2+均是10电子的微粒,Y2-、Z-与Ar原子具有相同的电子数。(请用化学用语回答下列问题)
(1)V2-的结构示意图为___________ 。
(2)V、W、X的原子半径由小到大的顺序是______________________ 。
(3)无水W2H4为无色液体,在298k时与V2气体迅速反应生成W2气体和液态的V的最简单氢化物,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为_________________________________ 。
(4)YZ2是一种重要的化工产品,熔点:-78℃,沸点:59.6℃,加热至40℃以上,部分开始分解,YZ2晶体属于___________ 晶体。
(5)①Na2YO3溶液中离子浓度从大到小的顺序是_________________________ 。
②已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,请通过计算确定NaHYO3水溶液的酸碱性(请写出计算过程)_________________________________ 。
(1)V2-的结构示意图为
(2)V、W、X的原子半径由小到大的顺序是
(3)无水W2H4为无色液体,在298k时与V2气体迅速反应生成W2气体和液态的V的最简单氢化物,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为
(4)YZ2是一种重要的化工产品,熔点:-78℃,沸点:59.6℃,加热至40℃以上,部分开始分解,YZ2晶体属于
(5)①Na2YO3溶液中离子浓度从大到小的顺序是
②已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,请通过计算确定NaHYO3水溶液的酸碱性(请写出计算过程)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮及其化合物在工农业生产、生活中有着重要的作用,请回答。
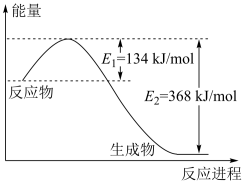
(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式___________ 。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)⇌ 2NH3(g) ΔH<0,其化学平衡常数K与温度的关系如表:
完成下列问题:
①比较K1、K2的大小:K1___________ K2(填“>”、“=”或“<”);
②判断该反应达到化学平衡状态的依据是___________ (填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)25℃时,水的电离达到平衡:H2O⇌H++OH- ∆H>0,下列叙述正确的是___________
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式___________ 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是___________ (填序号)。
A.c(Cl-)>c(N2H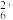 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O]+)>c(H+)>c(OH-)
C.2c(N2H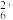 )+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
)+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
D.c(N2H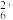 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式

(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)⇌ 2NH3(g) ΔH<0,其化学平衡常数K与温度的关系如表:
| 温度(℃) | 25 | 125 | 225 | … |
| 平衡常数 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1
②判断该反应达到化学平衡状态的依据是
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)25℃时,水的电离达到平衡:H2O⇌H++OH- ∆H>0,下列叙述正确的是___________
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
①写出盐酸肼第一步水解反应的离子方程式
②盐酸肼水溶液中离子浓度的排列顺序正确的是
A.c(Cl-)>c(N2H
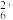 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)B.c(Cl-)>c([N2H5•H2O]+)>c(H+)>c(OH-)
C.2c(N2H
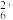 )+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
)+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)D.c(N2H
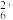 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
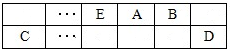
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为____________ 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a____ b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是:_______________ 填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:________________ 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是________ 。
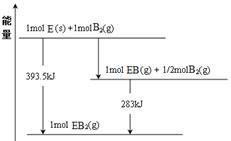
(6)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________ 。

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为_________________ 。

(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是:
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是
(6)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式


(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】I、丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
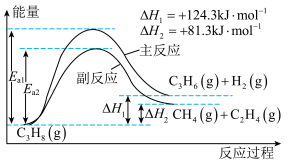
(1)由上图可知,主反应在___________________ (选“高温”或“低温”)时更加容易自发进行
(2)丙烷脱氢制丙烯的过程中。恒压时向原料气中掺入高温水蒸气,则 K(主反应)___________________ (填“增大”、“减小”或“不变”,下同),转化率 α (C3H8)___________________ 。温度升高,副反应更容易发生的主要原因是___________________ 。
(3)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为 104 Pa 和 105 Pa)。
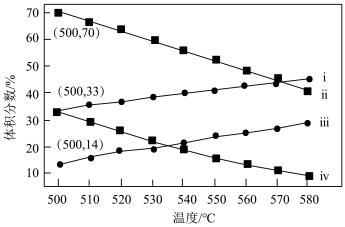
105 Pa 时,图中表示丙烯的曲线是___________________ (填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
II、一定温度下,在 3.0L 密闭容器中,通入 0.10mol CH4和 0.20molNO2进行反应,CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
(4)已知 4min 时容器中甲烷为 0.04mol,计算 0~4min 内 υ (NO2)=_________ ,该温度下的压强平衡常数 Kp=______ kPa。

(5)在一恒容密闭容器中,通入一定量 CH4和 NO2,测得在相同时间内,不同温度下,NO2 的转化率随温度的变化如图。c 点___________________ (填“是”或“不是”)反应达平衡的点。

(1)由上图可知,主反应在
(2)丙烷脱氢制丙烯的过程中。恒压时向原料气中掺入高温水蒸气,则 K(主反应)
(3)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为 104 Pa 和 105 Pa)。

105 Pa 时,图中表示丙烯的曲线是
II、一定温度下,在 3.0L 密闭容器中,通入 0.10mol CH4和 0.20molNO2进行反应,CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:| 时间(t/min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强(p/kPa) | 480 | 544 | 576 | 592 | 600 | 600 |
(4)已知 4min 时容器中甲烷为 0.04mol,计算 0~4min 内 υ (NO2)=

(5)在一恒容密闭容器中,通入一定量 CH4和 NO2,测得在相同时间内,不同温度下,NO2 的转化率随温度的变化如图。c 点
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】异丙醇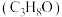 是重要的化工原料,丙烯直接水合法是工业制备异丙醇的常用方法,回答下列问题:
是重要的化工原料,丙烯直接水合法是工业制备异丙醇的常用方法,回答下列问题:
(1)丙烯直接水合法制异丙醇的反应可表示为
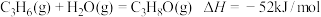
已知: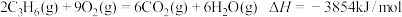
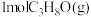 完全燃烧生成
完全燃烧生成 和
和 放出热量
放出热量_______ kJ。
(2)以上制备异丙醇反应的起始物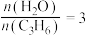 时,在不同条件下达到平衡,设体系中丙烯的转化率为
时,在不同条件下达到平衡,设体系中丙烯的转化率为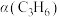 ,在
,在 ℃下的
℃下的 ,在
,在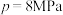 下的
下的 如图1所示:
如图1所示:_______ 。 点的反应条件为
点的反应条件为_______ ,该点的压强平衡常数
_______  。保持反应条件不变,下列可进一步提高
。保持反应条件不变,下列可进一步提高 平衡转化率的措施是(填字母)
平衡转化率的措施是(填字母)_______ 。
a.增大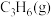 与
与 的进料比 b.充入惰性气体Ar
的进料比 b.充入惰性气体Ar
c.及时分离产品 d.换用更高效的催化剂
d.换用更高效的催化剂
(3)单程转化率反映了原料在第一次通过反应器时被转化的程度。将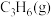 和
和 的混合气体以一定流速通过填充有催化剂的反应器,研究不同温度对
的混合气体以一定流速通过填充有催化剂的反应器,研究不同温度对 单程转化率和
单程转化率和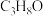 选择性的影响,结果如图2所示。由图可知,
选择性的影响,结果如图2所示。由图可知,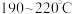 时
时 单程转化率很低,可能的原因是
单程转化率很低,可能的原因是_______ ,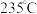 以后,随温度升高
以后,随温度升高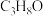 的选择性下降,可能的原因是
的选择性下降,可能的原因是_______ 。 转化为
转化为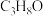 ,负极
,负极 迁移到正极,则正极上
迁移到正极,则正极上 发生的电极反应式为
发生的电极反应式为_______ 。
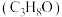 是重要的化工原料,丙烯直接水合法是工业制备异丙醇的常用方法,回答下列问题:
是重要的化工原料,丙烯直接水合法是工业制备异丙醇的常用方法,回答下列问题:(1)丙烯直接水合法制异丙醇的反应可表示为
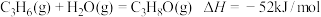
已知:
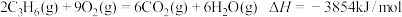
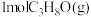 完全燃烧生成
完全燃烧生成 和
和 放出热量
放出热量(2)以上制备异丙醇反应的起始物
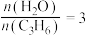 时,在不同条件下达到平衡,设体系中丙烯的转化率为
时,在不同条件下达到平衡,设体系中丙烯的转化率为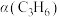 ,在
,在 ℃下的
℃下的 ,在
,在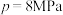 下的
下的 如图1所示:
如图1所示: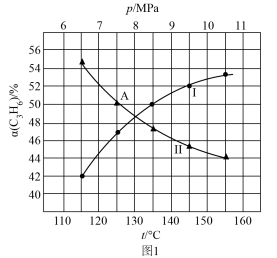
 点的反应条件为
点的反应条件为
 。保持反应条件不变,下列可进一步提高
。保持反应条件不变,下列可进一步提高 平衡转化率的措施是(填字母)
平衡转化率的措施是(填字母)a.增大
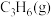 与
与 的进料比 b.充入惰性气体Ar
的进料比 b.充入惰性气体Arc.及时分离产品
 d.换用更高效的催化剂
d.换用更高效的催化剂(3)单程转化率反映了原料在第一次通过反应器时被转化的程度。将
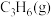 和
和 的混合气体以一定流速通过填充有催化剂的反应器,研究不同温度对
的混合气体以一定流速通过填充有催化剂的反应器,研究不同温度对 单程转化率和
单程转化率和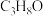 选择性的影响,结果如图2所示。由图可知,
选择性的影响,结果如图2所示。由图可知,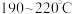 时
时 单程转化率很低,可能的原因是
单程转化率很低,可能的原因是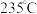 以后,随温度升高
以后,随温度升高 的选择性下降,可能的原因是
的选择性下降,可能的原因是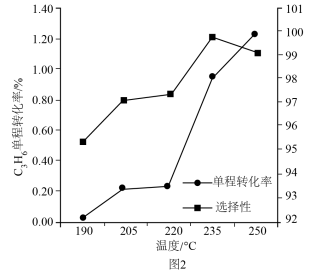
 转化为
转化为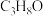 ,负极
,负极 迁移到正极,则正极上
迁移到正极,则正极上 发生的电极反应式为
发生的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生4NH3(g)+6NO(g) 5N2(g)+6H2O(l)+Q,NO的转化率随温度变化的情况如图1所示:
5N2(g)+6H2O(l)+Q,NO的转化率随温度变化的情况如图1所示:
(1)平衡常数表达式为K=______ ;在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=______ 。
(2)已知,298K时,相关物质的相对能量如图2所示,反应的Q=______ 。

(3)在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是______ 。
(4)用NaClO氧化也可除去氨氮(溶液中以NH3或 形式存在),已知:NH3+NaClO→N2+H2O+NaCl(未配平),NH3与NaClO反应时,氧化剂与还原剂物质的量之比为
形式存在),已知:NH3+NaClO→N2+H2O+NaCl(未配平),NH3与NaClO反应时,氧化剂与还原剂物质的量之比为______ 。
(5)请简述氨氮溶液中含有 的检验方法:
的检验方法:______ 。
 5N2(g)+6H2O(l)+Q,NO的转化率随温度变化的情况如图1所示:
5N2(g)+6H2O(l)+Q,NO的转化率随温度变化的情况如图1所示:
(1)平衡常数表达式为K=
(2)已知,298K时,相关物质的相对能量如图2所示,反应的Q=

(3)在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是
(4)用NaClO氧化也可除去氨氮(溶液中以NH3或
 形式存在),已知:NH3+NaClO→N2+H2O+NaCl(未配平),NH3与NaClO反应时,氧化剂与还原剂物质的量之比为
形式存在),已知:NH3+NaClO→N2+H2O+NaCl(未配平),NH3与NaClO反应时,氧化剂与还原剂物质的量之比为(5)请简述氨氮溶液中含有
 的检验方法:
的检验方法:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】乙炔(CH≡CH)是重要的化工原料,广泛应用于焊割、燃料电池及有机合成等。
(1)乙炔-空气燃料电池是一种碱性(20%-30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为_____________ ;
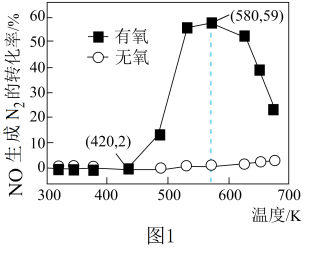
(2)科学家利用“组合转化技术”,将乙炔燃烧产物CO2转化成乙烯,反应式为:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是
CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是_____ (填序号)
①250℃时,催化剂的催化效率最大
②随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)甲烷裂解法制取乙炔的反应方程式为:2CH4(g) C2H2(g)+3H2(g)。已知:
C2H2(g)+3H2(g)。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ·mol-1
C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l) △H2= b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3= c kJ·mol-1
则2CH4(g) C2H2(g)+3H2(g) △H=
C2H2(g)+3H2(g) △H=______ kJ·mol-1
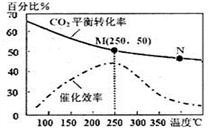
(4)哈斯特研究发现:甲烷裂解时,几种气体平衡时分压(Pa)与温度(℃)之间的关系如图所示。甲烷裂解可能发生的反应有:2CH4(g) C2H2(g)+3H2(g),2CH4(g)
C2H2(g)+3H2(g),2CH4(g) C2H4(g)+2H2(g)。
C2H4(g)+2H2(g)。
①1725℃时,向1L恒容密闭容器中充入0.3molCH4,达到平衡时,测得c(C2H2)=c(CH4)。则CH4生成C2H2的平衡转化率为_______ ;
②1725℃时,反应2CH4(g) C2H2(g)+3H2(g)的平衡常数Kp=
C2H2(g)+3H2(g)的平衡常数Kp=_________ (用平衡分压代替平衡浓度);
③由图可知,甲烷裂解制乙炔有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有_______ 。
(1)乙炔-空气燃料电池是一种碱性(20%-30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为
(2)科学家利用“组合转化技术”,将乙炔燃烧产物CO2转化成乙烯,反应式为:6H2(g)+2CO2(g)
 CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是
CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是
①250℃时,催化剂的催化效率最大
②随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)甲烷裂解法制取乙炔的反应方程式为:2CH4(g)
 C2H2(g)+3H2(g)。已知:
C2H2(g)+3H2(g)。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ·mol-1
C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l) △H2= b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3= c kJ·mol-1
则2CH4(g)
 C2H2(g)+3H2(g) △H=
C2H2(g)+3H2(g) △H=(4)哈斯特研究发现:甲烷裂解时,几种气体平衡时分压(Pa)与温度(℃)之间的关系如图所示。甲烷裂解可能发生的反应有:2CH4(g)
 C2H2(g)+3H2(g),2CH4(g)
C2H2(g)+3H2(g),2CH4(g) C2H4(g)+2H2(g)。
C2H4(g)+2H2(g)。
①1725℃时,向1L恒容密闭容器中充入0.3molCH4,达到平衡时,测得c(C2H2)=c(CH4)。则CH4生成C2H2的平衡转化率为
②1725℃时,反应2CH4(g)
 C2H2(g)+3H2(g)的平衡常数Kp=
C2H2(g)+3H2(g)的平衡常数Kp=③由图可知,甲烷裂解制乙炔有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝.电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用.
请回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJ•mol﹣1
2C(s)+O2(g)═2CO(g)△H2=﹣221KJ•mol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJ•mol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是___________________________ 。
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比).
反应ⅠCO2(g)+4H2(g) CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g) CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
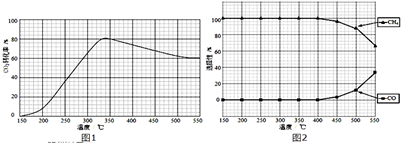
①下列说法不正确的是_______
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为______ (用a、V表示)
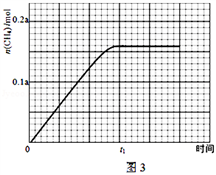
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线_______ .
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_______ .
请回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJ•mol﹣1
2C(s)+O2(g)═2CO(g)△H2=﹣221KJ•mol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJ•mol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比).
反应ⅠCO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4反应ⅡCO2(g)+H2(g)
 CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
①下列说法不正确的是
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线

(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】在一定温度下,向一容积为 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 ,发生反应:
,发生反应: 。经
。经 后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是__________ (填字母);
a. 、
、 、
、 三者的浓度之比为
三者的浓度之比为
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d. 的物质的量不再变化
的物质的量不再变化
e. 的生成速率和
的生成速率和 的生成速率相等
的生成速率相等
(2)从反应开始到平衡的这段时间用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率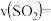
__________ ,其平衡常数表达式为
__________ ;
(3) 的转化率为
的转化率为__________ ,达到平衡时反应放出的热量为__________ ;
(4)若反应温度升高, 的转化率
的转化率___________ (填“增大”“减小”或“不变”);
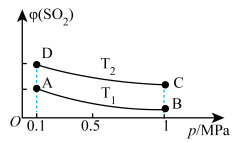
(5)如图表示平衡时 的体积分数随压强和温度变化的曲线。则温度关系:
的体积分数随压强和温度变化的曲线。则温度关系:
__________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 ,发生反应:
,发生反应: 。经
。经 后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(1)判断该反应达到平衡状态的标志是
a.
 、
、 、
、 三者的浓度之比为
三者的浓度之比为
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.
 的物质的量不再变化
的物质的量不再变化e.
 的生成速率和
的生成速率和 的生成速率相等
的生成速率相等(2)从反应开始到平衡的这段时间用
 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率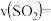

(3)
 的转化率为
的转化率为(4)若反应温度升高,
 的转化率
的转化率(5)如图表示平衡时
 的体积分数随压强和温度变化的曲线。则温度关系:
的体积分数随压强和温度变化的曲线。则温度关系:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】在100℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,发生反应:
2NO2 N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
(1)在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为__________ mol/(L·s)。
(2)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是_________ mol/L。假设在80s时达到平衡,请在如图中画出该条件下N2O4和NO2的浓度随时间变化的曲线。
______
(3)上述(2)达到平衡后四氧化二氮的转化率为_________ ,混合气体的平均摩尔质量为___________ 。
(4)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡将_________ (填“向左移动”、“向右移动”或“不移动”)。
2NO2
 N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为
(2)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是

(3)上述(2)达到平衡后四氧化二氮的转化率为
(4)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4 2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20s—40s内用N2O4表示的平均反应速率为____ 。
(2)该反应的平衡常数K=___ 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色___ (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号)___ ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)___ 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
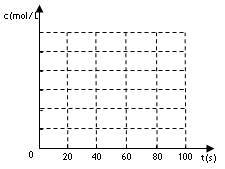
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。____
 2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为
(2)该反应的平衡常数K=
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色
(4)要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。

您最近一年使用:0次
【推荐3】一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4、CH3OH等)为原料来合成一系列化工原料和燃料的化学。天然气重整的反应为:CH4(g)+ H2O(g)  CO(g)+3H2(g) ΔH1=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.4 kJ·mol-1
已知:水煤气变换反应为:CO(g) + H2O(g) CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
(1)CH4与CO2经催化重整制得合成气的热化学反应方程式为______________________ 。
(2)合成气在一定条件下能够合成甲醇反应为CO(g)+3H2(g) CH3OH(g)。在恒温刚性容器中,下列事实能说明该反应达到平衡状态的是
CH3OH(g)。在恒温刚性容器中,下列事实能说明该反应达到平衡状态的是_______________ (填选项字母)。
A.气体密度不再改变
B.容器内的压强不再发生变化
C.气体平均摩尔质量不再改变
D.单位时间内消耗CO和生成CH3OH物质的量相等
(3)在刚性容器中,物质的量相等的CH4和H2O发生天然气重整反应,下图为CH4的平衡转化率与温度、压强的关系。

①图中温度T1、T2、T3、T4的大小顺序为_________________ ,理由是________________ 。
②有利于提高平衡体系中CO体积分数,又能加快化学反应速率的是_________________ 。
A.升高温度 B.加入催化剂
C.减小压强 D.增大水蒸气浓度
③图中压强是起始容器中压强,列式计算CH4和H2O反应在图中N点的平衡常数Kp=_________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
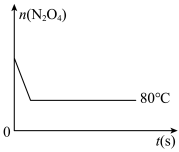
(4)沼气主要由甲烷、二氧化碳和氮气组成,检测沼气中CH4含量的测试仪工作原理如图所示,电极a的电极反应式为______________________________ 。
 CO(g)+3H2(g) ΔH1=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.4 kJ·mol-1已知:水煤气变换反应为:CO(g) + H2O(g)
 CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1(1)CH4与CO2经催化重整制得合成气的热化学反应方程式为
(2)合成气在一定条件下能够合成甲醇反应为CO(g)+3H2(g)
 CH3OH(g)。在恒温刚性容器中,下列事实能说明该反应达到平衡状态的是
CH3OH(g)。在恒温刚性容器中,下列事实能说明该反应达到平衡状态的是A.气体密度不再改变
B.容器内的压强不再发生变化
C.气体平均摩尔质量不再改变
D.单位时间内消耗CO和生成CH3OH物质的量相等
(3)在刚性容器中,物质的量相等的CH4和H2O发生天然气重整反应,下图为CH4的平衡转化率与温度、压强的关系。

①图中温度T1、T2、T3、T4的大小顺序为
②有利于提高平衡体系中CO体积分数,又能加快化学反应速率的是
A.升高温度 B.加入催化剂
C.减小压强 D.增大水蒸气浓度
③图中压强是起始容器中压强,列式计算CH4和H2O反应在图中N点的平衡常数Kp=

(4)沼气主要由甲烷、二氧化碳和氮气组成,检测沼气中CH4含量的测试仪工作原理如图所示,电极a的电极反应式为
您最近一年使用:0次



