某二元酸H2A在水中的电离方程式是H2A = H+ + HA﹣,HA﹣ H+ + A2﹣.回答下列问题:
H+ + A2﹣.回答下列问题:
(1)Na2A溶液显______________ (填“酸性”、“中性”或“碱性”),理由是________________________________ (用离子方程式或必要的文字说明).
(2)常温下,已知0.1mol•L﹣1NaHA溶液pH=2,则0.1mol•L﹣1H2A溶液中氢离子的物质的量浓度可能______ 0.11mol•L﹣1(填“大于”、“等于”或“小于”),理由是_____________________ .
(3)0.1mol•L﹣1NaHA溶液中各种离子浓度由大到小的顺序是_________ .
(4)Na2A溶液中,下列表述正确的是_________ .
A.c(Na+) + c(H+)= c(HA﹣)+ 2c(A2﹣)+ c(OH﹣)
B. c(OH﹣)= c(HA﹣)+ c(H+)
C.c(OH﹣)= c(HA﹣)+ c(H+)+ 2c(H2A)
D.c (Na+)= 2[c(HA﹣)+ c(A2﹣) + c(H2A)]
 H+ + A2﹣.回答下列问题:
H+ + A2﹣.回答下列问题:(1)Na2A溶液显
(2)常温下,已知0.1mol•L﹣1NaHA溶液pH=2,则0.1mol•L﹣1H2A溶液中氢离子的物质的量浓度可能
(3)0.1mol•L﹣1NaHA溶液中各种离子浓度由大到小的顺序是
(4)Na2A溶液中,下列表述正确的是
A.c(Na+) + c(H+)= c(HA﹣)+ 2c(A2﹣)+ c(OH﹣)
B. c(OH﹣)= c(HA﹣)+ c(H+)
C.c(OH﹣)= c(HA﹣)+ c(H+)+ 2c(H2A)
D.c (Na+)= 2[c(HA﹣)+ c(A2﹣) + c(H2A)]
更新时间:2018-01-12 20:38:24
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】(1)FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:(1) FeCl3净水的原理是_______ ;FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)________ 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为____ 。
(3)FeCl3在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1 ;
Fe(OH)2++H+ K1 ;
Fe(OH)2++H2O Fe(OH)2++H+ K2;
Fe(OH)2++H+ K2;
Fe(OH)2++H2O Fe(OH)3+H+ K3。
Fe(OH)3+H+ K3。
以上水解反应的平衡常数K1、K2、K3由小到大的顺序是_____ ;
(4)通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____ ;
A.降温 B.加水稀释 C.加入NH4Cl D.加入NaHCO3
(5)室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是____________ 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为
(3)FeCl3在溶液中分三步水解:Fe3++H2O
 Fe(OH)2++H+ K1 ;
Fe(OH)2++H+ K1 ;Fe(OH)2++H2O
 Fe(OH)2++H+ K2;
Fe(OH)2++H+ K2;Fe(OH)2++H2O
 Fe(OH)3+H+ K3。
Fe(OH)3+H+ K3。以上水解反应的平衡常数K1、K2、K3由小到大的顺序是
(4)通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:xFe3++yH2O
 Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)A.降温 B.加水稀释 C.加入NH4Cl D.加入NaHCO3
(5)室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是
您最近半年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)25℃时,在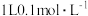 的HA溶液中,有
的HA溶液中,有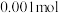 的HA电离成离子,则该温度下的电离平衡常数为
的HA电离成离子,则该温度下的电离平衡常数为_______ 。
(2)在25℃时,将pH=11的 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。
(3)常温下将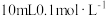 的NaOH溶液与
的NaOH溶液与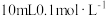 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为_______ 。
(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
①酸性由强到弱的顺序为_______ ;
②将少量的 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:_______ 。
(5)已知25℃时, 的溶度积常数
的溶度积常数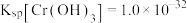 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中 时;应调节pH的最小值a为多少
时;应调节pH的最小值a为多少_______ 。
(6)在 的
的 溶液中,下列粒子浓度关系式正确的是_______(填字母)。
溶液中,下列粒子浓度关系式正确的是_______(填字母)。
(7)已知在25℃时,将浓度相等的HF与NaF溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因_______ 。
(1)25℃时,在
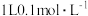 的HA溶液中,有
的HA溶液中,有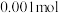 的HA电离成离子,则该温度下的电离平衡常数为
的HA电离成离子,则该温度下的电离平衡常数为(2)在25℃时,将pH=11的
 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。(3)常温下将
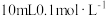 的NaOH溶液与
的NaOH溶液与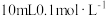 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
| 化学式 |  |  |  |  |
| 电离平衡常数 | 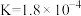 | 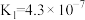 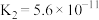 |  | 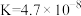 |
②将少量的
 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:(5)已知25℃时,
 的溶度积常数
的溶度积常数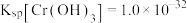 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中 时;应调节pH的最小值a为多少
时;应调节pH的最小值a为多少(6)在
 的
的 溶液中,下列粒子浓度关系式正确的是_______(填字母)。
溶液中,下列粒子浓度关系式正确的是_______(填字母)。A.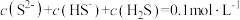 |
B. |
C. |
D.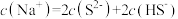 |
您最近半年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________ 。
(2)25℃时,利用pH试纸测得0.1mol•L-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______ ;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____ (填“增大”、“减小”或“无法确定”)。
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______ (取近似值)
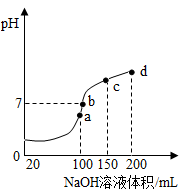
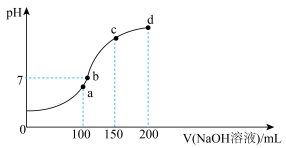
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是________ 点;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________
(2)25℃时,利用pH试纸测得0.1mol•L-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是

您最近半年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】乙二酸 俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
(1)我国国标推荐的食品、药品中钙元素含量的测定方法之一为:利用草酸钠将样品中的 沉淀,洗涤过滤,然后将所得
沉淀,洗涤过滤,然后将所得 溶于强酸,用已知浓度的高锰酸钾溶液滴定草酸测定溶液中钙离子的含量。
溶于强酸,用已知浓度的高锰酸钾溶液滴定草酸测定溶液中钙离子的含量。
①酸性高锰酸钾应该用_______ (填“酸式”或“碱式”)滴定管盛装。
②用已知浓度的高锰酸钾溶液进行滴定时,当滴入最后半滴高锰酸钾溶液时,观察到_______ ,则为滴定终点。
③利用 将样品中的
将样品中的 沉淀,
沉淀, 沉淀完全时(实验中
沉淀完全时(实验中 浓度小于
浓度小于 ,则认为沉淀完全),溶液中
,则认为沉淀完全),溶液中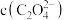 至少为
至少为_______ 。(已知草酸钙的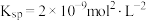 )
)
(2)25℃时,向 溶液中逐滴加入
溶液中逐滴加入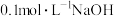 溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
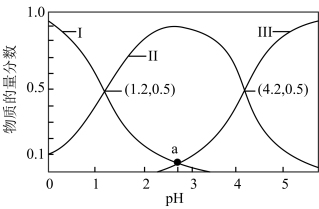
①溶液中 的物质的量分数随溶液pH变化曲线用
的物质的量分数随溶液pH变化曲线用_______ 表示。(填“Ⅰ”“Ⅱ”或“Ⅲ”);25℃时,草酸的电离平衡常数分别是 、
、 ,则
,则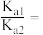
_______ 。
②a点溶液中,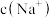
_______ 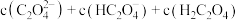 (填“>”“=”或“<”),此时溶液的pH=
(填“>”“=”或“<”),此时溶液的pH=_______ 。
 俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:(1)我国国标推荐的食品、药品中钙元素含量的测定方法之一为:利用草酸钠将样品中的
 沉淀,洗涤过滤,然后将所得
沉淀,洗涤过滤,然后将所得 溶于强酸,用已知浓度的高锰酸钾溶液滴定草酸测定溶液中钙离子的含量。
溶于强酸,用已知浓度的高锰酸钾溶液滴定草酸测定溶液中钙离子的含量。①酸性高锰酸钾应该用
②用已知浓度的高锰酸钾溶液进行滴定时,当滴入最后半滴高锰酸钾溶液时,观察到
③利用
 将样品中的
将样品中的 沉淀,
沉淀, 沉淀完全时(实验中
沉淀完全时(实验中 浓度小于
浓度小于 ,则认为沉淀完全),溶液中
,则认为沉淀完全),溶液中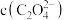 至少为
至少为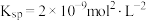 )
)(2)25℃时,向
 溶液中逐滴加入
溶液中逐滴加入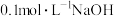 溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
①溶液中
 的物质的量分数随溶液pH变化曲线用
的物质的量分数随溶液pH变化曲线用 、
、 ,则
,则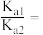
②a点溶液中,
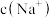
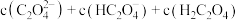 (填“>”“=”或“<”),此时溶液的pH=
(填“>”“=”或“<”),此时溶液的pH=
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐2】根据所学知识,回答下列问题:
(1)已知破坏 键、
键、 键、
键、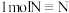 键分别需要吸收的能量为
键分别需要吸收的能量为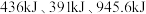 。则由氢气和氮气反应生成
。则由氢气和氮气反应生成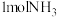 需要放出
需要放出_____  的热量。
的热量。
(2)白磷与氧气可发生反应,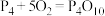 ,已知断裂下列化学键需要吸收的能量分别为
,已知断裂下列化学键需要吸收的能量分别为 键
键 键
键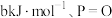 键
键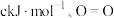 键
键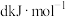 。根据图示的分子结构和有关数据计算,该反应的反应热为
。根据图示的分子结构和有关数据计算,该反应的反应热为_____ (用含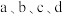 的代数式表示)
的代数式表示) 。
。

(3) 可用作净水剂,其原理是
可用作净水剂,其原理是_____ (用离子方程式说明)。
(4)相同条件下, 溶液中的
溶液中的
_____ (填“等于”、“大于”或“小于”) 溶液中的
溶液中的 。
。
(5)室温时,向 溶液中滴加
溶液中滴加 溶液,溶液
溶液,溶液 与加入
与加入 溶液体积的关系曲线如图所示。
溶液体积的关系曲线如图所示。
①试分析图中a、b、c、d四个点,水的电离程度最大的是_____ 点。
②在b点,溶液中各离子浓度由大到小的排列顺序是_____ 。
③由b到c发生反应的离子方程式为_____ 。
(6)泡沫灭火器的主要成分是硫酸铝溶液和碳酸氢钠溶液,这两种溶液混合后,发生反应的离子方程式为_____ 。
(1)已知破坏
 键、
键、 键、
键、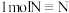 键分别需要吸收的能量为
键分别需要吸收的能量为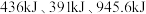 。则由氢气和氮气反应生成
。则由氢气和氮气反应生成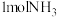 需要放出
需要放出 的热量。
的热量。(2)白磷与氧气可发生反应,
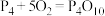 ,已知断裂下列化学键需要吸收的能量分别为
,已知断裂下列化学键需要吸收的能量分别为 键
键 键
键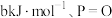 键
键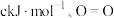 键
键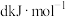 。根据图示的分子结构和有关数据计算,该反应的反应热为
。根据图示的分子结构和有关数据计算,该反应的反应热为 的代数式表示)
的代数式表示) 。
。
(3)
 可用作净水剂,其原理是
可用作净水剂,其原理是(4)相同条件下,
 溶液中的
溶液中的
 溶液中的
溶液中的 。
。(5)室温时,向
 溶液中滴加
溶液中滴加 溶液,溶液
溶液,溶液 与加入
与加入 溶液体积的关系曲线如图所示。
溶液体积的关系曲线如图所示。
①试分析图中a、b、c、d四个点,水的电离程度最大的是
②在b点,溶液中各离子浓度由大到小的排列顺序是
③由b到c发生反应的离子方程式为
(6)泡沫灭火器的主要成分是硫酸铝溶液和碳酸氢钠溶液,这两种溶液混合后,发生反应的离子方程式为
您最近半年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】按要求回答下列问题:
(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为___________ ;
(2)等浓度的NaHCO3、Na2CO3混合溶液中的物料守恒表达式为____________ ;
(3) 浓度为0.1mol/LNa2CO3溶液电荷守恒表达式为__________ ;
(4) 泡沫灭火器灭火时发生反应的离子方程是______________ 。
(5)常温下,NaHSO3溶液中粒子浓度由大到小的顺序_________ 。
(6)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100 ℃的恒温。欲使混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为________ 。(已知100℃,KW=1.0×10-12)
(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为
(2)等浓度的NaHCO3、Na2CO3混合溶液中的物料守恒表达式为
(3) 浓度为0.1mol/LNa2CO3溶液电荷守恒表达式为
(4) 泡沫灭火器灭火时发生反应的离子方程是
(5)常温下,NaHSO3溶液中粒子浓度由大到小的顺序
(6)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100 ℃的恒温。欲使混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为
您最近半年使用:0次



