研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)25℃时,在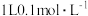 的HA溶液中,有
的HA溶液中,有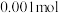 的HA电离成离子,则该温度下的电离平衡常数为
的HA电离成离子,则该温度下的电离平衡常数为_______ 。
(2)在25℃时,将pH=11的 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。
(3)常温下将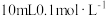 的NaOH溶液与
的NaOH溶液与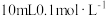 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为_______ 。
(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
①酸性由强到弱的顺序为_______ ;
②将少量的 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:_______ 。
(5)已知25℃时, 的溶度积常数
的溶度积常数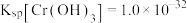 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中 时;应调节pH的最小值a为多少
时;应调节pH的最小值a为多少_______ 。
(6)在 的
的 溶液中,下列粒子浓度关系式正确的是_______(填字母)。
溶液中,下列粒子浓度关系式正确的是_______(填字母)。
(7)已知在25℃时,将浓度相等的HF与NaF溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因_______ 。
(1)25℃时,在
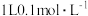 的HA溶液中,有
的HA溶液中,有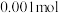 的HA电离成离子,则该温度下的电离平衡常数为
的HA电离成离子,则该温度下的电离平衡常数为(2)在25℃时,将pH=11的
 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。(3)常温下将
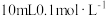 的NaOH溶液与
的NaOH溶液与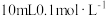 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
| 化学式 |  |  |  |  |
| 电离平衡常数 | 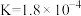 | 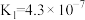 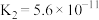 |  | 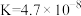 |
②将少量的
 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:(5)已知25℃时,
 的溶度积常数
的溶度积常数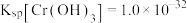 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中 时;应调节pH的最小值a为多少
时;应调节pH的最小值a为多少(6)在
 的
的 溶液中,下列粒子浓度关系式正确的是_______(填字母)。
溶液中,下列粒子浓度关系式正确的是_______(填字母)。A.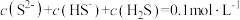 |
B. |
C. |
D.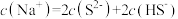 |
22-23高二下·上海黄浦·期中 查看更多[2]
更新时间:2023-04-15 17:09:41
|
相似题推荐
填空题
|
较难
(0.4)
解题方法
【推荐1】已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,物质的量溶度相同的三种物质的量浓度①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是_______ (填序号)。
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为_______ 。
(3)NaClO溶液中的电荷守恒关系为_______ 。
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_______ 。
(5)25℃下,将 的苛性钠溶液
的苛性钠溶液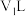 与
与 的稀硫酸
的稀硫酸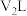 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
_______ 。
(6)25℃时,H2SO3⇌H++HSO 的电离常数
的电离常数 ,则该温度下
,则该温度下 的水解常数Kh=
的水解常数Kh=_______ 。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
(1)常温下,物质的量溶度相同的三种物质的量浓度①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的电荷守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)25℃下,将
 的苛性钠溶液
的苛性钠溶液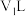 与
与 的稀硫酸
的稀硫酸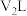 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
(6)25℃时,H2SO3⇌H++HSO
 的电离常数
的电离常数 ,则该温度下
,则该温度下 的水解常数Kh=
的水解常数Kh=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】水溶液中存在多种类型的平衡。
(1)25℃时, 现有 pH=2 的醋酸和 pH=2 的盐酸
①取 10mL的上述醋酸溶液,加入等体积的水,醋酸的电离平衡___________ 移动(填“向左”、“向右”或“不”)。
②相同条件下,取等体积的上述醋酸、盐酸溶液,各稀释100倍。稀释后的溶液,其pH 大小关系为 pH(醋酸)___________ pH(盐酸)(填“大于”、“小于”或“等于”)。
③取上述醋酸、盐酸溶液,分别与等体积、等浓度 NaOH 稀溶液恰好完全反应,则消耗的两种酸溶液的体积大小关系为 V(醋酸)___________ V(盐酸)(填“大于”、“小于”或“等于”)。
(2)实验室可用 NaOH 溶液吸收 NO2,含 0.2mol NaOH 的水溶液与0.2mol NO2恰好完全反应得1L溶液 A,溶液B为0.1mol·L⁻¹的CH3COONa溶液,则两溶液中 c( )、c(
)、c( )和
)和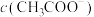 由大到小的顺序为
由大到小的顺序为___________ ,已知 HNO2的电离常数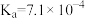 ,
, 的电离常数
的电离常数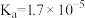 ,可使溶液 A 和溶液 B 的 pH 相等的方法是
,可使溶液 A 和溶液 B 的 pH 相等的方法是___________ 。
a.向溶液 A 中加适量水 b.向溶液 A 中加适量 NaOH
c.向溶液 B 中加适量水 d.向溶液 B 中加适量 NaOH
(3)25℃时,H2SO3的电离常数: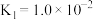 ,
,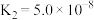 ;H2CO3的电离常数:
;H2CO3的电离常数: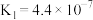 ,
,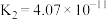 。
。
①写出碳酸的第一级电离平衡常数表达式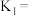
______________ 。
②足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为___________ 。
(1)25℃时, 现有 pH=2 的醋酸和 pH=2 的盐酸
①取 10mL的上述醋酸溶液,加入等体积的水,醋酸的电离平衡
②相同条件下,取等体积的上述醋酸、盐酸溶液,各稀释100倍。稀释后的溶液,其pH 大小关系为 pH(醋酸)
③取上述醋酸、盐酸溶液,分别与等体积、等浓度 NaOH 稀溶液恰好完全反应,则消耗的两种酸溶液的体积大小关系为 V(醋酸)
(2)实验室可用 NaOH 溶液吸收 NO2,含 0.2mol NaOH 的水溶液与0.2mol NO2恰好完全反应得1L溶液 A,溶液B为0.1mol·L⁻¹的CH3COONa溶液,则两溶液中 c(
 )、c(
)、c( )和
)和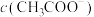 由大到小的顺序为
由大到小的顺序为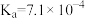 ,
, 的电离常数
的电离常数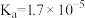 ,可使溶液 A 和溶液 B 的 pH 相等的方法是
,可使溶液 A 和溶液 B 的 pH 相等的方法是a.向溶液 A 中加适量水 b.向溶液 A 中加适量 NaOH
c.向溶液 B 中加适量水 d.向溶液 B 中加适量 NaOH
(3)25℃时,H2SO3的电离常数:
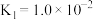 ,
,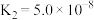 ;H2CO3的电离常数:
;H2CO3的电离常数: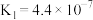 ,
,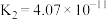 。
。①写出碳酸的第一级电离平衡常数表达式
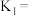
②足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】水是极弱的电解质,其中存在电离平衡H2O⇌H++OH-,回答下列问题:
(1)常温下,某电解质溶解在水中后,溶液中水电离的c(H+)=1×10-9,则该电解质可能是_______ (填序号)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)常温时,取0.1mol·L-1 HX溶液与0.1mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH=8。
①混合溶液中由水电离出的c(OH-)与0.1mol/LNaOH溶液中由水电离出的c(OH-)之比为_______ 。
②已知NH4X溶液呈中性,将HX溶液加入到Na2CO3溶液中有气体放出。试推断NH4HCO3溶液的pH_______ 7(填“>”“<”或“=”)。
(3)T℃时,测得0.01mol·L-1 NaOH溶液的pH=10,则此温度下水的Kw=_______ 。在此温度下,将0.01mol·L-1 H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va∶Vb=_______ (忽略溶液混合时体积的变化)。
(1)常温下,某电解质溶解在水中后,溶液中水电离的c(H+)=1×10-9,则该电解质可能是
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)常温时,取0.1mol·L-1 HX溶液与0.1mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH=8。
①混合溶液中由水电离出的c(OH-)与0.1mol/LNaOH溶液中由水电离出的c(OH-)之比为
②已知NH4X溶液呈中性,将HX溶液加入到Na2CO3溶液中有气体放出。试推断NH4HCO3溶液的pH
(3)T℃时,测得0.01mol·L-1 NaOH溶液的pH=10,则此温度下水的Kw=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】实验表明,液态时,纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都能像水那样进行自身电离(H2O+H2O H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是________________ 。
(2)25 ℃时,液态纯硫酸的离子积常数K(H2SO4)___________ 1×10-14(填“>”、“<”或“=”)。
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是____________ ,这是因为混合酸中不仅存在硫酸和硝酸各自电离的两个电离平衡,而且还因硫酸的酸度大于硝酸,又在无水条件下,混合酸中必然发生____________ (写离子方程式)反应。
 H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:(1)纯硫酸在液态时自身电离的方程式是
(2)25 ℃时,液态纯硫酸的离子积常数K(H2SO4)
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】物质在水中存在电离平衡、水解平衡。请根据所学知识回答:
(1)次磷酸( )是一种精细化工产品,向10mL
)是一种精细化工产品,向10mL  溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有
溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有 、
、 两种阴离子。
两种阴离子。
①写出 溶液与足量NaOH溶液反应后形成的正盐的化学式:
溶液与足量NaOH溶液反应后形成的正盐的化学式:___________ 。
②常温下,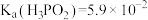 ,0.1mol/L的
,0.1mol/L的 溶液在加水稀释过程中,下列表达式的数据一定变小的是
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________ (填序号)。
A. B.
B. C.
C.
(2)25℃时,HF的电离常数为 ;
; 的电离常数为
的电离常数为 ,
,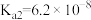 ,
, 。在
。在 溶液加入过量NaF溶液的离子反应方程式为
溶液加入过量NaF溶液的离子反应方程式为___________ 。
(3)盐碱地(含较多 、NaCl)不利于植物生长,盐碱地呈碱性的原因:
、NaCl)不利于植物生长,盐碱地呈碱性的原因:___________ (用离子方程式说明);已知25℃时,H2CO3的Ka1= 4.3×10-7,Ka2= 5×10-11 ,则当 溶液中
溶液中 时,溶液的pH=
时,溶液的pH=___________ 。
(4)某温度下,水的离子积常数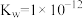 。该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为
。该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为___________ 。
(5)相同物质的量浓度的五种溶液:① 、②氨水、③
、②氨水、③ 、④
、④ 、⑤
、⑤ ,
, 由大到小顺序是
由大到小顺序是___________ (用序号表示)。
(1)次磷酸(
 )是一种精细化工产品,向10mL
)是一种精细化工产品,向10mL  溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有
溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有 、
、 两种阴离子。
两种阴离子。①写出
 溶液与足量NaOH溶液反应后形成的正盐的化学式:
溶液与足量NaOH溶液反应后形成的正盐的化学式:②常温下,
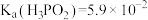 ,0.1mol/L的
,0.1mol/L的 溶液在加水稀释过程中,下列表达式的数据一定变小的是
溶液在加水稀释过程中,下列表达式的数据一定变小的是A.
 B.
B. C.
C.
(2)25℃时,HF的电离常数为
 ;
; 的电离常数为
的电离常数为 ,
,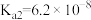 ,
, 。在
。在 溶液加入过量NaF溶液的离子反应方程式为
溶液加入过量NaF溶液的离子反应方程式为(3)盐碱地(含较多
 、NaCl)不利于植物生长,盐碱地呈碱性的原因:
、NaCl)不利于植物生长,盐碱地呈碱性的原因: 溶液中
溶液中 时,溶液的pH=
时,溶液的pH=(4)某温度下,水的离子积常数
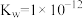 。该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为
。该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为(5)相同物质的量浓度的五种溶液:①
 、②氨水、③
、②氨水、③ 、④
、④ 、⑤
、⑤ ,
, 由大到小顺序是
由大到小顺序是
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB- H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显________ (填“酸性”“中性”或“碱性”),理由是____________________ (用离子方程式表示)。
(2)在0.1mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________ (填字母)。
A.c(B2-)+c(HB-)+c(H2B)=0.1mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1mol·L-1NaHB溶液的pH=2,0.1mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是______________________________
 H++B2-。回答下列问题。
H++B2-。回答下列问题。(1)Na2B溶液显
(2)在0.1mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)+c(H2B)=0.1mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1mol·L-1NaHB溶液的pH=2,0.1mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】回答下列问题:
(1)已知:H2S:Ka1=1.3×10﹣7 Ka2=7.1×10−15; H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10−11;
CH3COOH:Ka=1.8×10﹣5 NH3•H2O:Kb=1.8×10﹣5。
①常温下,0.1 mol∙L−1Na2S溶液和0.1 mol∙L−1Na2CO3溶液,碱性更强的是___________ 。
②25℃时,NaHCO3溶液的pH___________ (填“大于”或“小于”)CH3COONa溶液的pH。
③NH4HCO3溶液显___________ 性。
(2)25℃时,H2SO3
 +H+的电离常数Ka=1.0×10−2,则该温度下NaHSO3的水解常数Kh=
+H+的电离常数Ka=1.0×10−2,则该温度下NaHSO3的水解常数Kh=___________ 。
(3)能证明Na2SO3溶液中存在 +H2O
+H2O
 +OH﹣水解平衡的事实是
+OH﹣水解平衡的事实是___________ (填字母,下同)。
A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(4)氯化铝水溶液呈___________ 性(填“酸”、“中”、“碱”),把AlCl3溶液蒸干、灼烧后,得到的主要固体产物是 ___________ 。
(5)①写出1mol/L的NaH2PO4溶液中的电荷守恒表达式:___________ 。
②泡沫灭火器[里面装饱和NaHCO3溶液和Al2(SO4)3]的工作原理:______________________ (用离子方程式表示)。
(1)已知:H2S:Ka1=1.3×10﹣7 Ka2=7.1×10−15; H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10−11;
CH3COOH:Ka=1.8×10﹣5 NH3•H2O:Kb=1.8×10﹣5。
①常温下,0.1 mol∙L−1Na2S溶液和0.1 mol∙L−1Na2CO3溶液,碱性更强的是
②25℃时,NaHCO3溶液的pH
③NH4HCO3溶液显
(2)25℃时,H2SO3

 +H+的电离常数Ka=1.0×10−2,则该温度下NaHSO3的水解常数Kh=
+H+的电离常数Ka=1.0×10−2,则该温度下NaHSO3的水解常数Kh=(3)能证明Na2SO3溶液中存在
 +H2O
+H2O
 +OH﹣水解平衡的事实是
+OH﹣水解平衡的事实是A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(4)氯化铝水溶液呈
(5)①写出1mol/L的NaH2PO4溶液中的电荷守恒表达式:
②泡沫灭火器[里面装饱和NaHCO3溶液和Al2(SO4)3]的工作原理:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】按要求填空
(1)KAl(SO4)2·12H2O可做净水剂,其原理是(用离子方程式表示)___________ 。
(2)将体积相等的NaOH稀溶液和CH3COOH稀溶液充分混合后,若溶液中c(Na+)=c(CH3COO-),则混合前c(NaOH)___________ (填“ ”“
”“ ”或“
”或“ ”)c(CH3COOH)。
”)c(CH3COOH)。
(3)将AgCl分别放入①5mL H2O、②10mL 0.2mol/L MgCl2溶液、③20mL 0.5mol/L AgNO3溶液、④40mL 0.1mol/L HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是___________ (用序号填空)。
(4)常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,若溶液呈中性则CH3COOH的电离平衡常数Ka=___________ 。
(5)室温下,1mol/L相同体积的下列四种溶液①BaCl2、②FeCl3、③HF、④Na2CO3所含阳离子数由少到多的顺序是(用序号填空)___________ 。
(6)标准状况下,将2.24L CO2通入100mL浓度为1.5mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:2c(Na+)=___________ 。
(1)KAl(SO4)2·12H2O可做净水剂,其原理是(用离子方程式表示)
(2)将体积相等的NaOH稀溶液和CH3COOH稀溶液充分混合后,若溶液中c(Na+)=c(CH3COO-),则混合前c(NaOH)
 ”“
”“ ”或“
”或“ ”)c(CH3COOH)。
”)c(CH3COOH)。(3)将AgCl分别放入①5mL H2O、②10mL 0.2mol/L MgCl2溶液、③20mL 0.5mol/L AgNO3溶液、④40mL 0.1mol/L HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是
(4)常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,若溶液呈中性则CH3COOH的电离平衡常数Ka=
(5)室温下,1mol/L相同体积的下列四种溶液①BaCl2、②FeCl3、③HF、④Na2CO3所含阳离子数由少到多的顺序是(用序号填空)
(6)标准状况下,将2.24L CO2通入100mL浓度为1.5mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:2c(Na+)=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为H3PO4,沸点高难挥发)有一定关系。
(1)室温下,测得0.1mol/LH3PO4溶液的pH=1.5,用电离方程式解释原因:__ 。
(2)长期过量饮用可乐会破坏牙釉质,使下面的平衡向脱矿方向移动,造成龋齿。结合平衡移动原理解释原因:__ 。
Ca5(PO4)3OH(s)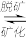 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO (aq)+OH-(aq)
(aq)+OH-(aq)
(3)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。
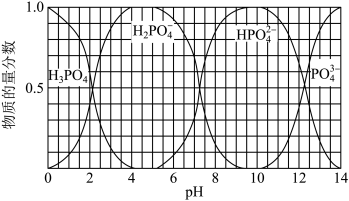
①向磷酸溶液中滴加NaOH溶液至pH=10时发生的主要反应的离子方程式是___ 。
②下列关于0.1mol/LNa2HPO4溶液的说法正确的是__ (填序号)。
a.Na2HPO4溶液显碱性,原因是HPO 的水解程度大于其电离程度
的水解程度大于其电离程度
b.c(Na+)+c(H+)=c(H2PO )+2c(HPO
)+2c(HPO )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)
c.c(Na+)=c(H2PO )+c(HPO
)+c(HPO )+c(PO
)+c(PO )+c(H3PO4)
)+c(H3PO4)
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取50.00mL滤液,用百里香酚酞作指示剂,用0.100mol/LNaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00mL。
①加热的目的是__ 。
②该可乐样品中磷酸的含量为__ g/L(H3PO4摩尔质量为98g/mol)。
(1)室温下,测得0.1mol/LH3PO4溶液的pH=1.5,用电离方程式解释原因:
(2)长期过量饮用可乐会破坏牙釉质,使下面的平衡向脱矿方向移动,造成龋齿。结合平衡移动原理解释原因:
Ca5(PO4)3OH(s)
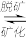 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO (aq)+OH-(aq)
(aq)+OH-(aq) (3)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。

①向磷酸溶液中滴加NaOH溶液至pH=10时发生的主要反应的离子方程式是
②下列关于0.1mol/LNa2HPO4溶液的说法正确的是
a.Na2HPO4溶液显碱性,原因是HPO
 的水解程度大于其电离程度
的水解程度大于其电离程度b.c(Na+)+c(H+)=c(H2PO
 )+2c(HPO
)+2c(HPO )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)c.c(Na+)=c(H2PO
 )+c(HPO
)+c(HPO )+c(PO
)+c(PO )+c(H3PO4)
)+c(H3PO4)(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取50.00mL滤液,用百里香酚酞作指示剂,用0.100mol/LNaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00mL。
①加热的目的是
②该可乐样品中磷酸的含量为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】利用所学化学反应原理,解决以下问题:
(1)碳酸氢钠溶液蒸干并灼烧得到的固体物质是_______ (填化学式)
(2)向 溶液中加
溶液中加 溶液,有沉淀和气体生成的离子方程式为
溶液,有沉淀和气体生成的离子方程式为_______
(3)将 分别放入①5
分别放入①5
 ,②10
,②10 0.2
0.2
 溶液,③20
溶液,③20 0.5
0.5
 溶液,④40
溶液,④40 0.1
0.1
 溶液中溶解至饱和,各溶液中
溶液中溶解至饱和,各溶液中 的浓度由大到小的顺序是:
的浓度由大到小的顺序是:_______ (填序号)。
(4)25℃时,若体积为 、
、 的某一元强酸溶液与体积为
的某一元强酸溶液与体积为 、
、 的某一元强碱溶液混合,恰好中和,若
的某一元强碱溶液混合,恰好中和,若 ,则
,则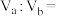
_______ 。
(5)已知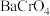 的
的 ,要使溶液中的
,要使溶液中的 沉淀完全[
沉淀完全[ ],溶液中钡离子浓度至少为
],溶液中钡离子浓度至少为_______  。
。
(6)在25℃下,将a 的氨水与0.01
的氨水与0.01 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显_______ (填“酸”、“碱”或“中”)性;用含a的代数式表示 的电离常数
的电离常数
_______ 。
(1)碳酸氢钠溶液蒸干并灼烧得到的固体物质是
(2)向
 溶液中加
溶液中加 溶液,有沉淀和气体生成的离子方程式为
溶液,有沉淀和气体生成的离子方程式为(3)将
 分别放入①5
分别放入①5
 ,②10
,②10 0.2
0.2
 溶液,③20
溶液,③20 0.5
0.5
 溶液,④40
溶液,④40 0.1
0.1
 溶液中溶解至饱和,各溶液中
溶液中溶解至饱和,各溶液中 的浓度由大到小的顺序是:
的浓度由大到小的顺序是:(4)25℃时,若体积为
 、
、 的某一元强酸溶液与体积为
的某一元强酸溶液与体积为 、
、 的某一元强碱溶液混合,恰好中和,若
的某一元强碱溶液混合,恰好中和,若 ,则
,则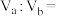
(5)已知
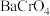 的
的 ,要使溶液中的
,要使溶液中的 沉淀完全[
沉淀完全[ ],溶液中钡离子浓度至少为
],溶液中钡离子浓度至少为 。
。(6)在25℃下,将a
 的氨水与0.01
的氨水与0.01 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显 的电离常数
的电离常数
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】(1)25 ℃时,浓度为0.1 mol·L-1的6种溶液:①HCl,②CH3COOH,③Ba(OH)2,④Na2CO3,⑤KCl,⑥NH4Cl。溶液pH由小到大的顺序为________ (填写编号)。
(2)25 ℃时,醋酸的电离常数Ka=1.7×10-5 mol·L-1,则该温度下CH3COONa的水解平衡常数K=_______ mol·L-1(保留到小数点后一位)。
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈________ (填“酸性”“中性”或“碱性”)。
(4)25 ℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Ka=________ 。
(2)25 ℃时,醋酸的电离常数Ka=1.7×10-5 mol·L-1,则该温度下CH3COONa的水解平衡常数K=
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈
(4)25 ℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Ka=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】用化学知识填空:
(1)NaHCO3溶液显碱性,用离子方程式表示其原因_______________ ,其溶液中离子浓度大小顺序为____________________ 。
(2)向50mL0.018mol•L﹣1的AgNO3溶液中加入50mL0.020mol•L﹣1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10﹣10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=____________ 。
②完全沉淀后,溶液的pH=____________________ 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应式为2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2,该电池正极的电极反应式为_________________ 。
(1)NaHCO3溶液显碱性,用离子方程式表示其原因
(2)向50mL0.018mol•L﹣1的AgNO3溶液中加入50mL0.020mol•L﹣1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10﹣10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液的pH=
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应式为2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2,该电池正极的电极反应式为
您最近一年使用:0次



