(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5kJ的热量,请写出该反应的热化学方程式
(2)在150℃时2L 的密闭容器中,将2molCH4和2mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=
②在该温度下,计算该反应的平衡常数K=
③下列选项中能表示该反应已达到平衡状态的是
A.V(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C(CH4)=C(CO)
(3)合成气中的氢气也用于合成氨气:N2+3H2
 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是| 容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2 的体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
| 甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | v甲 | P甲 |
| 乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | v乙 | P乙 |
| 丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | v丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.v乙 >v丙>v甲 D.P乙>P甲=P丙
(4)合成气可以制取甲醚,绿色电源“二甲醚-氧气燃料电池”工作原理如下图所示
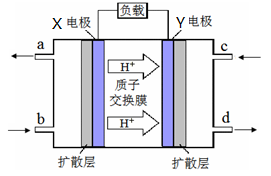
① 电极Y 上发生的反应式为
②电池在放电过程中,电极X周围溶液的pH
相似题推荐
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式:
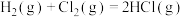
 kJ·mol
kJ·mol ;该反应属于
;该反应属于(2)常温常压下,1 mol乙醇完全燃烧生成
 气体和液态水放出的热量为1367kJ,写出乙醇燃烧热的热化学方程式:
气体和液态水放出的热量为1367kJ,写出乙醇燃烧热的热化学方程式:(3)根据盖斯定律计算
 (白磷,s)
(白磷,s)
 kJ·mol
kJ·mol ①
①P(红磷,s)

 kJ·mol
kJ·mol ②
②则白磷转化为红磷的热化学方程式为
(4)已知破坏1 mol
 键、1 mol
键、1 mol 键、1mol
键、1mol 键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2molHI需要放出
键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2molHI需要放出(5)已知①


②


③


利用上述三个反应,计算

 的反应焓变为
的反应焓变为 、
、 、
、 的式子表示)
的式子表示)(6)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: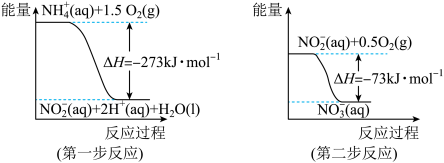
①第一步反应是
②1 mol
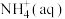 全部氧化成
全部氧化成 的热化学方程式是
的热化学方程式是(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
| 物质浓度 时间/min | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L-1 | 0.13 mol·L-1 | 0.1 mol·L-1 | 0.1 mol·L-1 | 0.09 mol·L-1 |
| H2 | 0 mol·L-1 | 0.2 mol·L-1 | 0.3 mol·L-1 | 0.3 mol·L-1 | 0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
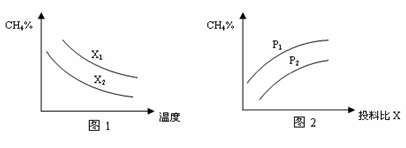
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
 )和亚硫酰氯(
)和亚硫酰氯( )均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
)均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。已知

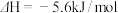 (Ⅰ)
(Ⅰ)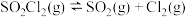

 (Ⅱ)
(Ⅱ)(1)
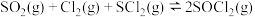 的平衡常数
的平衡常数
 、
、 表示),
表示),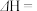
 。
。(2)若在绝热、恒容的密闭容器中,投入一定量的
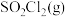 和
和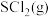 发生反应(Ⅰ),下列示意图能说明
发生反应(Ⅰ),下列示意图能说明 时刻反应达到平衡状态的是
时刻反应达到平衡状态的是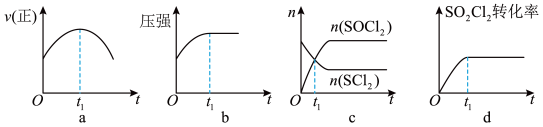
(3)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol
 ,10min后反应(Ⅱ)达到平衡。测得10min内
,10min后反应(Ⅱ)达到平衡。测得10min内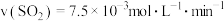 。则平衡时
。则平衡时 的转化率
的转化率
 的转化率
的转化率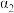
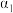 (填“>”、“<”或“=”)。若要增大
(填“>”、“<”或“=”)。若要增大 的转化率,可以采取的措施有
的转化率,可以采取的措施有(4)将
 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,试解释原因
,试解释原因 2CO(g)+2H2(g) △H,反应体系还涉及以下副反应:
2CO(g)+2H2(g) △H,反应体系还涉及以下副反应:i.CH4(g)
 C(s)+2H2(g) △H1=+75.0kJ•mol-1;
C(s)+2H2(g) △H1=+75.0kJ•mol-1;ii.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.0kJ•mol-1;
CO(g)+H2O(g) △H2=+41.0kJ•mol-1;iii.CO(g)+H2(g)
 C(s)+H2O(g) △H3=-131.0kJ•mol-1。
C(s)+H2O(g) △H3=-131.0kJ•mol-1。(1)主反应的△H=
(2)我国学者对催化重整的主反应进行理论研究,提出在Pt-Ni合金或Sn-Ni合金催化下,先发生甲烷逐级脱氢反应,其反应历程如图1所示(*表示物种吸附在催化剂表面)。Sn-Ni合金作催化剂时该历程中最大能垒E正=
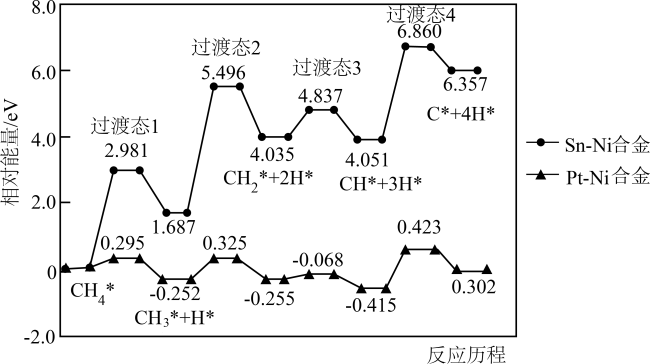
图1
(3)在1L恒容密闭容器中通入1molH2及一定量CO,反应iii中CO的平衡转化率随n(CO)及温度的变化关系如图2所示。
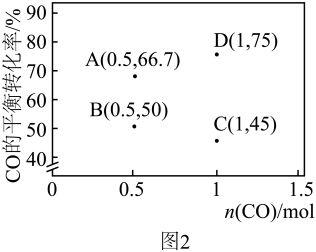
①A、B两点对应的CO正反应速率v正(A)
②已知反应速率v正=k正·x(CO)·x(H2),v逆=k逆·x(H2O)·x(H2),k为反应速率常数,x为气体的物质的量分数,在达到平衡状态为D点的反应过程(此过程为恒温)中,当某时刻CO的转化率刚好达到60%时,
 =
=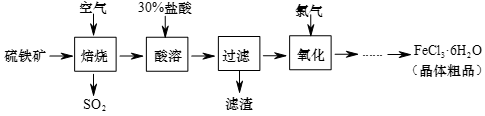
完成下列填空:
(1)焙烧产生的SO2可以继续制备硫酸,其中的反应之一为:2SO2+O2
 2SO3+Q(Q>0),该反应的平衡常数表达式为K=
2SO3+Q(Q>0),该反应的平衡常数表达式为K=a.1s b.5s c.10s d.50s
(2)硫铁矿焙烧后的烧渣中含有Fe2O3、Fe3O4等。酸溶后溶液中主要存在的阳离子有
(3)通入氯气时,主要反应的离子方程式为
(4)酸溶及后续过程中均需保持盐酸过量,请从水解平衡移动原理解释原因
(1)NO2可用水吸收,相应的化学反应方程式为
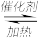 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是(2)已知:2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-12NO(g)+O2(g)
 2NO2(g) ΔH=-113.0 kJ·mol
2NO2(g) ΔH=-113.0 kJ·mol则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=a 体系压强保持不变 b 混合气体颜色保持不变
c SO3和NO的体积比保持不变 d 每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH
(1)已知下列反应的热化学方程式:
① 2H2S(g)
 S2(g)+2H2(g) ΔH1 = +180 kJ·mol-1
S2(g)+2H2(g) ΔH1 = +180 kJ·mol-1② CS2(g)+2H2(g)
 CH4(g)+S2(g) ΔH2 = -81 kJ·mol-1
CH4(g)+S2(g) ΔH2 = -81 kJ·mol-1则反应③ CH4(g)+2H2S(g)
 CS2(g)+4H2(g)的ΔH3=
CS2(g)+4H2(g)的ΔH3=(2)一定温度下的恒容体系,下列叙述能说明反应②达到平衡状态的是___________(填标号)。
| A.体系压强不再变化 |
| B.断裂1 mol C=S键的同时生成4 mol C-H键 |
| C.混合气体的密度不再变化 |
| D.2ν正(H2)=ν逆(S2) |

(4)某科研小组将微电池技术用于去除废气中的H2S,其装置示意图如图二,主要反应:2Fe+2H2S+O2 = 2FeS+2H2O (FeS难溶于水),室温时,pH=7的条件下,研究反应时间对H2S的去除率的影响。
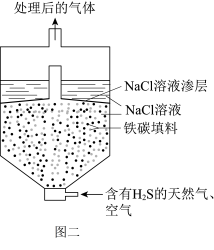
① 装置中微电池负极的电极反应式为
②一段时间后,电流减小,单位时间内H2S的去除率降低,可能的原因是
(1) CO2与H2催化重整制备CH3OCH3的过程中存在以下反应:
I.
 ;
;Ⅱ.
 。
。已知:相关物质能量变化的示意图如图所示:
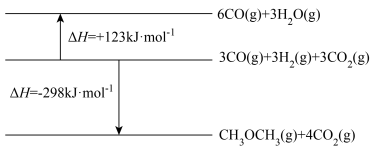
①由已知信息可知

 。
。②向密闭容器中以物质的量之比为1∶3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。
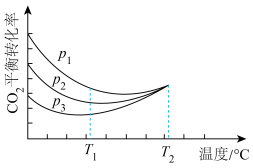
由图2可知,
 由大到小的顺序为
由大到小的顺序为 时主要发生反应为
时主要发生反应为(2)工业上常用合成气(主要成分为CO、H2)在一定条件下制备甲醇,其涉及反应如下:
反应1:
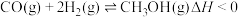
反应2:
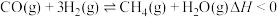
反应3:
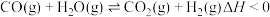
向容积为2L的刚性密闭催化反应器中充入2molCO和4molH2发生上述反应,测得不同温度下,2min内CO的转化率和CH3OH的选择性(CH3OH的选择性
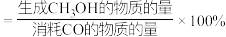 )如图所示。
)如图所示。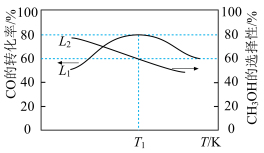
①若反应过程中催化剂的活性几乎不受温度影响,则T1前CO转化率升高的原因是:
②反应在T1K下,2min时达到平衡,此时体系压强为
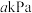 ,
,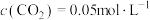 。用CO的分压变化表示的化学反应速率为
。用CO的分压变化表示的化学反应速率为 ,反应3的)
,反应3的)
 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压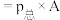 的物质的量分数,以上两空结果均保留3位小数)。
的物质的量分数,以上两空结果均保留3位小数)。
【推荐3】氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用。回答下列问题:
(1)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
在恒温、恒容的密闭容器中,合成氨反应的各物质浓度的变化曲线如图所示。
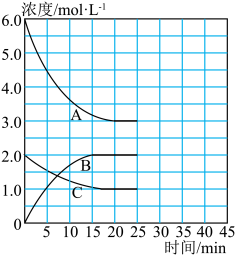
①计算在该温度下反应2NH3(g) N2(g)+3H2(g)的平衡常数K=
N2(g)+3H2(g)的平衡常数K=
②在第25min末,保持其它条件不变,若将温度降低,在第35min末再次达到平衡。在平衡移动过程中N2浓度变化了0.5mol/L,请在图中画出25-40minNH3浓度变化曲线。
③已知:2N2(g)+6H2O(l)
 4NH3(g)+3O2(g)△H=+1530.0kJ/mol,则氢气的热值为
4NH3(g)+3O2(g)△H=+1530.0kJ/mol,则氢气的热值为
(2)① N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,请解释为什么用过量氨气反应的原因:
②用NaClO与NH3制N2H4的反应是相当复杂的,主要分为两步:
已知第一步:NH3+ClO-=OH-+NH2Cl
请写出第二步离子方程式:
③ N2H4易溶于水,是与氨相类似的弱碱,已知其常温下电离常数K1=1.0×10-6,常温下,将0.2 mol/L N2H4·H2O与0.lmol/L,盐酸等体积混合(忽略体积变化)。则此时溶液的pH等于
①2CH4(g)+O2(g)
 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1②CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2③2CH4(g)+O2(g)
 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1(1)ΔH2=
(2)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。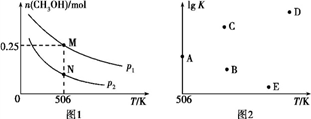
①M点时,H2的转化率为
②反应速率:N点v正(CO)
③若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图2所示。则温度为506 K时,平衡常数K=
④在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式
(1)在常温,1.01×105Pa时,48g 甲醇在足量的氧气中充分燃烧生成二氧化碳和液态水,放出1089kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)在生产和生活中经常遇到化学能与电能的相互转化。在如图甲、乙两装置中,甲中负极电极反应式为
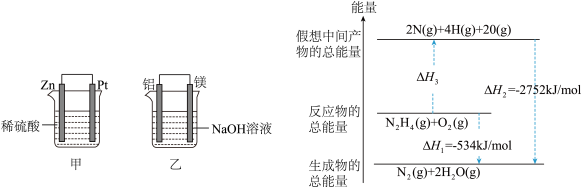
(3)肼(N2H4)可作为火箭发动机的燃料,有关肼化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为944、O=O为500、N-N为154,则反应物转化为中间产物的ΔH3=
(4)工业制氢气的一个重要反应是:CO(g)+ H2O(g) =CO2(g) + H2(g),
已知25℃时: C(石墨)+O2(g) = CO2(g) ; △H1= -394 kJ•mol-1
C(石墨)+
 O2(g) = CO(g); △H2= -111 kJ•mol-1
O2(g) = CO(g); △H2= -111 kJ•mol-1H2(g)+
 O2 (g)=H2O(g); △H3= -242kJ•mol-1
O2 (g)=H2O(g); △H3= -242kJ•mol-1试计算25℃时CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H=
 2K2CO3+6H2O。请填空:
2K2CO3+6H2O。请填空: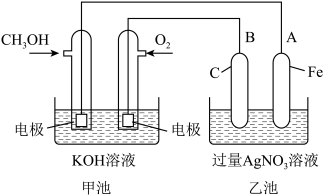
(1)充电时:①原电池的负极与电源
②阳极的电极反应式为
(2)放电时:负极的电极反应式为
(3)某兴趣小组的同学用如图装置进行如下实验:在此过程中若完全反应,乙池中A极的质量升高648g,则甲池中理论上消耗O2的体积为
(4)已知常温时CuS的Ksp=1.3×10-36,向100 mL 2×10-18 mol·L-1的K2S溶液中加入100 mL 2×10-18 mol·L-1的CuCl2溶液,试通过计算说明有无CuS沉淀生成(写出计算推理过程,忽略溶液混合时的体积变化)



