常温下,下列有关叙述正确的是
| A.同浓度的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ |
| B.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C.10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
| D.0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
更新时间:2018-03-12 19:43:45
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】25℃时,向20 mL 0.1 mol/L一元弱酸HA溶液中滴加0.1 mol/L NaOH溶液,溶液中lg 与pH关系如图所示。下列说法正确的是
与pH关系如图所示。下列说法正确的是
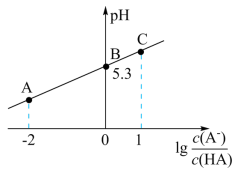
 与pH关系如图所示。下列说法正确的是
与pH关系如图所示。下列说法正确的是
| A.A点或B点所示溶液中,离子浓度最大的均是Na+ |
| B.HA滴定NaOH溶液时可用甲基橙作指示剂 |
| C.达到图中B点溶液时,加入NaOH溶液的体积小于10 mL |
D.对C点溶液加热(不考虑挥发),则 一定增大 一定增大 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】常温下,下列说法正确的是
A.向 溶液中加入等浓度等体积的盐酸: 溶液中加入等浓度等体积的盐酸: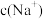 = =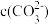 + + 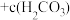 |
B. 溶液中: 溶液中: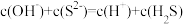 |
C.pH相同的① 溶液、② 溶液、② 溶液中 溶液中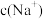 :①<② :①<② |
D.pH=9的 的 的 的溶液中: 的溶液中: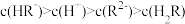 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,向20mL NaB溶液中滴入等浓度的HA溶液,所得溶液中
NaB溶液中滴入等浓度的HA溶液,所得溶液中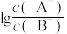 与
与 的关系如图所示。已知
的关系如图所示。已知 ,下列说法错误的是
,下列说法错误的是

 NaB溶液中滴入等浓度的HA溶液,所得溶液中
NaB溶液中滴入等浓度的HA溶液,所得溶液中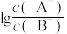 与
与 的关系如图所示。已知
的关系如图所示。已知 ,下列说法错误的是
,下列说法错误的是
A. |
B.与 时相比, 时相比,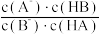 的值在 的值在 时更小 时更小 |
| C.滴加过程中水的电离程度在减小 |
D.滴入20mL HA溶液离子浓度存在关系: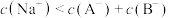 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
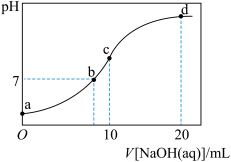
【推荐2】用0.1 mol/L NaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol/L HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法正确的是
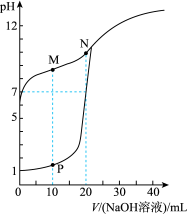

| A.M点c(HX)<c(X-) |
| B.M点c(Na+)>c(OH-) |
| C.P点c(Cl-)=0.05 mol/L |
| D.N点c(Na+)>c(X-) >c(OH-) >c(H+)>c(HX) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示。下列说法正确的是
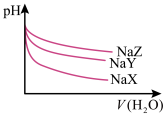

| A.在上述三种盐原溶液中,水的电离度大小是NaX>NaY>NaZ |
| B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z-)=c(Y-)=c(X-) |
| C.在上述NaX和NaY的混合液中存在c(HX)/c(X-)=c(HY)/c(Y-) |
| D.在0.2mol·L-1 NaX溶液中加入等体积0.1mol·L-1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-) |
您最近半年使用:0次

 <1
<1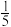 mol·L-1
mol·L-1 )+2c(NH3·H2O)
)+2c(NH3·H2O)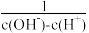 <15
<15

