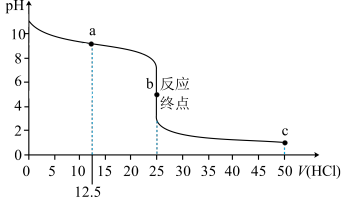
常温下,向浓度均为0.1 mol·L-1、体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是

| A.N点:c(Na+)=c(Y-)+c(HY) |
| B.M点:c(X-)>c(Na+) |
| C.滴至pH=7时,消耗NaOH溶液的体积:HX>HY |
| D.滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY |
2018·福建泉州·一模 查看更多[7]
福建省泉州市2018届高三毕业班3月质量检查理综化学试题福建省莆田市第六中学2019届高三上学期9月月考化学试题(已下线)2019年10月12日《每日一题》2020年高考一轮复习——周末培优(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
更新时间:2018-03-15 16:19:53
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】实验测定某硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)样品纯度的过程为:称取1.5000 g样品,配成100 mL溶液。取0.01mol ·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量的KI。充分反应后,以淀粉作指示剂,用硫代硫酸钠溶液滴定产生的I2,终点时消耗溶液20.00 mL。样品中所含硫代硫酸钠晶体的质量分数为(杂质不参与反应,反应过程中的物质转化关系为K2Cr2O7 I2
I2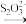 S4O
S4O )
)
 I2
I2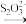 S4O
S4O )
)| A.99.20% | B.96.72% | C.94.24% | D.91.76% |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】按一定的速率用0.10
 溶液滴定10.0
溶液滴定10.0 0.10
0.10
 溶液,溶液
溶液,溶液 和温度随
和温度随 的变化曲线如图所示。下列说法正确的是
的变化曲线如图所示。下列说法正确的是


 溶液滴定10.0
溶液滴定10.0 0.10
0.10
 溶液,溶液
溶液,溶液 和温度随
和温度随 的变化曲线如图所示。下列说法正确的是
的变化曲线如图所示。下列说法正确的是
| A.滴定分析时,X点可用甲基橙、Z点可用酚酞作指示剂指示滴定终点 |
B.当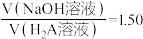 时溶液的 时溶液的 ,且溶液中 ,且溶液中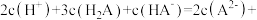 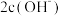 |
C.25℃时, 的电离常数 的电离常数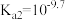 |
D.从W至Z点,Z点水的电离程度和 都最大 都最大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】酸碱中和滴定是化学中重要的定量实验,准确量取 25.00 mL 某待测浓度的盐酸于锥形瓶中,用0.100 0 mol/L 的NaOH 标准溶液滴定。下列说法正确的是
| A.锥形瓶用蒸馏水洗涤以后,再用待测液进行润洗 |
| B.使用酚酞为指示剂,当锥形瓶中的溶液由红色变为无色时停止滴定 |
| C.盛NaOH 标准溶液的滴定管尖嘴部分有气泡未排出就开始滴定,到达滴定终点时气泡消失,则导致测定结果偏高 |
| D.实验结束,某同学记录的氢氧化钠溶液的体积为 21.6mL |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】室温下,用0.1000mol/LNaOH溶液滴定20.00mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示。下列说法正确的是
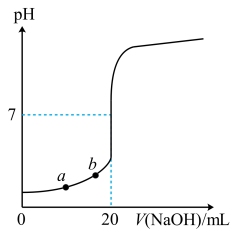

| A.水的电离程度:a<b |
| B.盐酸的物质的量浓度为0.01mol/L |
| C.指示剂刚变色时,说明盐酸与NaOH恰好完全反应 |
| D.当滴加NaOH溶液30.00mL时(忽略反应前后体积变化),该混合液的pH=11.3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】在25mL 0.1mol·L-1 NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
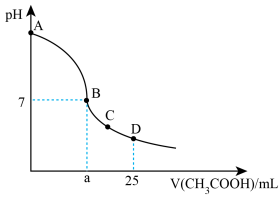

| A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| C.在C点,c(Na+)>c(CH3COO-) >c(H+)>c(OH-) |
| D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| C.NaCN中通入少量CO2发生的化学反应为:NaCN+CO2+H2O=HCN+NaHCO3 |
D.稀释HCN溶液过程中, 减小 减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】相同温度下,三种酸在一定物质的量浓度下的电离度如表所示,下列说法正确的是
| 酸 | HA | HB | HD | ||
| 浓度/mol∙L-1 | 1 | 0.1 | 0.5 | 0.9 | 1 |
| 电离度/% | 0.3 | 0.3 | 0.15 | 0.1 | 10 |
| A.HD是强酸 |
| B.酸性:HB<HA<HD |
| C.在相同温度下,HA酸浓度越大其电离度越小因而溶液酸性越弱 |
| D.由表可知在相同温度下,弱酸HB浓度越小其电离平衡常数越大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列离子浓度的关系正确的是
| A.0.1mol·L-1K2S溶液中:c(H+)+c(HS-)+2c(H2S)=c(OH-) |
B.0.1mol·L-1NaHCO3溶液中:c( )+2c( )+2c( )+c(H2CO3)=c(Na+) )+c(H2CO3)=c(Na+) |
| C.等物质的量的CH3COONa和盐酸的混合溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
D.物质的量浓度相等的NH4Cl溶液、CH3COONH4溶液和NH4HSO4溶液中c( )依次增大 )依次增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
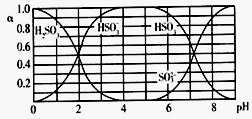

| A.溶液的pH=5时,硫元素的主要存在形式为HSO3- |
| B.当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) |
C.向pH=8的上述溶液中滴加少量澄清石灰水,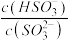 的值增大 的值增大 |
| D.向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
您最近一年使用:0次

 的平衡,下列叙述一定正确的是
的平衡,下列叙述一定正确的是 减小
减小 降低
降低 ,
,