常温,将VamL pH=3的盐酸溶液与VbmL pH=ll的氨水溶液混合。下列说法正确的是
| A.若Va=Vb,则混合后溶液pH=7 |
| B.若Va>Vb,则混合后溶液pH一定小于7 |
| C.若Va=Vb,则盐酸与氨水恰好完全中和 |
| D.若Va=Vb,混合后溶液中微粒浓度的关系可能为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
2011·四川宜宾·二模 查看更多[1]
(已下线)2011届四川省宜宾市高中高三第二次诊断性测试(理综)化学部分
更新时间:2016-12-09 01:40:04
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列叙述正确的是( )
| A.0.1mol·L-1氨水中,c(OH-)=c(NH4+) |
| B.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| C.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是
| A.取等体积的两种酸溶液分别进行稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n |
| B.取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 |
| C.取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多 |
| D.两种酸溶液中c(CH3COO-)=c(Cl-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】温度相同、浓度均为0.1mol•L-1的 ①(NH4)2SO4 ②NH3·H2O ③NH4HSO4 ④NH4NO3 ⑤(NH4)2CO3 ⑥NH4Fe(SO4)2 溶液中的c(NH4+)由大到小的顺序是( )
| A.①⑤③⑥④② | B.⑤①③④②⑥ |
| C.③②①⑥④⑤ | D.⑤①②⑥④③ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,用0.10mol/L的盐酸分别滴定20.00mL浓度均为0.10mol/L的两种一元弱酸的钾盐(KX、KY)溶液,滴定曲线如图所示。下列说法错误的是
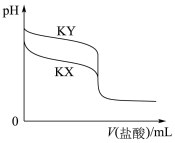

| A.电离平衡常数:K(HX)>K(HY) |
| B.KY溶液中:c(K+)>c(Y-)>c(OH-)>c(H+) |
| C.当pH=7时,两溶液中:c(X-)=c(Y-) |
| D.分别滴加20.00mL盐酸后,将两种溶液混合:c(X-)+c(Y-)=c(H+)-c(OH-) |
您最近一年使用:0次

 的氨水,下列判断正确的是
的氨水,下列判断正确的是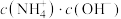 变大
变大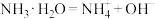
 溶液反应的离子方程式为
溶液反应的离子方程式为
 溶液恰好完全中和
溶液恰好完全中和
 )=0.01mol·L-1
)=0.01mol·L-1 )+2c(
)+2c( )+2c(
)+2c(

