已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH 的关系如图所示。下列说法不正确的是
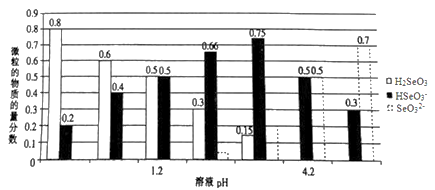

| A.将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水可配得pH为4.2的混合液 |
| B.pH=l.2的溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SeO3) |
| C.常温下,亚硒酸的电离平衡常数K2=10-4.2 |
| D.向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大 |
更新时间:2018-05-06 11:05:40
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】乙醇胺为一元弱碱(25℃时,电离常数Kb=4.0×10-5)。其电离方程式为HOCH2CH2NH2+H2O⇌HOCH2CH2NH +OH-。用0.1mol/L的盐酸滴定20mL0.1mol/L乙醇胺溶液,温度恒定在25℃时,滴定过程中由水电离出的c(H+)与滴加盐酸体积的关系如图所示(已知:lg5=0.7)。下列说法中错误的是
+OH-。用0.1mol/L的盐酸滴定20mL0.1mol/L乙醇胺溶液,温度恒定在25℃时,滴定过程中由水电离出的c(H+)与滴加盐酸体积的关系如图所示(已知:lg5=0.7)。下列说法中错误的是
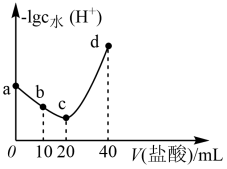
 +OH-。用0.1mol/L的盐酸滴定20mL0.1mol/L乙醇胺溶液,温度恒定在25℃时,滴定过程中由水电离出的c(H+)与滴加盐酸体积的关系如图所示(已知:lg5=0.7)。下列说法中错误的是
+OH-。用0.1mol/L的盐酸滴定20mL0.1mol/L乙醇胺溶液,温度恒定在25℃时,滴定过程中由水电离出的c(H+)与滴加盐酸体积的关系如图所示(已知:lg5=0.7)。下列说法中错误的是
| A.a点溶液的pH约为11.3 |
B.b点溶液中:c(HOCH2CH2NH2)>c(Cl-)>c(HOCH2CH2NH ) ) |
| C.c点两侧溶液均存在由水电离出的c(H+)=1×10-7mol/L |
D.d点溶液中:c(Cl-)=2c(HOCH2CH2NH2)+2c(HOCH2CH2NH ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列是25 ℃时某些弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A.相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B.向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5 |
| C.次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32 -+2HClO |
| D.pH相同的CH3COONa溶液、NaClO溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3) >c(NaClO ) >c(NaOH ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】 时,向
时,向 二元弱酸(简写成
二元弱酸(简写成 )溶液中加入
)溶液中加入 固体或通入
固体或通入 气体,调节溶液
气体,调节溶液 ,混合溶液的
,混合溶液的 与
与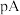 或
或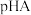 或
或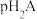 的关系如图所示(忽略溶液体积变化和
的关系如图所示(忽略溶液体积变化和 的挥发)。下列有关叙述错误的是(已知:
的挥发)。下列有关叙述错误的是(已知: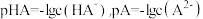 )
)
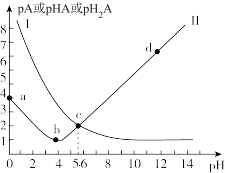
 时,向
时,向 二元弱酸(简写成
二元弱酸(简写成 )溶液中加入
)溶液中加入 固体或通入
固体或通入 气体,调节溶液
气体,调节溶液 ,混合溶液的
,混合溶液的 与
与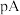 或
或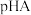 或
或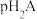 的关系如图所示(忽略溶液体积变化和
的关系如图所示(忽略溶液体积变化和 的挥发)。下列有关叙述错误的是(已知:
的挥发)。下列有关叙述错误的是(已知: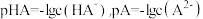 )
)
A.曲线Ⅰ、Ⅱ分别代表的微粒为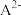 和 和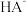 |
B. |
| C.从a点到c点,水的电离程度先增大后减小 |
D.b点有关微粒浓度大小关系为 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】某化学研究学习小组对高二所学部分内容作了归纳总结(均指常温下),现摘录6条,其中错误的有
①物质的量的浓度相同的2种盐,若pH:NaX>NaY,则HX>HY
②已知CH3COOH电离平衡常数为Ka,CH3COO-水解常数为Kh,水的离子积为KW,则三者关系为:Ka·Kh = KW
③pH=7的NH3·H2O与NH4Cl的混合溶液中:c(Cl-) = c( )
)
④0.1 mol·L-1的硫酸铵溶液中:c( )>c(
)>c( )>c(H+)
)>c(H+)
⑤冰晶胞中水分子的空间排列方式与干冰晶胞类似
⑥1mol [Cu(NH3)4]2+中含有σ键的数目为12NA
①物质的量的浓度相同的2种盐,若pH:NaX>NaY,则HX>HY
②已知CH3COOH电离平衡常数为Ka,CH3COO-水解常数为Kh,水的离子积为KW,则三者关系为:Ka·Kh = KW
③pH=7的NH3·H2O与NH4Cl的混合溶液中:c(Cl-) = c(
 )
)④0.1 mol·L-1的硫酸铵溶液中:c(
 )>c(
)>c( )>c(H+)
)>c(H+)⑤冰晶胞中水分子的空间排列方式与干冰晶胞类似
⑥1mol [Cu(NH3)4]2+中含有σ键的数目为12NA
| A.①⑤⑥ | B.①③⑤ | C.②④⑥ | D.③④⑥ |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】若定义pC是溶液中微粒物质的量浓度的负对数。常温下,一定浓度的某酸(H2A)的水溶液中pC(H2A)、pC(HA-)、pC(A2-)随着溶液pH的变化曲线如图所示。
下列说法一定正确的是( )

下列说法一定正确的是( )

| A.pH=3时,c(H2A)=c(A2-)>c(HA-) |
| B.c(H2A)+c(HA-)+c(A2-)是定值 |
| C.HA-的水解平衡常数为10-12.7 |
| D.任何时候,溶液中都存在:c(H+)=c(OH-)+c(HA-)+2c(A2-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】以酚酞为指示剂,用0.1000mol•L-1的NaOH溶液滴定pH=4的未知浓度H2A溶液。溶液中,pH、分布系数δ变化关系如图所示。 ,10-1.7=0.02]
,10-1.7=0.02]
下列叙述不正确的是
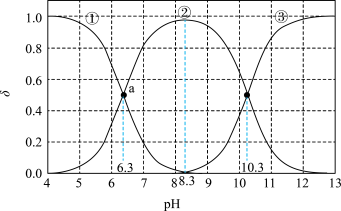
 ,10-1.7=0.02]
,10-1.7=0.02]下列叙述不正确的是
| A.曲线①代表δ(H2A),曲线②代表δ(HA-) | B.H2A溶液的浓度约为0.02000mol•L-1 |
| C.NaHA溶液显碱性 | D.a点溶液中:c(Na+)>2c(A2-)+c(H2A) |
您最近一年使用:0次



