常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中不正确的是( )
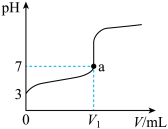

| A.上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1 |
| B.图中V1 <20 mL |
| C.a点对应的溶液中:c (CH3COO-)=c (Na+) |
| D.当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-) |
17-18高二下·广东·期末 查看更多[8]
更新时间:2019-07-04 20:24:57
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】常温下,用0.1mol·L-1盐酸滴定25mL 0.1mol·L-1BOH溶液的过程中,溶液pH的变化曲线如图1所示,用0.1mol·L-1NaOH溶液滴定25mL0.1mol·L-1HA溶液的过程中溶液pH的变化曲线如图2所示(忽略溶液体积变化)。下列说法不正确的是


| A.常温下,若用等浓度的HA溶液滴定该BOH溶液,所得到的图象与图1相同 |
| B.若将c点所示溶液与e点所示溶液混合,混合后溶液中存在c(H+)=c(OH-)+c(BOH) |
| C.V1<25,且b、d点所示溶液中,水的电离程度为b>d |
| D.a点所示溶液中粒子浓度大小关系:c(OH-)>c(BOH) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是
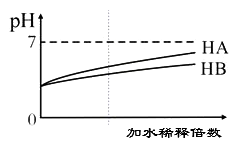

| A.向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大 |
| B.用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性 |
| C.氨水与HA溶液混合后的溶液中可能存在:c(NH4+ )>c(A+)>c(H+)>c(OH-) |
| D.完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】用0.1mol·L-1NaOH溶液滴定20mI。0.1mol·1-1H2A溶液,所得滴定曲线如图所示(已知:①H2A=H++HA-,HA- H++A2-;②HA-的电离平衡常数Ka= 10-5;③忽略混合后溶液的体积变化)。下列有关叙述不正确的是
H++A2-;②HA-的电离平衡常数Ka= 10-5;③忽略混合后溶液的体积变化)。下列有关叙述不正确的是

 H++A2-;②HA-的电离平衡常数Ka= 10-5;③忽略混合后溶液的体积变化)。下列有关叙述不正确的是
H++A2-;②HA-的电离平衡常数Ka= 10-5;③忽略混合后溶液的体积变化)。下列有关叙述不正确的是
| A.a点溶液中:c(A2-) =c(H+) -c(OH- ) |
| B.b点溶液中:3c(A2-) >c(Na+ ) 。 |
| C.c点时,消耗的NaOH溶液的体积小于30mL |
| D.d点溶液中;c(Na+) =2c(A2-) +2c(HA-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温下,用0.1000mol/L NaOH溶液滴定 溶液所得滴定曲线如图所示。下列说法中错误的是
溶液所得滴定曲线如图所示。下列说法中错误的是

 溶液所得滴定曲线如图所示。下列说法中错误的是
溶液所得滴定曲线如图所示。下列说法中错误的是
| A.滴定时应选择酚酞作指示剂 |
B.点②所示溶液中: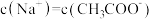 |
| C.点①②③所示溶液中,水的电离程度最大的是点① |
D.点③所示溶液中, |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】若用AG表示溶液的酸度,其表达式为AG= 室温下,实验室里用0.1mol/L的盐酸滴定10mL0.1mol/LMOH溶液,滴定曲线如图所示。下列说法正确的是
室温下,实验室里用0.1mol/L的盐酸滴定10mL0.1mol/LMOH溶液,滴定曲线如图所示。下列说法正确的是
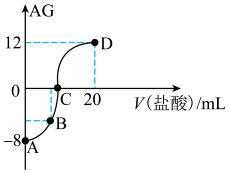
 室温下,实验室里用0.1mol/L的盐酸滴定10mL0.1mol/LMOH溶液,滴定曲线如图所示。下列说法正确的是
室温下,实验室里用0.1mol/L的盐酸滴定10mL0.1mol/LMOH溶液,滴定曲线如图所示。下列说法正确的是
| A.该滴定过程可选择酚酞作为指示剂 |
| B.若B点加入的盐酸体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-) |
| C.水的电离程度:A<D<C |
| D.MOH的电离平衡常数为1×10-17 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】通过佛尔哈德法可以测定三氯氧磷(POCl3)样品中Cl元素的含量,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
下列说法正确的是
Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
下列说法正确的是
| A.滴定选用的指示剂为甲基橙 |
B.本次实验测得Cl元素的质量分数为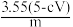 % % |
| C.硝基苯的作用为防止沉淀被氧化 |
| D.若取消步骤Ⅲ,测定结果偏大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是:
| A.0.1mol•L-1 CH3COONa溶液与0.1mol•L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) |
| B.0.1mol•L-1 NH4Cl溶液与0.1mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| C.0.1mol•L-1 Na2CO3溶液与0.1mol•L-1 NaHCO3溶液等体积混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.1mol•L-1 Na2C2O4溶液与0.1mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸): 2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,将0.2mol·L-1NH4Cl溶液与0.2mol·L-1NaHA溶液等体积混合后(忽略体积变化),所得混合溶液的pH为7.8。当向混合液中加入盐酸或NaOH溶液时,溶液中的粒子分布系数(δ)随溶液pH的变化如图所示(无NH3逸出)。已知δ(x)=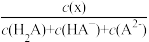 或δ(x)=
或δ(x)=  ;a、b、c、d、e分别表示NH
;a、b、c、d、e分别表示NH 、NH3·H2O、HA-、A2-、H2A中的一种。下列有关描述正确的是
、NH3·H2O、HA-、A2-、H2A中的一种。下列有关描述正确的是

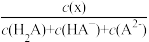 或δ(x)=
或δ(x)=  ;a、b、c、d、e分别表示NH
;a、b、c、d、e分别表示NH 、NH3·H2O、HA-、A2-、H2A中的一种。下列有关描述正确的是
、NH3·H2O、HA-、A2-、H2A中的一种。下列有关描述正确的是
| A.常温下,Kb(NH3·H2O)<Ka1(H2A) |
| B.由图可知,曲线a表示的是H2A,曲线e表示的是NH3·H2O |
C.常温下,向该混合溶液中逐滴加入NaOH溶液时,c(NH )、c(HA-)均逐渐减小 )、c(HA-)均逐渐减小 |
| D.常温下,向该混合溶液中逐滴加入HCl溶液至pH=7时:c(Na+)+c(H2A)=c(Cl-)+c(A2-)+c(NH3·H2O) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】为测定某二元弱酸H2A与NaOH溶液反应过程中溶液pH与粒子关系,在25℃时进行实验,向H2A溶液中滴加NaOH溶液,混合溶液中lgX[X表示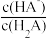 或
或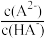 ]随溶液pH的变化关系如图所示。下列说法正确的是
]随溶液pH的变化关系如图所示。下列说法正确的是

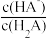 或
或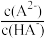 ]随溶液pH的变化关系如图所示。下列说法正确的是
]随溶液pH的变化关系如图所示。下列说法正确的是
A.直线II中X表示的是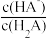 |
| B.当pH=3.81时,溶液中c(HA-):c(H2A)=10:1 |
| C.0.1 mol·L-1 NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-) |
| D.当pH=6.91时,对应的溶液中,3c(A2-)=c(Na+)+c(H+)-c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,向20.00mL 0.1000mol•L-1的CH3COOH溶液中滴加0.1000mol•L-1的NaOH溶液,溶液中,lg 随pH的变化关系如图所示(取lg5=0.7).下列说法正确的是
随pH的变化关系如图所示(取lg5=0.7).下列说法正确的是

 随pH的变化关系如图所示(取lg5=0.7).下列说法正确的是
随pH的变化关系如图所示(取lg5=0.7).下列说法正确的是
| A.常温下,CH3COOH的电离常数为10-4.76 |
| B.当溶液的pH=7时,消耗NaOH溶液20.00mL |
| C.溶液中水的电离程度大小:a>b>c |
| D.c点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.在0.1mol⋅L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1mol⋅L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) |
| C.向0.2mol⋅L-1NaHCO3溶液中加入等体积0.1mol⋅L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol⋅L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
您最近一年使用:0次



