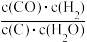可逆反应mA(g)+ nB pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )
pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )
 pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )
pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )| A.若增加B的量,平衡体系颜色加深,说明B必是气体 |
| B.增大压强,平衡不移动,说明m+n一定等于p+q |
| C.升高温度,A的转化率减小,说明正反应是吸热反应 |
| D.若B是气体,增大A的量,A、B的转化率都增大 |
10-11高三上·湖南郴州·阶段练习 查看更多[11]
(已下线)2011届湖南嘉禾一中高三1月份高考押题化学试卷(已下线)2014届高考化学二轮复习提分训练 专题6化学反应速率和化学平衡练习卷(已下线)2014届高考化学三轮复习排查 专题6化学反应速率和化学平衡练习卷(已下线)2013-2014江苏省盐城中学第二学期期中考试高二化学试卷(已下线)2014届江苏省盐城中学第二学期期中考试高二化学试卷2016-2017学年江西省玉山一中高二上第一次月考化学卷四川省成都七中实验学校2018-2019学年高二上学期10月月考化学试题黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素
更新时间:2019-10-11 11:37:33
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列事实中,能用勒夏特列原理解释的是
| A.经粉碎的硫黄燃烧得较快、较完全 |
| B.压缩氢气与碘蒸气的平衡混合体系,气体颜色变深 |
| C.夏天打开冰镇啤酒,把啤酒倒入玻璃杯中,杯中立即泛起大量泡沫 |
D.500℃左右比常温下更有利于 和 和 反应生成 反应生成 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】已知 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: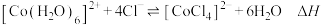 ,用该溶液做实验,溶液的颜色变化如图,以下结论和解释正确的是
,用该溶液做实验,溶液的颜色变化如图,以下结论和解释正确的是

 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: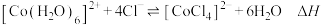 ,用该溶液做实验,溶液的颜色变化如图,以下结论和解释正确的是
,用该溶液做实验,溶液的颜色变化如图,以下结论和解释正确的是
A.等物质的量的 和 和 中 中 键数之比为 键数之比为 |
B.由实验①可推知 |
C. 中配体为 中配体为 ,它提供空轨道,配位数为6 ,它提供空轨道,配位数为6 |
D.由实验③可知配离子的稳定性: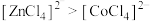 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列实验操作不能达到实验目的的是
| 实验目的 | 实验操作 | |
| A | 验证醋酸是弱酸 | 向醋酸钠溶液中滴入2滴酚酞溶液 |
| B | 由ZnCl2溶液制备无水ZnCl2 | 将ZnCl2溶液加热蒸干 |
| C | 探究温度对化学平衡的影响 | 将两个封装NO2和N2O4混合气体的圆底烧瓶,分别浸泡在热水和冷水中 |
| D | 实验室配制FeCl3溶液 | 将FeCl3固体溶于少量浓盐酸中,再加水稀释 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】甲醇是重要的化工原料,利用CO2与H2反应可以合成甲醇,反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0。下列说法正确的是
CH3OH(g)+H2O(g) △H<0。下列说法正确的是
 CH3OH(g)+H2O(g) △H<0。下列说法正确的是
CH3OH(g)+H2O(g) △H<0。下列说法正确的是| A.因有气体生成,故该反应的△S>0 |
| B.升高温度,平衡逆向移动,正反应速率减慢 |
| C.恒温恒压条件下,加入催化剂,平衡常数增大 |
| D.恒温条件下,增大压强,可提高CO2的平衡转化率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】COCl2(g) CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①恒容通入惰性气体;②恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①恒容通入惰性气体;②恒压通入惰性气体,能提高COCl2转化率的是
 CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①恒容通入惰性气体;②恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①恒容通入惰性气体;②恒压通入惰性气体,能提高COCl2转化率的是| A.①② | B.① | C.② | D.都不能 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列可逆反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2(g) N2O4(g) ∆H<0 N2O4(g) ∆H<0 | B.H2(g)+ I2(g) 2HI(g) ∆H<0 2HI(g) ∆H<0 |
C.3O2(g) 2O3(g) ∆H>0 2O3(g) ∆H>0 | D.C(s)+CO2(g) 2CO(g) ∆H>0 2CO(g) ∆H>0 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列事实不能用化学平衡移动原理解释的是( )
| A.高压比常压有利于合成NH3的反应 |
| B.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| C.将装有NO2气体并密封的圆底烧瓶放入热水中,气体颜色变深 |
| D.常温时,AgCl在饱和氯化钠溶液中的溶解度小于在水中的溶解度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列事实不能用勒夏特列原理解释的是
A.用排饱和食盐水的方法收集 |
| B.在一定条件下,氢气和碘蒸气反应达到平衡后,加压,混合气体颜色加深 |
C.反应 (正反应为放热反应),达平衡后,升高温度体系颜色变深 (正反应为放热反应),达平衡后,升高温度体系颜色变深 |
| D.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率 |
您最近一年使用:0次

 2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2),平衡逆移,氢气的平衡转化率均减小
2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2),平衡逆移,氢气的平衡转化率均减小
 CO(g)+H2(g) ΔH>0,下列有关说法正确的是
CO(g)+H2(g) ΔH>0,下列有关说法正确的是