(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
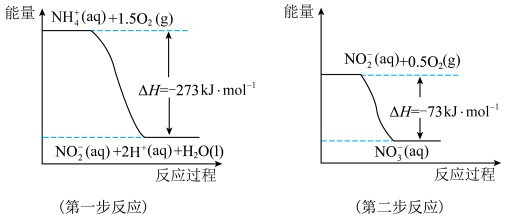
1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________ 。
(2)工业上常用CO和H2合成甲醇,反应方程式为:CO(g) +2H2(g) CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。
CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。

①当起始n(H2)/n(CO)=2,经过5 min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5 min内平均反应速率v(H2)=________ 。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH(g),达新平衡时H2的转化率将________ (填“增大”“减小”或“不变”)。
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____ 点(填“D”“E”或“F”)。
③由图2可知该反应的ΔH________ 0(填“>”“<”或“=”),理由是______________ ;当压强为p2时,在y点:v正________ v逆(填“>”“<”或“=”)。

1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是
(2)工业上常用CO和H2合成甲醇,反应方程式为:CO(g) +2H2(g)
 CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。
CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。
①当起始n(H2)/n(CO)=2,经过5 min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5 min内平均反应速率v(H2)=
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
③由图2可知该反应的ΔH
更新时间:2019-12-15 11:12:29
|
相似题推荐
【推荐1】研究表明:丰富的CO2可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:第一步:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.3kJ/mol;第二步:2CO(g)+4H2(g)
CO(g)+H2O(g) △H=+41.3kJ/mol;第二步:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H=-210.5kJ/mol。
C2H4(g)+2H2O(g) △H=-210.5kJ/mol。
①加氢合成乙烯的热化学方程式为________ 。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是_______ (填字母)。
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1mol CO2和2.75molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
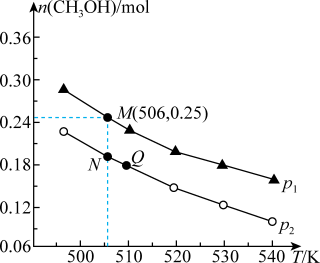
①能判断该反应达到化学平衡状态的是________ (填字母)。
a.c(H2):c(CH3OH)=3:1 b.容器内氢气的体积分数不再改变
c.容器内气体的密度不再改变 d.容器内压强不再改变
②上述反应的△H_______ 0(填“>”或“<”),图中压强p1_______ p2(填“>”或“<”)。
③经测定知Q点时容器的压强是反应前压强的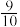 ,则Q点H2的转化率为
,则Q点H2的转化率为________ 。
④N点时,该反应的平衡常数K=______ (计算结果保留两位小数)。
(3)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为p0,仅进行反应Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①充分反应达到平衡后,若CO2转化率为x,则容器的压强与起始压强之比为_____ (用x表示)。
②若经过30h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为_____ (保留三位有效数字);
③平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数Kp为_____ (用p0表示,并化简)。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:第一步:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.3kJ/mol;第二步:2CO(g)+4H2(g)
CO(g)+H2O(g) △H=+41.3kJ/mol;第二步:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H=-210.5kJ/mol。
C2H4(g)+2H2O(g) △H=-210.5kJ/mol。①加氢合成乙烯的热化学方程式为
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1mol CO2和2.75molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
①能判断该反应达到化学平衡状态的是
a.c(H2):c(CH3OH)=3:1 b.容器内氢气的体积分数不再改变
c.容器内气体的密度不再改变 d.容器内压强不再改变
②上述反应的△H
③经测定知Q点时容器的压强是反应前压强的
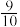 ,则Q点H2的转化率为
,则Q点H2的转化率为④N点时,该反应的平衡常数K=
(3)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为p0,仅进行反应Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)①充分反应达到平衡后,若CO2转化率为x,则容器的压强与起始压强之比为
②若经过30h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为
③平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数Kp为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
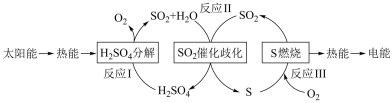
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为________ 。
②对于反应Ⅱ,将投料比【n(SO2):n(H2O)】为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___

A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4在平衡体系中物质的量分数
C.其他条件相同时,投料比【n(SO2):n(H2O)】改变为 2:1,可提高 SO2的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) ⇌ H2(g) + I2(g)
反应C:2H2SO4(g) ⇌ 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
归纳出分离 H2的次数对 HI 转化率的影响________ 。第 2 次平衡时 I2的物质的量为 n(I2)=_____ mol;
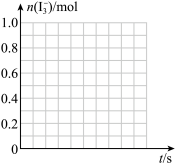
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I‑(aq)⇌ (aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中 的物质的量 n( I3- )随反应时间 t 变化的曲线图
的物质的量 n( I3- )随反应时间 t 变化的曲线图____ 。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:

①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为
②对于反应Ⅱ,将投料比【n(SO2):n(H2O)】为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是

A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4在平衡体系中物质的量分数
C.其他条件相同时,投料比【n(SO2):n(H2O)】改变为 2:1,可提高 SO2的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) ⇌ H2(g) + I2(g)
反应C:2H2SO4(g) ⇌ 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
| 达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
| n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2的次数对 HI 转化率的影响
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I‑(aq)⇌
 (aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中 的物质的量 n( I3- )随反应时间 t 变化的曲线图
的物质的量 n( I3- )随反应时间 t 变化的曲线图
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。请回答:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g) ΔH1=+3351 kJ·molˉ1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318 kJ·molˉ1
则反应Al2O3(s)+ 3C(s)+ N2(g)=3CO(g)+ 2AlN(s)的ΔH=_______ ,该反应自发进行的条件是:_______ 。
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应ⅠCO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4
反应ⅡCO2(g)+H2(g) CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5

①下列说法不正确的是_______ 。
a.ΔH 4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数K=_______ (用a、V表示)。
③350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。___________

(1)已知:2Al2O3(s)=4Al(g)+3O2(g) ΔH1=+3351 kJ·molˉ1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318 kJ·molˉ1
则反应Al2O3(s)+ 3C(s)+ N2(g)=3CO(g)+ 2AlN(s)的ΔH=
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应ⅠCO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4反应ⅡCO2(g)+H2(g)
 CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
①下列说法不正确的是
a.ΔH 4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数K=
③350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】温室气体让地球“发烧”,倡导低碳生活,是-种可持续发展的环保责任,将CO2应用于生产中实现其综合利用是目前的研究热点。回答下列问题:
(1)通过使用不同的新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3 )也有广泛的应用。
反应I:CO2(g) +3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1
反应II:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-24.52 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.52 kJ·mol-1
反应III :CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+41.17 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41.17 kJ·mol-1
则2CO2(g) +6H2(g) CH3OCH3(g)+ 3H2O(g) ΔH=
CH3OCH3(g)+ 3H2O(g) ΔH=_____________ kJ·mol-1。
(2)一定条件下,CO2(g) +3H2(g) CH3OH(g) + H2O(g)的反应历程如图1所示。该反应的反应速率由第
CH3OH(g) + H2O(g)的反应历程如图1所示。该反应的反应速率由第_____________________ (填“1”或“2”)步决定。
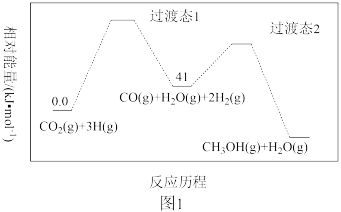
(3)向2 L恒容密闭容器中充入1 mol CO2和3 mol H2,在一定条件下,仅发生上述反应I;在甲、乙两种不同催化剂的作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度的变化如图2所示。

①相同温度下,催化剂效果更好的是_____________ (填“甲”或“乙”);T4°C 下,甲醇的平均反应速率为_______ mol·L-1·min-1。
②T2°C和T5°C下,平衡常数:K2___ (填“>”、“<”或“=”)K5。
③T5°C下,反应开始时容器中的总压为p0 MPa,该温度下反应的平衡常数Kp=________ (只列出计算式,不必化简,气体分压=气体总压 ×气体的物质的量分数)。
(4)已知CH3OH的选择性为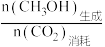 ×100%。其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图3、4所示。
×100%。其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图3、4所示。
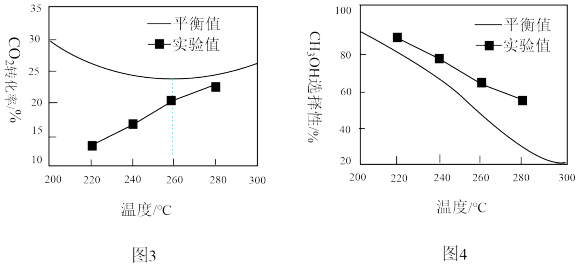
①由图3可知,实验中反应均未达到化学平衡状态的依据是______________________ 。
②温度高于260 °C时,CO2的平衡转化率呈上升变化的原因是__________ 。
③由图4可知,温度相同时CH3OH选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是_______ 。
(1)通过使用不同的新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3 )也有广泛的应用。
反应I:CO2(g) +3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1反应II:2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-24.52 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.52 kJ·mol-1 反应III :CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3=+41.17 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41.17 kJ·mol-1则2CO2(g) +6H2(g)
 CH3OCH3(g)+ 3H2O(g) ΔH=
CH3OCH3(g)+ 3H2O(g) ΔH=(2)一定条件下,CO2(g) +3H2(g)
 CH3OH(g) + H2O(g)的反应历程如图1所示。该反应的反应速率由第
CH3OH(g) + H2O(g)的反应历程如图1所示。该反应的反应速率由第
(3)向2 L恒容密闭容器中充入1 mol CO2和3 mol H2,在一定条件下,仅发生上述反应I;在甲、乙两种不同催化剂的作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度的变化如图2所示。

①相同温度下,催化剂效果更好的是
②T2°C和T5°C下,平衡常数:K2
③T5°C下,反应开始时容器中的总压为p0 MPa,该温度下反应的平衡常数Kp=
(4)已知CH3OH的选择性为
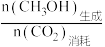 ×100%。其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图3、4所示。
×100%。其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图3、4所示。
①由图3可知,实验中反应均未达到化学平衡状态的依据是
②温度高于260 °C时,CO2的平衡转化率呈上升变化的原因是
③由图4可知,温度相同时CH3OH选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】温室气体让地球“发烧”,倡导低碳生活,是一种可持续发展的环保责任,通过化学、生物等方法将其转化为更具附加值的能源、化工原料和精细化学品成为目前研究热点。回答下列问题:
(1)通过使用不同的新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应Ⅰ: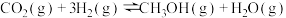
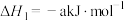
反应Ⅱ: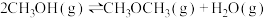
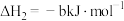
反应Ⅲ: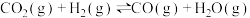

则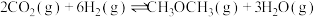

___________ 。
(2)一定条件下,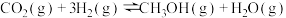 的反应历程如图1所示。该反应的块反应速率由第
的反应历程如图1所示。该反应的块反应速率由第___________ (填“1”或“2”)步决定。

(3)向2L恒容密闭容器中充入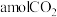 和
和 ,在一定条件下,仅发生上述反应Ⅰ;在甲、乙两种不同催化剂的作用下,反应时间均为
,在一定条件下,仅发生上述反应Ⅰ;在甲、乙两种不同催化剂的作用下,反应时间均为 时,测得甲醇的物质的量分数随温度的变化如图2所示。
时,测得甲醇的物质的量分数随温度的变化如图2所示。

①相同温度下,催化剂效果更好的是___________ (填“甲”或“乙”); 下,甲醇的平均反应速率为
下,甲醇的平均反应速率为___________  。
。
② 和
和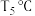 下,平衡常数:
下,平衡常数:
___________ (填“>”、“<”或“=”)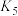 。
。
③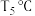 下,反应开始时容器中的总压为
下,反应开始时容器中的总压为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
___________ (只列出计算式,不必化简,气体分=气体总压×气体的物质的量分数)。
(4)已知 的选择性为
的选择性为 。其他条件相同时,反应温度对
。其他条件相同时,反应温度对 的转化率和
的转化率和 的选择性的影响如图3、4所示。
的选择性的影响如图3、4所示。

①由图3可知,实验中反应均未达到化学平衡状态的依据是___________ 。
②温度高于260℃时, 的平衡转化率呈上升变化的原因是
的平衡转化率呈上升变化的原因是___________ 。
③由图4可知,温度相同时 选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是___________ 。
(1)通过使用不同的新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应Ⅰ:
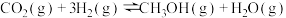
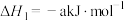
反应Ⅱ:
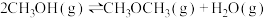
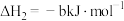
反应Ⅲ:
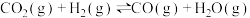

则
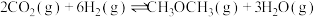

(2)一定条件下,
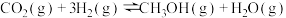 的反应历程如图1所示。该反应的块反应速率由第
的反应历程如图1所示。该反应的块反应速率由第
(3)向2L恒容密闭容器中充入
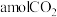 和
和 ,在一定条件下,仅发生上述反应Ⅰ;在甲、乙两种不同催化剂的作用下,反应时间均为
,在一定条件下,仅发生上述反应Ⅰ;在甲、乙两种不同催化剂的作用下,反应时间均为 时,测得甲醇的物质的量分数随温度的变化如图2所示。
时,测得甲醇的物质的量分数随温度的变化如图2所示。
①相同温度下,催化剂效果更好的是
 下,甲醇的平均反应速率为
下,甲醇的平均反应速率为 。
。②
 和
和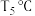 下,平衡常数:
下,平衡常数:
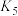 。
。③
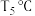 下,反应开始时容器中的总压为
下,反应开始时容器中的总压为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
(4)已知
 的选择性为
的选择性为 。其他条件相同时,反应温度对
。其他条件相同时,反应温度对 的转化率和
的转化率和 的选择性的影响如图3、4所示。
的选择性的影响如图3、4所示。
①由图3可知,实验中反应均未达到化学平衡状态的依据是
②温度高于260℃时,
 的平衡转化率呈上升变化的原因是
的平衡转化率呈上升变化的原因是③由图4可知,温度相同时
 选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】 催化加氢制甲醇(
催化加氢制甲醇( )是实现碳达峰、碳中和的途径之一,其反应可表示为
)是实现碳达峰、碳中和的途径之一,其反应可表示为
 。
。
(1)该反应分两步进行,反应过程能量变化如图所示,所有物质均为气态。
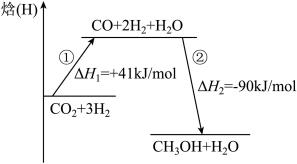
总反应
___________ 。第①步反应的热化学方程式为___________ 。
(2)用 和
和 合成甲醇有利于减少碳排放,其反应原理为
合成甲醇有利于减少碳排放,其反应原理为 。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入
。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入 和
和 的混合气体,分别在
的混合气体,分别在 、
、 温度下进行反应并达到平衡,反应过程中甲、乙两容器中
温度下进行反应并达到平衡,反应过程中甲、乙两容器中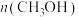 随时间的变化情况如下表:
随时间的变化情况如下表:
①两容器的温度
___________  。
。
②甲容器中,0~6min内用 表示的平均反应速率为
表示的平均反应速率为___________ 。
③甲容器 中反应达平衡时容器内气体压强与起始时容器内气体压强之比为
中反应达平衡时容器内气体压强与起始时容器内气体压强之比为___________ 。
④一定温度下,在一体积固定的密闭容器中投入一定量的 和
和 进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中 与
与 的物质的量之比为
的物质的量之比为
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗 ,同时生成
,同时生成
D. 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(3)捕碳 技术在降低温室气体排放中具有重要的作用。目前
技术在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

则 与
与 、
、 之间的关系是:
之间的关系是:
___________ 。
(4)甲醇燃料电池具有很多优点。
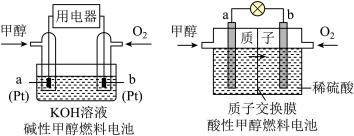
①碱性甲醇燃料电池中,电极a上发生的电极反应式为___________ 。
②酸性甲醇燃料电池中,电极b上发生的电极反应式为___________ 。
 催化加氢制甲醇(
催化加氢制甲醇( )是实现碳达峰、碳中和的途径之一,其反应可表示为
)是实现碳达峰、碳中和的途径之一,其反应可表示为
 。
。(1)该反应分两步进行,反应过程能量变化如图所示,所有物质均为气态。

总反应

(2)用
 和
和 合成甲醇有利于减少碳排放,其反应原理为
合成甲醇有利于减少碳排放,其反应原理为 。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入
。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入 和
和 的混合气体,分别在
的混合气体,分别在 、
、 温度下进行反应并达到平衡,反应过程中甲、乙两容器中
温度下进行反应并达到平衡,反应过程中甲、乙两容器中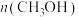 随时间的变化情况如下表:
随时间的变化情况如下表: | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器 | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器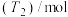 | 0 | 0.34 | 0.55 | 0.70 | 0.83 | 0.83 |

 。
。②甲容器中,0~6min内用
 表示的平均反应速率为
表示的平均反应速率为③甲容器
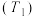 中反应达平衡时容器内气体压强与起始时容器内气体压强之比为
中反应达平衡时容器内气体压强与起始时容器内气体压强之比为④一定温度下,在一体积固定的密闭容器中投入一定量的
 和
和 进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中
 与
与 的物质的量之比为
的物质的量之比为
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗
 ,同时生成
,同时生成
D.
 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变E.混合气体的密度保持不变
(3)捕碳
 技术在降低温室气体排放中具有重要的作用。目前
技术在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


则
 与
与 、
、 之间的关系是:
之间的关系是:
(4)甲醇燃料电池具有很多优点。

①碱性甲醇燃料电池中,电极a上发生的电极反应式为
②酸性甲醇燃料电池中,电极b上发生的电极反应式为
您最近一年使用:0次
【推荐1】2022年6月5日10时44分,神舟十四号载人飞船搭载3名航天员在酒泉卫星发射中心成功起航,航天员乘组将在空间站组合体工作生活6个月,空间站的水气整合系统利用“萨巴蒂尔反应”,将CO2转化为CH4和水蒸气,配合O2生成系统可实现O2的再生。回答下列问题:
Ⅰ.萨巴蒂尔反应为: CO2(g)+ 4H2(g) CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
(1)常温常压下,已知:①H2和CH4的燃烧热(△H)分别为一285.5 kJ·mol-1和一890.0kJ·mol-1;
②H2O(g)=H2O(l) △H= -44.0kJ·mol-1,则△H1=_______ kJ·mol-1。
(2)研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“· ”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会_______ (填“放出热量”或“吸收热量”):反应历程中最小能垒(活化能)步骤的化学方程式为_______ 。

Ⅱ.实验证明CO2在一定条件下与H2O发生氧再生反应:CO2(g)+ 2H2O(g) CH4(g)+2O2(g) △H1= +802.3kJ · mol-1
CH4(g)+2O2(g) △H1= +802.3kJ · mol-1
(3)恒压P0条件下,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。

350℃时,用平衡分压代替平衡浓度表示A点的化学平衡常数Kp=_______ (填计 算结果)[气体分压(P分)=气体总压(p总) ×气体物质的量分数];为了提高CO2的转化率,除改变温度外,还可采取的措施为_______ 。
(4)氧再生反应可以通过酸性条件下半导体光催化转化实现:反应机理如图所示:

①光催化CO2转化为CH4时,其阴极的电极反应式为_______ 。
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到 400℃之间,CH4生成速率加快的原因是_______ 。
Ⅰ.萨巴蒂尔反应为: CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1(1)常温常压下,已知:①H2和CH4的燃烧热(△H)分别为一285.5 kJ·mol-1和一890.0kJ·mol-1;
②H2O(g)=H2O(l) △H= -44.0kJ·mol-1,则△H1=
(2)研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“· ”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会

Ⅱ.实验证明CO2在一定条件下与H2O发生氧再生反应:CO2(g)+ 2H2O(g)
 CH4(g)+2O2(g) △H1= +802.3kJ · mol-1
CH4(g)+2O2(g) △H1= +802.3kJ · mol-1(3)恒压P0条件下,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。

350℃时,用平衡分压代替平衡浓度表示A点的化学平衡常数Kp=
(4)氧再生反应可以通过酸性条件下半导体光催化转化实现:反应机理如图所示:

①光催化CO2转化为CH4时,其阴极的电极反应式为
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到 400℃之间,CH4生成速率加快的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】为了实现“碳中和”、“碳达峰”,氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知:①乙醇、水蒸气重整制氢的部分反应过程如图1所示。

②反应Ⅰ和反应Ⅱ的平衡常数(K)随温度(T)的变化曲线如图2所示。

(1)反应Ⅰ中,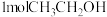 参与反应后的热量变化是
参与反应后的热量变化是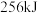 ,则该反应的热化学方程式为
,则该反应的热化学方程式为___________ 。
(2)一定温度下,在一恒容密闭容器中发生反应Ⅰ,下列叙述能说明此反应达到化学平衡状态的是___________(填标号)。
(3)在一恒容密闭容器中按不同进料比通入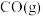 与
与 发生反应Ⅱ,在不同温度时测得
发生反应Ⅱ,在不同温度时测得 的平衡转化率如图3所示。
的平衡转化率如图3所示。

①B、C两点对应的反应温度分别为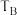 和
和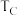 ,则
,则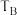
___________ 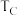 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
②A点对应温度下,反应Ⅱ的化学平衡常数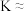
___________ 。
③若向A点对应的平衡体系中再充入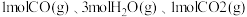 和
和 ,此时平衡向
,此时平衡向___________ (填“正反应”或“逆反应”)方向移动。
④其他条件不变,下列措施可以增大平衡时的 的体积分数的是
的体积分数的是___________ (填标号)。
A.投入一定量的 B.增大压强 C.降低温度
B.增大压强 C.降低温度
已知:①乙醇、水蒸气重整制氢的部分反应过程如图1所示。

②反应Ⅰ和反应Ⅱ的平衡常数(K)随温度(T)的变化曲线如图2所示。

(1)反应Ⅰ中,
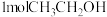 参与反应后的热量变化是
参与反应后的热量变化是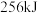 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)一定温度下,在一恒容密闭容器中发生反应Ⅰ,下列叙述能说明此反应达到化学平衡状态的是___________(填标号)。
A. |
| B.混合气体压强不再发生变化 |
C.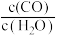 不再发生变化 不再发生变化 |
| D.混合气体密度不再发生变化 |
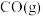 与
与 发生反应Ⅱ,在不同温度时测得
发生反应Ⅱ,在不同温度时测得 的平衡转化率如图3所示。
的平衡转化率如图3所示。
①B、C两点对应的反应温度分别为
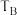 和
和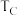 ,则
,则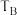
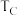 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。②A点对应温度下,反应Ⅱ的化学平衡常数
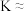
③若向A点对应的平衡体系中再充入
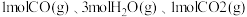 和
和 ,此时平衡向
,此时平衡向④其他条件不变,下列措施可以增大平衡时的
 的体积分数的是
的体积分数的是A.投入一定量的
 B.增大压强 C.降低温度
B.增大压强 C.降低温度
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2 (g)、CO2(g)和H2O(l)的热化学方程式______________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①下列说法不能作为判断该反应达到化学平衡状态标志的是___________ ;
A.活性炭的质量 B.v正(N2) = 2v逆(NO) C.容器内压强保持不变 D.容器内混合气体的密度保持不变 E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
②在T℃时,该反应的平衡常数为______________ (小数点后保留两位);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________ ;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______ (填“正向移动”、“逆向移动”或“不移动”)。
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
①A电极的电极反应式为________________ 。
②下列关于该电池的说法正确的是________ 。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2 (g)、CO2(g)和H2O(l)的热化学方程式
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:| NO | N2 | CO2 | |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是
A.活性炭的质量 B.v正(N2) = 2v逆(NO) C.容器内压强保持不变 D.容器内混合气体的密度保持不变 E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
②在T℃时,该反应的平衡常数为
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为
②下列关于该电池的说法正确的是
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】碳中和是指企业,团体或个人测算在一定时间内直接或间接产生的温室气体排放总量,通过植树造林、节能减排等形式,以抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。研究显示,全球二氧化碳排放量增速趋缓。 的综合利用是解决温室问题的有效途径。
的综合利用是解决温室问题的有效途径。
(1)一种途径是将 转化成有机物实现碳循环。如:
转化成有机物实现碳循环。如:
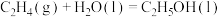
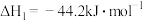
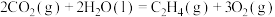
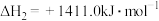
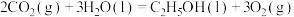

___________
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:


现有两个相同的恒容绝热(与外界没有热量交换)密闭容器甲、乙,在甲中充入lmol 和4mol
和4mol  ,在乙中充入1mol
,在乙中充入1mol  和2mol
和2mol  (g),300℃下开始反应。达到平衡时,容器中的压强
(g),300℃下开始反应。达到平衡时,容器中的压强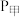
___________ 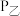 (填“>”“=”或“<”),
(填“>”“=”或“<”), 的物质的量分数
的物质的量分数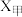
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(3) 经催化加氢可以生成低碳怪,主要有两个竞争反应:
经催化加氢可以生成低碳怪,主要有两个竞争反应:
反应I:
反应Ⅱ: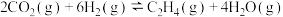
在1L恒容密闭容器中充入1mol 和4mol
和4mol  测得平衡时有关物质的物质的量随温度变化如图所示。
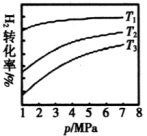
测得平衡时有关物质的物质的量随温度变化如图所示。 ℃时,
℃时, 的转化率为
的转化率为___________ 。 ℃时,反应I的平衡常数
℃时,反应I的平衡常数
___________ 。

(4)已知 催化加氢合成乙醇的反应原理为
催化加氢合成乙醇的反应原理为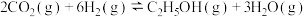
 ,m代表起始时的投料比,即
,m代表起始时的投料比,即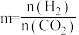 。图中投料比相同,温度
。图中投料比相同,温度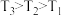 ,则
,则
___________ (填“>”或“<”)0。
 的综合利用是解决温室问题的有效途径。
的综合利用是解决温室问题的有效途径。(1)一种途径是将
 转化成有机物实现碳循环。如:
转化成有机物实现碳循环。如: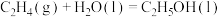
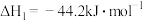
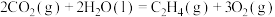
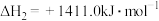
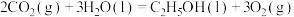

(2)在一定条件下,二氧化碳转化为甲烷的反应如下:


现有两个相同的恒容绝热(与外界没有热量交换)密闭容器甲、乙,在甲中充入lmol
 和4mol
和4mol  ,在乙中充入1mol
,在乙中充入1mol  和2mol
和2mol  (g),300℃下开始反应。达到平衡时,容器中的压强
(g),300℃下开始反应。达到平衡时,容器中的压强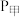
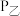 (填“>”“=”或“<”),
(填“>”“=”或“<”), 的物质的量分数
的物质的量分数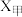
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(3)
 经催化加氢可以生成低碳怪,主要有两个竞争反应:
经催化加氢可以生成低碳怪,主要有两个竞争反应:反应I:

反应Ⅱ:
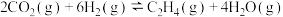
在1L恒容密闭容器中充入1mol
 和4mol
和4mol  测得平衡时有关物质的物质的量随温度变化如图所示。
测得平衡时有关物质的物质的量随温度变化如图所示。 ℃时,
℃时, 的转化率为
的转化率为 ℃时,反应I的平衡常数
℃时,反应I的平衡常数

(4)已知
 催化加氢合成乙醇的反应原理为
催化加氢合成乙醇的反应原理为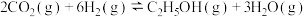
 ,m代表起始时的投料比,即
,m代表起始时的投料比,即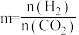 。图中投料比相同,温度
。图中投料比相同,温度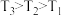 ,则
,则

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】氯乙烯是合成聚氯乙烯的单体,工业上常用乙烯氧氯化法制取,其主要反应为 。
。
(1)每生成1 g氯乙烯,放出_______ J的热量。
(2)工业上要提高氯乙烯的平衡产率,可采取的措施有_______ (填标号)。
A.升高温度 B.增大压强
C.不断分离出水蒸气 D.加入合适的催化剂
(3)催化剂的选择是合成氯乙烯的核心技术之一 ,使用催化剂1(反应的活化能为Ea1)或催化剂2(反应的活化能为Ea2)合成时,氯乙烯的生成速率与温度的关系如图。Ea1_______ (填“>”、“=”或“<”,下同)Ea2;当反应方程式相同时,使用催化剂1(反应的焓变为 或催化剂2(反应的焓变为
或催化剂2(反应的焓变为 )时,
)时,
_______  ;在催化剂1的作用下,200℃时氯乙烯的生成速率为0的原因是
;在催化剂1的作用下,200℃时氯乙烯的生成速率为0的原因是_______ 。

(4)保持体系压强始终为0. 1 MPa,起始时充入4 mol C2H4、2 mol Cl2和1 mol O2,反应达到平衡后,5种组分的物质的量分数随温度T的变化如图所示。

①图中表示C2H4、H2O变化的曲线分别是_______ 、_______ 。(填标号)
②图中P点对应温度下,乙烯的转化率为_______ ,此时反应平衡常数Kp=_______ 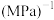 。
。
 。
。(1)每生成1 g氯乙烯,放出
(2)工业上要提高氯乙烯的平衡产率,可采取的措施有
A.升高温度 B.增大压强
C.不断分离出水蒸气 D.加入合适的催化剂
(3)催化剂的选择是合成氯乙烯的核心技术之一 ,使用催化剂1(反应的活化能为Ea1)或催化剂2(反应的活化能为Ea2)合成时,氯乙烯的生成速率与温度的关系如图。Ea1
 或催化剂2(反应的焓变为
或催化剂2(反应的焓变为 )时,
)时,
 ;在催化剂1的作用下,200℃时氯乙烯的生成速率为0的原因是
;在催化剂1的作用下,200℃时氯乙烯的生成速率为0的原因是
(4)保持体系压强始终为0. 1 MPa,起始时充入4 mol C2H4、2 mol Cl2和1 mol O2,反应达到平衡后,5种组分的物质的量分数随温度T的变化如图所示。

①图中表示C2H4、H2O变化的曲线分别是
②图中P点对应温度下,乙烯的转化率为
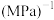 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
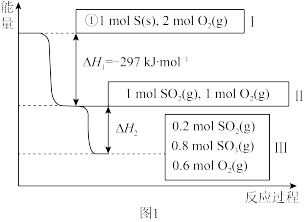
(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
①写出能表示硫的燃烧热的热化学方程式:_____________________________
②ΔH2=__________ kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________ ;此时该反应________ (填“放出”或“吸收”)________ kJ的能量。
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________ mol·L-1·min-1。 此条件下该反应的平衡常数为__________
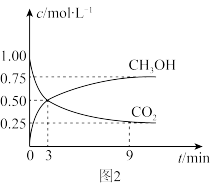
②能说明上述反应达到平衡状态的是______ (填编号)
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________ (填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂

(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:①写出能表示硫的燃烧热的热化学方程式:
②ΔH2=
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=
②能说明上述反应达到平衡状态的是
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
您最近一年使用:0次



